Levofloxacin: acid (+)–9–Fluoro–2,3–dihydro–3–methyl–10–(4–methyl–1– piperazinyl)–7–oxo–7H–pyrido[1,2,3–d]–1,4–benzoxazin–6–carboxylic.
Levofloxacin là đồng phân quang học của ofloxacin. Hiệu lực in vitro của levofloxacin mạnh gấp hai lần ofloxacin đối với nhiều vi khuẩn hiếu khí Gram âm và Gram dương, Bao gồm trực khuẩn lao. Nồng độ trong huyết tương cho bởi hai dạng uống và tiêm tĩnh mạch được cho là tương đương.
- Hoạt tính kháng khuẩn
Hiệu lực trên phổ kháng khuẩn của các quinolon thế hệ I cộng thêm hoạt tính
trên:
Tụ cầu khuẩn nhạy meti (mạnh) và kháng meti (yếu). Lậu cầu khuẩn, màng não cầu khuẩn.
Haemophilus influenza.
Trực khuẩn mủ xanh.
Mầm nội bào: Chlamydia, Mycoplasma.
- Cơ chế tác động và cơ chế đề kháng
Các quinolon ức chế sự tái bản hay sao chép của phân tử DNA bằng cách ức chế hai enzym topoisomerase II (hay DNA–gyrase) và topoisomerase IV ở vi khuẩn. Các enzym này có vai trò giúp cho sự xoắn và tháo xoắn DNA là hiện tượng cần thiết cho sự sao chép hay tái bản ở vi khuẩn. Ở vi khuẩn Gram âm, DNA–gyrase nhậy cảm với tác động của quinolon hơn topoisomerase IV và ngược lại, ở vi khuẩn Gram dương topoisomerase IV là điểm tác động chính của các quinolon.
Sự đề kháng của vi khuẩn với quinolon có nguồn gốc nhiễm sắc thể do sự đột biến gien tạo men DNA–gyrase hay topoisomerase IV, có sự đề kháng chéo giữa các fluoroquinolon.
2.4. TÌNH HÌNH SỬ DỤNG KHÁNG SINH VÀ ĐỀ KHÁNG KHÁNG SINH HIỆN NAY
2.4.1. Tình hình sử dụng kháng sinh và đề kháng kháng sinh trên thế giới
Theo báo cáo mới nhất của Tổ chức Y tế thế giới (WHO) công bố ngày 30/4/2014, tình hình kháng thuốc kháng sinh đang đe dọa nghiêm trọng đến sức khỏe cộng đồng trên thế giới.
Dữ liệu thu thập từ 114 quốc gia cho thấy tình hình đề kháng kháng sinh của vi khuẩn trong điều trị các bệnh nhiễm trùng cho đến nay đang là mối đe dọa nghiêm trọng. Vi khuẩn đề kháng kháng sinh không còn là một dự đoán ở tương lai, mà là đang xảy ra và có khả năng ảnh hưởng đến bất kỳ ai, với mọi lứa tuổi, ở bất cứ nơi nào trên thế giới.
Theo trợ lý Tổng giám đốc WHO, tiến sĩ Keiji Fukuda, cần phối hợp hành động khẩn cấp nếu không muốn thế giới phải đối mặt với một kỷ nguyên hậu kháng sinh,
khi đó các bệnh nhiễm trùng hoặc các vết thương nhẹ trước đây có thể chữa trị được thì nay có thể gây ra chết người do hiện tượng đề kháng kháng sinh của vi khuẩn. Do đó, cần nỗ lực hơn nữa trong việc ngăn chặn nhiễm trùng, thay đổi cách sản xuất, quy định và sử dụng thuốc kháng sinh một cách hợp lý hơn.
Báo cáo cho biết đề kháng kháng sinh đang diễn ra trên nhiều tác nhân gây bệnh khác nhau, tuy nhiên, báo cáo “Kháng thuốc: Báo cáo toàn cầu” (“Antimicrobial resistance: global report on surveillance”) chỉ tập trung vào kháng sinh với bảy loại vi khuẩn khác nhau gây ra các bệnh nghiêm trọng, phổ biến như: nhiễm trùng máu, tiêu chảy, viêm phổi, nhiễm trùng đường tiết niệu và bệnh lậu.
Kháng với các kháng sinh carbapenem lan rộng ra tất cả các khu vực trên thế giới. Các kháng sinh carbapenem (gồm imipenem, meropenem, ertapenem và doripenem) điều trị các bệnh nhiễm trùng do vi khuẩn đường ruột Klebsiella pneumoniae (phế trực khuẩn Friedlander) gây ra. K. pneumoniae là nguyên nhân chính gây nhiễm khuẩn bệnh viện như viêm phổi, nhiễm trùng máu, nhiễm trùng ở trẻ sơ sinh và bệnh nhân điều trị tăng cường. Ở một số nước, kháng sinh carbapenem không còn hiệu quả điều trị với hơn một nửa số người nhiễm trùng K. pneumoniae.
Kháng với thuốc kháng khuẩn fluoroquinolon trong việc điều trị nhiễm trùng đường tiểu do vi khuẩn E. coli gây ra. Các loại thuốc này, gần như không có hiện tượng kháng vào những năm 1980 khi vừa mới ra đời, tuy nhiên ngày nay, với hơn một nửa số bệnh nhân ở nhiều nơi trên thế giới lại không có hiệu quả điều trị.
Ở Áo, Úc, Canada, Pháp, Nhật Bản, Na Uy, Slovenia, Nam Phi, Thụy Điển và Vương quốc Anh xảy ra kháng với thuốc kháng sinh cephalosporin thế hệ ba. Thuốc kháng sinh cephalosporin không còn hiệu nghiệm trong việc điều trị bệnh lậu trong khi mỗi ngày thế giới có hơn 1 triệu người nhiễm bệnh lậu.
Kháng kháng sinh làm kéo dài thời gian bị bệnh, tăng chi phí chăm sóc sức khỏe và tăng nguy cơ tử vong. Ước tính khả năng tử vong của những người có vi khuẩn Staphylococcus aureus kháng methicillin (MRSA) là 64 %, cao hơn so với những người không xảy ra kháng.
So sánh một số điểm nổi bật trong báo cáo của các WHO khu vực cho thấy: hầu như tất cả các khu vực đều xảy ra kháng cao với methicillin trong điều trị Staphylococcus aureus; trong đó, Đông Nam Á hơn 25 %, Đông Địa Trung Hải hơn 50 %, Châu Âu 60 %, Châu Phi 80 %, Tây Thái Bình Dương 80 %, Châu Mỹ 90 %. Ngoài ra, 3 khu vực là Châu Mỹ, Đông Địa Trung Hải, Đông Nam Á xảy ra kháng cephalosporin thế hệ thứ ba trong điều trị nhiễm trùng K. pneumoniae và E. coli, fluoroquinolone trong điều trị nhiễm trùng E. coli; khu vực Châu Phi kháng với cephalosporin thế hệ thứ ba và fluoroquinolon trong điều trị nhiễm trùng E. coli; Tây Thái Bình Dương kháng với fluoroquinolon trong điều trị nhiễm trùng E. coli và
cephalosporin thế hệ thứ ba trong điều trị nhiễm trùng K. pneumoniae; khu vực Châu Âu xảy ra kháng với cephalosporin thế hệ thứ ba trong điều trị K. pneumoniae. (http://www.impehcm.org.vn)
2.4.2. Tình hình sử dụng kháng sinh và đề kháng kháng sinh tại Việt Nam
Tại hội thảo “Kháng kháng sinh–từ nghiên cứu tới hành động” Thứ trưởng Bộ Y tế Nguyễn Thanh Long cho biết, tình trạng kháng kháng sinh ở Việt Nam được xếp ở tốp cao nhất thế giới. Có tới 60 % người lành mang vi khuẩn kháng kháng sinh, đặc biệt là xuất hiện chủng kháng, chủng đa kháng kháng sinh.
Theo Nguyễn Văn Kính chủ tịch nhóm nghiên cứu quốc gia GARP Việt Nam tình trang kháng kháng sinh ở Việt Nam đã ở mức độ cao. Trong những năm gần đây, một số nghiên cứu cho thấy:
Ở Việt Nam, các chủng Streptococcus pneumoniae một trong những nguyên nhân thường gặp nhất gây nhiễm khuẩn hô hấp kháng penicillin 71,4 % và kháng erythromycin 92,1 %. Trong mạng lưới giám sát các căn nguyên kháng thuốc Châu Á năm 2000–2001 Việt Nam là nước có tỉ lệ phổ biến cao nhất trong số 11 nước.
75 % các chủng pneumococci kháng với ba hoặc trên ba loại kháng sinh.
57 % Haemophilus influenzae một căn nguyên vi khuẩn phổ biến khác phân lập từ bệnh nhi ở Hà Nội năm 2000–2002 kháng với ampicillin. Tỉ lệ tương tự cũng được báo cáo ở Nha trang.
Vi khuẩn phân lập từ trẻ bị tiêu chảy có tỉ lệ kháng cao. Đối với hầu hết các trường hợp, bù nước và điện giải là biện pháp xử trí hiệu quả nhất đối với bệnh tiêu chảy, khoảng 1/4 số trẻ đã được chỉ định kháng sinh trước khi đưa đến bệnh viện.
Các vi khuẩn Gram âm đa số là kháng kháng sinh enterobacteriaceae: hơn 25
% số chủng phân lập tại một bệnh viện thành phố Hồ Chí Minh kháng với kháng sinh cephalosporin thế hệ ba, theo nghiên cứu năm 2000–2001. Theo báo cáo của một nghiên cứu khác năm 2009 cho thấy, 42 % các chủng vi khuẩn Gram âm kháng với ceftazidine, 63 % kháng với gentamicin và 74 % kháng với acid nalidixic tại cả bệnh viện và trong cộng đồng.
Xu hướng gia tăng của tình trạng kháng kháng sinh cũng thể hiện rõ rệt. Những năm 1990, tại Thành phố Hồ Chí Minh, chỉ có 8 % các chủng pneumococcus kháng với penicillin. Đến năm 1999–2000, tỉ lệ này đã tăng lên 56 %. Xu hướng tương tự cũng được báo cáo tại các tỉnh phía Bắc Việt Nam.
Do tỉ lệ kháng kháng sinh cao, nhiều liệu pháp kháng sinh được khuyến cáo trong các tài liệu hướng dẫn điều trị đã không còn hiệu lực. Do các bệnh nhiễm khuẩn vẫn là các bệnh phổ biến ở Việt Nam, việc tiếp cận với các kháng sinh có hiệu lực giữ vai trò rất quan trọng. Tỉ lệ kháng kháng sinh gia tăng như hiện nay là mối hiểm họa đối với hiệu quả của các liệu pháp điều trị bằng kháng sinh.
2.5. SƠ LƯỢC VỀ ĐIA ĐIỂM NGHIÊN CỨU
Thành phố Cần Thơ là đô thị trực thuộc Trung ương, nằm trong vùng trung–hạ lưu và ở vị trí trung tâm châu thổ đồng bằng sông Cửu Long, trải dài trên 55 km dọc bờ Tây sông Hậu, tổng diện tích tự nhiên 1408,9 km2. Phía Bắc giáp tỉnh An Giang; phía Đông Bắc giáp tỉnh Đồng Tháp; phía Đông giáp tỉnh Vĩnh Long; phía Tây giáp tỉnh Kiên Giang; phía Nam giáp tỉnh Hậu Giang.
Dân số năm 2015 là 1248 nghìn người. Dân tộc: Kinh, Khmer, Hoa, Chăm...
Cần Thơ có khí hậu nhiệt đới gió mùa, ít bão, quanh năm nóng ẩm, không có mùa lạnh. Mùa mưa từ tháng 5 đến tháng 11, mùa khô từ tháng 12 đến tháng 4 năm sau. Nhiệt độ trung bình trong năm là 28 oC, độ ẩm trung bình năm 82 % – 87 % (http://www.vietnamtourism.com/index.php/tourism/items/1288).
Tại Cần Thơ có một số bệnh viện như: bệnh viện đa khoa thành phố Cần Thơ, bệnh viện Nhi đồng, bệnh viện Tai Mũi Họng, bệnh viện Mắt – Răng hàm mặt, bệnh viện Y học cổ truyền, bệnh viện Da liễu, bệnh viện Tâm thần, bệnh viện Lao và Bệnh phổi, bệnh viện Ung bướu, bệnh viện Huyết học – truyền máu, Bệnh viện Phụ sản, trung tâm Pháp Y, trung tâm Y tế dự phòng thành phố, trung tâm Giám định Y khoa,trung tâm Chăm sóc sức khỏe sinh sản, trung tâm Phòng chống HIV/AID, các bệnh viện thuộc các quận, huyện. Các bệnh viện tư nhân như bệnh viện Hoàn mỹ Cần Thơ.
(http://soytecantho.vn)
CHƯƠNG 3. PHƯƠNG PHÁP NGHIÊN CỨU
3.1. THỜI GIAN VÀ ĐỊA ĐIỂM NGHIÊN CỨU
- Thời gian : Từ tháng 5/2015 đến tháng 5/2017.
- Địa điểm :
Phòng thí nghiệm vi sinh vật–ký sinh trùng trường Đại học Tây Đô.
Bệnh viện Da liễu Cần Thơ và phòng khám Tiến sĩ–Bác sĩ Huỳnh Văn Bá (14/14 Lý Tự Trọng, Q.Ninh Kiều, TP Cần Thơ ).
3.2. PHƯƠNG TIỆN NGHIÊN CỨU
3.2.1. Nguyên vật liệu
Mẫu bệnh phẩm: bã và nhân mụn trứng cá lấy từ bệnh nhân mụn trứng cá.
3.2.2. Dụng cụ và thiết bị thí nghiệm
Sử dụng các trang thiết bị hiện có tại phòng thí nghiệm vi sinh vật–trường Đại học Tây Đô.
Các dụng cụ thu mẫu và phân lập P. acnes: ống nghiệm có nắp, tăm bông lấy mẫu, đĩa petri, que cấy, lame, đèn cồn, tủ cấy vi sinh vật, nồi hấp khử trùng, cân điện tử Sartorius, tủ sấy EHRET (Đức), tủ ủ vi sinh vật, tủ lạnh giữ mẫu –40 oC Hitachi (Nhật Bản), máy vortex, bộ micropipet Gibson P10, P20, P50, P200, P1000 (Đức), bình hút ẩm, kim tiêm 1 ml.
Các thiết bị và dụng cụ khác: máy vi tính lưu trữ dữ liệu, máy chụp hình kỹ thuật số Canon ÍXUS 220HS (Nhật Bản) , kính hiển vi Olympus CX–21 (Nhật Bản)…
3.2.3 Hóa chất và môi trường
3.2.3.1 Hóa chất
- Hóa chất kiểm tra catalase: dung dịch oxy già 3 % (công ty TNHH Dược phẩm Phương Nam).
- Hóa chất dùng nhuộm Gram vi khuẩn P. acnes: dung dịch crystal violet, dung dịch lugol, ethanol 95 %, dung dịch safranin (Bộ nhuộm Gram Công ty Nam Khoa, Việt Nam).
- Thuốc thử Kovac’s dùng để thử khả năng sinh indol (Mecrk).
- Hóa chất dùng thử khả năng dịch hóa gelatin: gelatin, pepton.
- Hóa chất dùng thử khả năng phản ứng nitrat hóa: pepton, KNO3.
- Đĩa kháng sinh: clindamycin, cefuroxim, erythromycin, levofloxacin, tetracyclin, trimethoprim/sulfamethoxazol (Công ty Nam Khoa, Việt Nam).
3.2.3.2 Môi trường
- Môi trường phân lập và nuôi cấy vi khuẩn Propionibacterium acnes : môi trường Trypticase-Yeast Extract-Heart extract-Glycerol Agar (Masamichi kishisita, 1980).
Bảng 3.1 Công thức môi trường TYEG agar ( pH 6.8 )
Tỉ lệ ( %) | |
Trypticase (BBL) Yeast extract (BBL) Heart extract Nissui Glycerol NaCl K2HPO4 L-cysteine-HCl Bromocresol purple Agar | 1,5 0,5 0,5 1,0 0,2 0,2 0,03 0,002 1,5 |
Có thể bạn quan tâm!
-
 Khảo sát tình hình đề kháng kháng sinh của vi khuẩn gây bệnh mụn trứng cá Probionibacterium acnes tại thành phố Cần Thơ - 1
Khảo sát tình hình đề kháng kháng sinh của vi khuẩn gây bệnh mụn trứng cá Probionibacterium acnes tại thành phố Cần Thơ - 1 -
 Khảo sát tình hình đề kháng kháng sinh của vi khuẩn gây bệnh mụn trứng cá Probionibacterium acnes tại thành phố Cần Thơ - 2
Khảo sát tình hình đề kháng kháng sinh của vi khuẩn gây bệnh mụn trứng cá Probionibacterium acnes tại thành phố Cần Thơ - 2 -
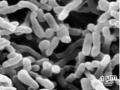
 Vi Khuẩn Propionibacterium Acnes (Douglas And Gunter, 1946) Giới: Bacteria
Vi Khuẩn Propionibacterium Acnes (Douglas And Gunter, 1946) Giới: Bacteria -
 Đặc Điểm Nhóm Bệnh Nhân Mụn Trứng Cá Nghiên Cứu
Đặc Điểm Nhóm Bệnh Nhân Mụn Trứng Cá Nghiên Cứu -
 Kết Quả Định Danh Các Dòng Vi Khuẩn Phân Lập Được Bằng Phương Pháp Sinh Hóa
Kết Quả Định Danh Các Dòng Vi Khuẩn Phân Lập Được Bằng Phương Pháp Sinh Hóa -
 Mối Quan Hệ Giữa Kết Quả Phân Lập Các Dòng Vi Khuẩn Propionibacterium Acnes Và Một Số Yếu Tố Khảo Sát
Mối Quan Hệ Giữa Kết Quả Phân Lập Các Dòng Vi Khuẩn Propionibacterium Acnes Và Một Số Yếu Tố Khảo Sát
Xem toàn bộ 108 trang tài liệu này.

- Môi trường Trypton soyar broth 1 % dùng để kiểm tra khả năng sinh indol.
- Môi trường sử dụng khảo sát kháng sinh đồ: môi trường MHA bổ sung dịch chiết tim không bổ sung thành phần Bromocresol purple.
3.3. PHƯƠNG PHÁP NGHIÊN CỨU
3.3.1. Thiết kế nghiên cứu: nghiên cứu thực nghiệm khoa học.
3.3.2. Cỡ mẫu
Thu 100 mẫu bệnh phẩm lấy từ bệnh nhân mụn trứng cá, tại bệnh viện Da Liễu Cần Thơ và phòng khám Tiến sĩ–Bác sĩ Huỳnh Văn Bá đủ tiêu chuẩn chọn mẫu và không thuộc tiêu chuẩn loại trừ để tiến hành nghiên cứu.
3.3.3. Tiêu chuẩn chọn mẫu bệnh (Huỳnh Văn Bá, 2009) Bệnh nhân mụn trứng cá tự nguyện tham gia nghiên cứu.
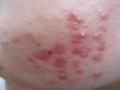
Bệnh được chẩn đoán rõ ràng, không phân biệt giới tính và lứa tuổi, có các biểu hiện sau:
+ Tổn thương cơ bản: sẩn đỏ, mụn mủ, nang, nốt, nhân trứng cá.
+ Vị trí: vùng da ở mặt, có thể ở cổ, ngực và lưng.
3.3.4. Tiêu chuẩn loại trừ (Huỳnh Văn Bá, 2009)
- Những trường hợp sử dụng corticoid qua đường toàn thân (tiêm, uống).
- Những trường hợp bệnh da do có các bệnh lý nội khoa như: bệnh tiểu đường, suy gan, suy thận.
- Bệnh nhân mụn trứng cá đang dùng kháng sinh điều trị.
3.3.5. Phương pháp thu thập mẫu nghiên cứu
Phối hợp Bác sĩ phòng khám chuyên khoa da liễu và phòng tư vấn bệnh tại bệnh viện Da liễu Cần Thơ.
Hỏi bệnh: tuổi, giới tính, nghề nghiệp, địa chỉ, một số yếu tố có liên quan đến những bệnh nhân mụn trứng cá: da nhờn, tiền sử gia đình, sử dụng mỹ phẩm có corticoid.
Xác định các đặc điểm lâm sàng
+ Các loại tổn thương: sẩn, mụn mủ, nốt, áp xe, giãn mạch.
+ Vị trí: hai bên má, trán, cầm, mũi, vùng trước ngực, sau vai.
+ Tình trạng da: mức độ da nhờn.
Lấy bã và nhân mụn trứng cá để kiểm tra vi khuẩn bằng cách:
+ Dùng tăm bông thấm dung dịch nước muối sinh lý, quét lấy bệnh phẩm trên da bệnh nhân mụn trứng cá.
+ Đặt ngay vào ống nghiệm vô trùng có chứa 5ml nước muối sinh lý.
+ Mang mẫu bệnh phẩm thu được đến phòng thí nghiệm vi sinh. Mẫu bệnh phẩm không để bên ngoài quá 4 giờ và tiến hành phân lập.
3.3.6. Nội dung nghiên cứu
3.3.6.1. Phân lập các dòng vi khuẩn Propionibacterium acnes
Phân lập để tìm ra các dòng vi khuẩn Propionibacterium acnes gây nhiễm trùng ở mụn.
Theo Hans và Kilian (2010) các mẫu bệnh phẩm sau khi thu về được cấy phân lập trên môi trường TYEG agar, các bước thực hiện sau:
- Pha loãng dung dịch chứa mẫu bệnh phẩm trong nước cất. Sau đó dùng micropipette hút 10 L từ các ống nghiệm có độ pha loãng 10-2, 10-3, 10-4, nhỏ lên môi trường TYEG agar, mỗi nồng độ nhỏ 3 giọt. Ủ kỵ khí trong bình hút ẩm (không chứa các hạt hút ẩm, đốt nến, đậy nắp để tạo điều kiện kỵ khí), ủ 37 oC từ 5–7 ngày, kiểm tra sự xuất hiện khuẩn lạc (màu vàng).
- Chọn khuẩn lạc có màu vàng, đục, mô cao hoàn toàn trên môi trường và làm môi trường từ màu tím chuyển sang màu vàng do khuẩn lạc thuộc giống vi khuẩn Propionibacterium phát triển sinh acid propionic làm giảm pH của môi trường. Tiến hành cấy phân lập trên đĩa môi trường TYEG agar để tiến hành tách ròng (khuẩn lạc rời, nhỏ, có kích thước và màu sắc giống nhau).
- Chọn khuẩn lạc riêng biệt cấy chuyển vào môi trường ống TYEG agar nghiêng xem như ròng (ủ kỵ khí 37 oC từ 1–2 ngày).
- Sau đó quan sát dưới kính hiển vi chọn dòng vi khuẩn hình que và lưu trữ trong TYEG broth bổ sung 20 % glycerol ở -40 oC để làm nguồn vật liệu cho các thí nghiệm tiếp theo.
3.3.6.2. Nhuộm Gram các dòng vi khuẩn phân lập được
Tiến hành nhuộm Gram theo hướng dẫn sử dụng bộ nhuộm Gram của công ty TNHH Nam Khoa.
Chuẩn bị vết bôi: làm sạch lam kính bằng cồn 70 %, nhỏ 1 giọt nước cất vô trùng vào giữa lam kính, dùng que cấy chuyển một ít vi khuẩn từ môi trường ống TYEG agar nghiêng để vào giọt nước tán nhẹ cho vi khuẩn hòa tan vào giọt nước, làm khô trong không khí.
Cố định mẫu: hơ nhanh vết bôi trên ngọn lửa đèn cồn 2–3 lần. Nhỏ dung dịch crystal violet, để 1 phút, rửa nước, thấm khô. Nhỏ dung dịch lugol trong 1 phút, rửa nước, thấm khô.
Nhỏ etanol 95 % giữ khoảng 30 giây hoặc cho cồn chảy qua vết bôi vi khuẩn liên tục đến khi vừa thấy giọt dung dịch không còn màu, rửa nước, thấm khô.
Nhuộm bổ sung bằng dung dịch safranin trong 1 phút, rửa nước, để khô trong không khí.
Quan sát dưới kính hiển vi với vật kính 100X. Vi khuẩn Gram dương có màu tím xanh crystal violet, Gram âm có màu đỏ của safranin.
Kết quả chọn những dòng vi khuẩn có hình que, Gram dương tiếp tục thử catalase.
3.3.6.3. Định danh các dòng vi khuẩn phân lập được bằng một số thử nghiệm sinh hóa
- Thử nghiệm catalse (John Harley and Lansing Prescolt, 2002)
Lấy vài khuẩn lạc trên môi trường thạch TYEG sau 48 giờ ủ. Hòa tan vào giọt nước đã nhỏ sẵn trên lam kính.
Thêm vào một hoặc vài giọt H2O2 3 %.
Quan sát sự hình thành bọt khí và ghi nhận kết quả: nếu dương tính thì có hình thành bọt khí oxi, nếu kết quả âm tính thì không có sự hình thành bọt khí.
Kết quả chọn những dòng vi khuẩn catalase dương tính tiếp tục thử indol.
- Thử indol (John Harley and Lansing Prescolt, 2002)
Cho vào ống nghiệm có nắp đậy 10 ml môi trường Tryptone soyar broth, khử trùng ở 121 oC trong 15 phút, để nguội.
Dùng que cấy lấy một ít khuẩn lạc cần kiểm tra chủng vào, đậy nắp, ủ kỵ khí 48 giờ ở 37 oC cho vi khuẩn phát triển.
Mỗi ống nghiệm cho vài giọt thuốc thử Kovac’s. Quan sát và ghi nhận kết quả
+ Dương tính: xuất hiện vòng màu đỏ trên bề mặt môi trường.
+ Âm tính: vòng màu vàng của thuốc thử không thay đổi.
Kết quả chọn những dòng vi khuẩn indol dương tính tiếp tục thử khả năng dịch hóa gelatin.