2.2. VI KHUẨN PROPIONIBACTERIUM ACNES (Douglas and Gunter, 1946) Giới: Bacteria
Ngành: Actinobacteria
Bộ: Actinomycetales
Họ: Propionibacteriaceae
Chi: Propionibacterium
Loài: Propionibacterium acnes
2.2.1. Đặc điểm vi khuẩnPropionibacterium acnes
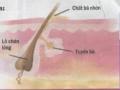
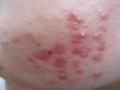
Propionibacterium acnes đóng vai trò quan trọng trong bệnh mụn trứng cá. P. acnes là một loại vi khuẩn thuộc hệ vi sinh vật tự nhiên của da phát triển sâu bên trong của lỗ chân lông nơi có nhiều bã nhờn như mặt, ngực, lưng. P. acnes còn được tìm thấy trên da trẻ sơ sinh, nhưng sự bắt đầu thực sự trong 1–3 năm trước khi trưởng thành (http://emedicine.medscape.com). Trong thời gian này, số lượng tế bào bệnh mụn trứng cá khoảng 10–106 tế bào/cm2.
P. acnes có thể gây hỏng mô nếu tồn tại trên mô do các sản phẩm chuyển hóa (acetate, propionate, indol, porphyrin), enzym và các sản phẩm thoái dưỡng của glucose và fructose. Hai yếu tố quyết định độc lực của P. acnes là các enzym ngoại bào và các sản phẩm có hoạt tính sinh học.
Vi khuẩn P. acnes là vi khuẩn Gram dương có thành tế bào dày giàu peptidoglycan và lippolysacharid giúp bảo vệ chúng khỏi môi trường, hình que, không sinh nha bào, đường kính 0,5–0,8 micromet, dài 3–4 micromet, phát triển chậm trong môi trường nuôi cấy sau 5–7 ngày khuẩn lạc xuất hiện, thích hợp ở pH từ 5–8, nhiệt độ 37 oC. Trên môi trường TYEG agar có bổ sung bromocresol purple khuẩn lạc của P. acnes mô cao và có màu vàng. Điều kiện môi trường nuôi cấy khác nhau khuẩn lạc sẽ xuất hiện khác nhau, tùy thuộc vào thời gian và môi trường sẽ có kích thước khác nhau trong khoảng 0,5–4 mm. Trong điều kiện kị khí (CO2:N2=10 %:90 %) có khả năng sản xuất acid propionic, nitrat, catalase và indol dương tính, dịch hóa gelatine (Masamichi kishishita, 1980).
P. acnes có thể phát triển trên môi trường chứa chỉ tám acid amin (Wilson, 2005). P. acnes được trữ ở nhiệt độ -40 oC trong môi trường BHI bổ sung 20 % glycerol (Jappe et al., 2002). P. acnes có thể tồn tại trong vòng tám tháng mà không cần bổ sung môi trường (Csuka et al., 2004).
Bảng 2.2 Sản phẩm ngoại bào của P. acnes (Aedy et al., 1994)
Hợp chất | Vai trò | |
Lipase | Triglycerid | Dinh dưỡng, sản xuất acid béo tự do, tăng kết dính với tế bào. |
Phospholipase C | Phospholipid | Gây rối loạn chức năng màng tế bào. |
Protease | Collagen, Keratine | Dinh dưỡng, tăng hoạt tính, sản sinh chemotaxins, phân hủy protein, xâm lấn mô lân cận. |
Hyaluronidase, neuraminidase | Mucopolysaccharid | Xâm lấn mô lân cận, xuất huyết dưới da. |
Acid phosphatase | Đường phosphase | Dinh dưỡng |
Bacteriocins | Kháng vi khuẩn khác | |
Histamin,trytamin | Cơ động mạch | Gây viêm cấp tính |
Có thể bạn quan tâm!
-
 Khảo sát tình hình đề kháng kháng sinh của vi khuẩn gây bệnh mụn trứng cá Probionibacterium acnes tại thành phố Cần Thơ - 1
Khảo sát tình hình đề kháng kháng sinh của vi khuẩn gây bệnh mụn trứng cá Probionibacterium acnes tại thành phố Cần Thơ - 1 -
 Khảo sát tình hình đề kháng kháng sinh của vi khuẩn gây bệnh mụn trứng cá Probionibacterium acnes tại thành phố Cần Thơ - 2
Khảo sát tình hình đề kháng kháng sinh của vi khuẩn gây bệnh mụn trứng cá Probionibacterium acnes tại thành phố Cần Thơ - 2 -
 Tình Hình Sử Dụng Kháng Sinh Và Đề Kháng Kháng Sinh Hiện Nay
Tình Hình Sử Dụng Kháng Sinh Và Đề Kháng Kháng Sinh Hiện Nay -
 Đặc Điểm Nhóm Bệnh Nhân Mụn Trứng Cá Nghiên Cứu
Đặc Điểm Nhóm Bệnh Nhân Mụn Trứng Cá Nghiên Cứu -
 Kết Quả Định Danh Các Dòng Vi Khuẩn Phân Lập Được Bằng Phương Pháp Sinh Hóa
Kết Quả Định Danh Các Dòng Vi Khuẩn Phân Lập Được Bằng Phương Pháp Sinh Hóa
Xem toàn bộ 108 trang tài liệu này.
Do cấu trúc thành tế bào nên P. acnes có khả năng chống lại đại thực bào và có thể tồn tại trong đại thực bào một thời gian dài, kích thích phản ứng miễn dịch liên tục và lâu dài, gây viêm nên tình trạng tổn thương viêm của mụn trứng cá thường kéo dài (Webster et al.,1985). P. acnes có thể hình thành những khối vi khuẩn kị khí kết dính được gọi là màng sinh học dùng để giữ chặt và bảo vệ các vi khuẩn tại nơi nhiễm trùng do chúng được bảo vệ bởi kháng sinh và hệ thống miễn dịch của tế bào chủ (Coates et al., 2002).
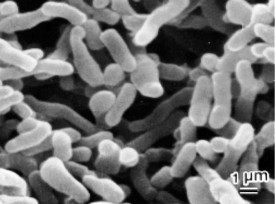
Hình 2.3 Vi khuẩn Propionibacterium acnes (Nguồn: Jappe et al.,2002)
2.2.2. Phân loại vi khuẩn Propionibacterium acnes
P. acnes được chia thành 5 dạng khác nhau dựa vào quá trình lên men, sử dụng đường ribose, erythritol và sorbitol. P. acnes thành hai loại: loại I đường Glactose tham gia cấu tạo nên thành tế bào, loại II chỉ có đường Mantose trong cấu tạo thành tế bào dựa trên xét nghiệm huyết thanh học và phân tích thành phần đường trên thành tế bào (Johnson & Cummins, 1972). P. acnes được chia thành hai loại I và II dựa vào sự
khác biệt về kiểu gen dựa trên biến thể về kiểu gen (recA, hly) (McDowell, 2005). Gần đây có thêm loại III trên da người bị dị ứng ( McDowell et al., 2008).
2.2.3. Những nghiên cứu về điều trị vi khuẩn gây mụn Propionibacterium acnes.
Nghiên cứu tỉ lệ hiện mắc Propionibacterium acnes và sự đề khángin vitro đối với kháng sinh ở bệnh nhân mụn trứng cá thông thường tại bệnh viện Da liễu TP Hồ Chí Minh năm 2011–2012 của Nguyễn Thanh Hùng và Nguyễn Tất Thắng.
Propionibacterium acnes kháng thuốc kháng sinh ở bệnh nhân bị mụn trứng cá. (James J. L et al., 1983).
Tổng quan hệ thống về Propionibacterium acnes kháng thuốc kháng sinh toàn thân. (Cooper A. J, 1999).
Các vi khuẩn propionibic kháng erythromycin trong các bệnh nhân điều trị bằng kháng sinh điều trị mụn: kết hợp với thất bại điều trị. (E.Anne Eady et al., 1989).
Sự phát triển của kháng kháng sinh do điều trị bằng kháng sinh của mụn trứng cá: một đánh giá. (Patel M et al., 2010).
2.3. TỔNG QUAN VỀ CÁC LOẠI KHÁNG SINH
2.3.1. Giới thiệu kháng sinh
Kháng sinh là những chất chuyển hoá vi sinh vật hay chất tương đồng bán tổng hợp, tổng hợp; hoặc chất tổng hợp không liên quan đến những chất thiên nhiên; ở liều nhỏ các chất này ức chế sự phát triển và sống sót của vi sinh vật mà không có độc tính trầm trọng trên ký chủ (Hóa dược 1, 2009)
2.3.2. Một số loại kháng sinh sử dụng trong điều trị bệnh mụn trứng cá
2.3.2.1. Các sulfamid kháng khuẩn
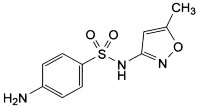
Hình 2.4 Công thức cấu tạo sulfamethoxazolum (Nguồn Dược điển Việt Nam IV) C10H11N3O3S P.t.l: 253,3
Sulfamethoxazol là 4–Amino–N–(5–methylisoxazol–3–yl)benzensulphonamid
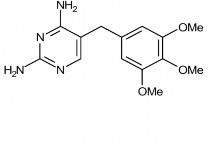
Hình 2.5 Công thức cấu tạo trimethoprimum (Nguồn Dược điển Việt Nam IV) C14H18N4O3 P.t.l: 290,3
Trimethoprim là 2,4 diamino–5–(3,4,5–trimethoxybenzyl)
Sự phối hợp của trimethoprim và các sulfamid là một bước tiến quan trọng trong sự phát hiện các chất kháng khuẩn có hiệu lực tốt. Hai chất này tác động ở hai giai đoạn khác nhau thuộc quá trình biến dưỡng của vi khuẩn và dẫn đến kết quả là sự hiệp lực.
- Hoạt tính kháng khuẩn ( Đào Văn Phan, 2012)
Phổ kháng khuẩn của trimethoprim và sulfamethoxazol tương tự nhau, tuy hiệu lực của trimethoprim thường gấp 20–100 lần sulfamethoxazol. Nhiều vi khuẩn Gram âm và Gram dương nhạy cảm với trimethoprim nhưng sự đề kháng dễ phát triển khi dùng riêng lẻ chất này. Các vi khuẩn đề kháng với sulfamethoxazol hay trimethoprim dùng riêng lẻ vẫn có thể nhạy cảm với phối hợp của hai chất. Tuy nhiên, hiệu lực tối đa của co–trimoxazol đạt được khi vi khuẩn nhạy cảm với cả hai thành phần kết hợp. Với một số vi khuẩn, sự phối hợp này cho tác động diệt khuẩn (trimethoprim cũng tác động kìm khuẩn khi dùng riêng như sulfamid).
- Cơ chế tác động và đề kháng
Trimethoprim phối hợp với sulfamid cho tác động hiệp lực vì trimethoprim là chất ức chế tương tranh dihydrofolat redutase, enzym giúp sự chuyển đổi dihydrofolat thành tetrahydrofolat. Việc sử dụng đồng thời sulfamid và trimethoprim gây ra sự ức chế nối tiếp trong quá trình tổng hợp acid folic, chất không thể thiếu trong sự tổng hợp acid nucleic cho vi khuẩn.
Sự đề kháng của vi khuẩn với co–trimoxazol phát triển chậm hơn so mỗi thành phần riêng lẻ. Cơ chế đề kháng giống cơ chế đề kháng sulfamid là do đột biến gen hay do plasmid và có thể dẫn đến một sự biến đổi enzym chuyển hóa PABA (dihydropteroat synthase) hoặc sự thay đổi kiểu biến dưỡng để tổng hợp acid folic.
2.3.2.2. Kháng sinh họ macrolid
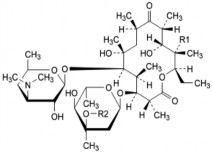
Hình 2.6 Công thức cấu tạo erythromycin (Nguồn Dược điển Việt Nam IV)
Công thức phân tử | R1 | R2 | |
A | C37 H67 NO13 | OH | CH3 |
B | C37 H67 NO12 | H | CH3 |
C | C36 H65 NO13 | OH | H |
C37H67NO13 P.t.l: 734
Erythromycin là một hỗn hợp các kháng sinh họ macrolid được sản xuất bằng cách nuôi cấy chủng Streptomyces erythreus, thành phần chính là (3R,4S,5S,6R,7R,9R,11R,12R,13S,14R)–4–[(2,6–dideoxy–3–C–methyl–3–O–methyl–
-L–ribo-hexopyranosyl)oxy]–14–ethyl–7,12,13–trihydroxy–3,5,7,9,11,13– hexamethyl–6–[(3,4,6–trideoxy–3–dimethylamino–-D–xylo–hexopyranosyl)– oxy]oxacyclotetradecan–2,10–dion (erythromycin A).
- Phổ kháng khuẩn (Nguyễn Thị Xuyên, 2015)
Macrolid có phổ kháng khuẩn hẹp, chủ yếu tập trung vào một số chủng vi khuẩn Gram dương và một số vi khuẩn không điển hình.
Macrolid có hoạt tính trên cầu khuẩn Gram dương (liên cầu, tụ cầu), trực khuẩn Gram dương (Clostridium perfringens, Corynebacterium diphtheriae, Listeria monocytogenes). Thuốc không có tác dụng trên phần lớn các chủng trực khuẩn Gram âm đường ruột và chỉ có tác dụng yếu trên một số chủng vi khuẩn Gram âm khác như
H. influenzae và N. meningitides, tuy nhiên lại có tác dụng khá tốt trên các chủng N.gonorrrhoeae. Kháng sinh nhóm macrolid tác dụng tốt trên các vi khuẩn nội bào như Campylobacter jejuni, Legionella pneumophila, Mycobacteria.
- Cơ chế tác động (Hóa dược 1, 2009)
Erythromycin kết hợp vào một vị trí chuyên biệt của tiểu thể 50S trên ribosom vi khuẩn, sự kết hợp này làm ngăn cản quá trình giải mã di truyền trong quá trình tổng hợp protein, do vậy sự tổng hợp protein bị ức chế.
Kết hợp này xảy ra ở mức độ thấp nên quá trình tổng hợp protein vẫn có thể xảy ra, do đó các thuốc thuộc nhóm này chỉ có tác dụng kìm khuẩn ở các nồng độ trị liệu, ngược lại ở nồng độ cao có tác dụng diệt khuẩn.
Khả năng kết hợp của kháng sinh nhóm macrolid với ribosom của vi khuẩn Gram dương và Gram âm ở mức tương đương, tuy nhiên tác động mạnh hơn trên Gram dương do tính thấm qua màng tế bào Gram dương tốt hơn.
Kháng sinh nhóm macrolid không kết hợp với các ribosom của động vật có vú.
Sự kết dính vào tiểu thể 50S trên ribosom của erythromycin làm che khuất hoặc gây cản trở cho sự kết hợp của cloramphenicol và lincomycin, nhưng sự kết hợp giữa erythromycin và ribosom không bị cản trở bởi cloramphenicol và lincomycin. Sự kết hợp của lincomycin cũng ngăn cản cloramphenicol kết hợp vào ribosom.
- Sự đề kháng (Hóa dược 1, 2009)
Sự đề kháng với macrolid có thể bắt nguồn từ nhiều cơ chế phức tạp, một số do yếu tố plasmid (sự đề kháng thu nhận), một số khác do đột biến nhiễm sắc thể (đề kháng tự nhiên).
Đề kháng thu nhận
Streptococcus, Staphylococcus và cả Pneumococcus đã có sự đề kháng với
macrolid, biểu hiện bằng cách sau:
Giảm tính thấm qua thành vi khuẩn đối với thuốc. Thay đổi vị trí gắn kết đối với thuốc (receptor).
Vi khuẩn đường ruột (Enterobacteriaceae) tiết ra esterase thủy giải các macrolid.
Đề kháng tự nhiên
Trực khuẩn Gram âm đề kháng tự nhiên với các macrolid, sự đề kháng này do vi khuẩn không cho thấm thuốc qua các lỗ (porin) trên thành tế bào.
Đề kháng chéo
Sự đề kháng chéo xảy ra giữa các kháng sinh trong cùng nhóm, nhất là các macrolid cổ điển. Các kháng sinh bán tổng hợp thế hệ mới như clarithromycin, azithromycin có thể dùng để điều trị các vi khuẩn đã kháng với macrolid cổ điển.
2.3.2.3. Kháng sinh họ beta lactam
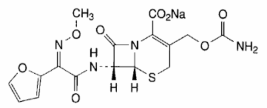
Hình 2.7 Công thức cấu tạo cefuroxim (Nguồn Hóa dược 1) C16H15N4NaO8S P.t.l: 446,4
Cefuroxim natri là muối natri của acid (6R,7R)–3[(carbamoyloxy)methyl]–7–[[(Z)– (furan–2–yl)(methoxyimino)acetyl]amino]–8–oxo–5–thia–1–azabicyclo[4.2.0]oct–2– en–2–carboxylic.
- Cơ chế tác động
Các beta lactam tác động trên thành vi khuẩn bằng cách ức chế giai đoạn cuối của sự tổng hợp peptidoglycan. phân tử beta lactam gắn vào các protein PBP (protein binding penicillin) có họat tính enzym hiện diện trên màng vi khuẩn và ức chế chức năng của các enzym này trong sự tổng hợp peptiddoglycan. Tùy theo nhóm thế trên nhân beta lactam, các beta lactam có ái lực khác nhau đối với PBP.
- Cơ chế đề kháng thuốc
Sự đề kháng của vi khuẩn đối với beta lactam có thể theo 3 cơ chế:
Sự tổng hợp các men beta lactamase bởi vi khuẩn. Tác động thủy phân của các men do vi khuẩn tiết ra làm mở vòng beta lactam và kháng sinh bị mất tác dụng. Cơ chế đề kháng này có nguồn gốc plasmid hoặc nhiễm sắc thể.
Sự giảm tính thấm của thành vi khuẩn là sự đề kháng có nguồn gốc nhiễm sắc thể của vi khuẩn Gram âm đối với kháng sinh beta lactam, đặc biệt với penicillin G.
Sự thay đổi điểm đích của kháng sinh là sự thay đổi cấu trúc hóa học của các PBP, có nguồn gốc nhiễm sắc thể và dẫn đến sự giảm ái lực của điểm đích đối với kháng sinh.
- Phổ kháng khuẩn (Hóa dược 1, 2009)
Trên cầu khuẩn Gram dương không có lợi bằng cephalosporin thế hệ I vì công hiệu kém hơn cefalotin và cefazolin.
Trên cầu khuẩn Gram âm, cephalosporin II hoạt tính mạnh hơn cephalosporin I, đặc biệt trên cầu khuẩn kháng penicillin.
Lợi điểm của cephalosporin II ở chỗ hoạt tính đối với vi khuẩn Gram âm (Gram âm đường ruột đề kháng với cephalosporin I) mắc phải tại bệnh viện.
Cephalosporin II xâm nhập tốt vào các mô cơ thể, ngoại trừ dịch não tủy; được đào thải qua thận.
2.3.2.4. Kháng sinh họ cyclin
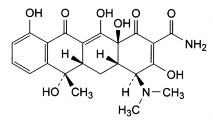
Hình 2.8 Công thức cấu tạo tetracyclin (Nguồn Hóa dược 1) C22H24N2O8 P.t.l: 444,4
Tetracyclin : (4S,4aS,5aS,6S,12aS)–4–Dimethylamino–1,4,4a,5,5a,6,11,12a– octahydro–3,6,10,12,12a–pentahydroxy–6–methyl–1,11–dioxo–naphthacen–2– carboxamid
- Phổ kháng khuẩn (Hóa dược 1, 2009)
Nhóm tetracyclin có tác động kìm khuẩn (bacteriostatic), độ nhạy cảm và sự đề kháng giữa các chất trong cùng một nhóm, nói chung tương tự nhau. Tuy nhiên, minocylin là chất có hiệu lực mạnh nhất, kể đến doxycycin, yếu nhất là tetracyclin và oxytetracyclin.
Các cyclin có hoạt phổ rộng không chỉ trên vi khuẩn Gram dương và Gram âm, mà còn trên một số mầm nội bào khác: Rickettsia, Chlamydia, Mycoplasma, Plasmodium, có hoạt tính yếu trên vi nấm Candida, tác động ức chế gián tiếp sự phát triển của amip ruột.
Kháng sinh nhóm này tác động trên vi khuẩn Gram dương ở liều thấp hơn so với vi khuẩn Gram âm, nhưng thực tế ít dùng điều trị nhiễm khuẩn Gram dương do các chủng này đề kháng nhanh với thuốc.
- Cơ chế tác động và cơ chế đề kháng
Các tetracyclin tác động bằng cách gắn vào tiểu đơn vị 30S của ribosom vi khuẩn, ngăn cản sự tổng hợp protein.
Cơ chế của sự đề kháng có thể do việc ngăn chặn kháng sinh đi qua màng vi khuẩn hoặc đẩy kháng sinh ra ngoài màng bằng sự chuyển vận tích cực.
Có sự đề kháng chéo giữa các tetracyclin.
2.3.2.5. Kháng sinh họ lincosamid
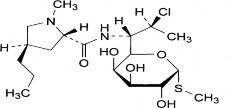
Hình 2.9 Công thức cấu tạo clindamycin (Nguồn Dược điển Việt Nam IV) C18H33ClN2O5S P.t.l: 424,98
Clindamycin: (2S,4R)–Nb–{2–chloro–1–[(2R,3R,4S,5R,6R)–3,4,5–trihydroxy–6– (methylsulfa-nyl)oxan–2–yl]propyl}–1–methyl–4–propylpyrrolidin–2–carboxamid
- Cơ chế tác động (Hóa dược 1, 2009)
Tác động gần giống tác động của macrolid, cùng cơ chế tác động trên thụ thể ở phần 50S của ribosom, với sự ức chế giai đoạn đầu của sự tổng hợp protein.
- Phổ kháng khuẩn ( Nguyễn Thị Xuyên, 2015)
Kháng sinh nhóm lincosamid có phổ kháng khuẩn tương tự như kháng sinh nhóm macrolid trên pneumococci, S. pyogenes, và viridans streptococci. Thuốc có tác dụng trên S. aureus, nhưng không có hiệu quả trên S. aureus kháng methicilin. Thuốc cũng không có tác dụng trên trực khuẩn Gram âm hiếu khí.
Khác với macrolid, kháng sinh lincosamid có tác dụng tốt trên một số chủng vi khuẩn kỵ khí, đặc biệt là B. fragilis. Thuốc có tác dụng tương đối tốt trên C. perfringens, nhưng có tác dụng khác nhau trên các chủng Clostridium spp. Khác.
Cũng khác với macrolid, kháng sinh nhóm này chỉ tác dụng yếu hoặc không có tác dụng trên các chủng vi khuẩn không điển hình như M. pneumoniae hay Chlamydia spp.
2.3.2.6. Kháng khuẩn họ quinolon
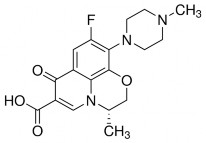
Hình 2.10 Công thức cấu tạo levofloxacin (Nguồn Hóa dược 1) C18H20FO4N3 P.t.l: 331,35