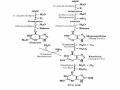
c). Phản ứng do nhóm α-carboxyl
Ngoài các phản ứng thông thường tạo este, tạo amid, tạo muối ... mhóm - COOH còn có những phản ứng đặc trưng khác như có thể bị khử thành hợp chất rượu amino dưới sự xúc tác của NaBH4
R - NH2 - CH – COOH R - NH2 - CH – CH2OH
Nhóm -COOH có thể tạo thành phức aminoacyl-adenylat trong phản ứng hoạt hoá acid amin để tổng hợp protein, hay có thể loại CO2 (gặp rất nhiều trong quá trình thoái hoá acid amin).
d). Phản ứng do nhóm α-amin
Nhiều phản ứng của nhóm amin được dùng để định tính và định lượng các chỉ tiêu của acid amin như:
Để định lượng nitrogen của acid amin người ta cho phản ứng với HNO2 để giải phóng N2.
HOOC – CH – R
HOOC – CH – R
Có thể bạn quan tâm!
-
 Các Con Đường Thoái Hóa Tiếp Tục Của Acetyl Coa A). Oxy Hóa Ở Chu Trình Krebs
Các Con Đường Thoái Hóa Tiếp Tục Của Acetyl Coa A). Oxy Hóa Ở Chu Trình Krebs -
 Giáo trình Hóa sinh Dùng cho sinh viên Cao đẳng Dược - Đại học Tây Đô - 9
Giáo trình Hóa sinh Dùng cho sinh viên Cao đẳng Dược - Đại học Tây Đô - 9 -
 Giáo trình Hóa sinh Dùng cho sinh viên Cao đẳng Dược - Đại học Tây Đô - 10
Giáo trình Hóa sinh Dùng cho sinh viên Cao đẳng Dược - Đại học Tây Đô - 10 -
 Sự Thủy Phân Protid Ngoại Sinh (Sự Tiêu Hóa Protid)
Sự Thủy Phân Protid Ngoại Sinh (Sự Tiêu Hóa Protid) -
 Thành Phần Hóa Học Của Mật Gồm: Sắc Tố Mật, Muối Mật, Cholesterol.
Thành Phần Hóa Học Của Mật Gồm: Sắc Tố Mật, Muối Mật, Cholesterol. -
 Giáo trình Hóa sinh Dùng cho sinh viên Cao đẳng Dược - Đại học Tây Đô - 14
Giáo trình Hóa sinh Dùng cho sinh viên Cao đẳng Dược - Đại học Tây Đô - 14
Xem toàn bộ 122 trang tài liệu này.
NH2 + HNO2
OH + N2 + H2O
Để định lượng acid amin người ta cho phản ứng với aldehyd tạo thành base schiff.
Để xác định acid amin đầu N-tận cùng người ta cho tác dụng với 2-4 dinitrofluobenzen (phản ứng Sanger) hay phenyliothiocyanate (phản ứng Edman).
3. PEPTID
3.1. Định nghĩa
Peptid là phân tử protein gồm hai đến hàng chục acid amin, nối với nhau bằng các liên kết peptid, có phân tử lượng < 6000 dalton.
3.2. Cấu tạo
Các peptid có thể được tổng hợp trong tự nhiên hoặc được hình thành do sự thoái hoá protein. Trong các peptid các acid amin liên kết với nhau thông qua liên kết peptide (hình 7.6).
Trong chuỗi peptid, ở đầu của là acid amin có nhóm α-amin (α-NH2) tự do gọi là đầu N tận cùng và đầu có nhóm α-carboxyl (α-COOH) tự do gọi là đầu C tận cùng. Liên kết peptid tạo nên bộ khung chính, còn gốc R tạo nên mạch bên của chuỗi
Như vậy, chuỗi peptid lúc nào cũng có một nhóm α-amin và một nhóm α- carboxyl tự do. Với n acid amin thì có (n-1) liên kết peptid được hình thành và loại (n-1) phân tử nước.
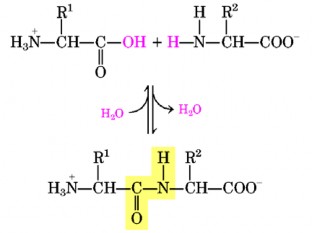
Hình 7.6. Sự tạo thành liên kết peptide
3.3. Cách gọi tên
Gọi theo số acid amin có trong chuỗi pepetid: dipeptid (2 acid amin), tripeptid (3 acid amin), …
Gọi theo gốc acid amin: bắt đầu từ đầu N tận cùng của acid amin đầu tiên đến đầ C tận cùng của acid amin cuối.
Giữ nguyên tên acid amin có đầu C tận và thay đuôi của các acid amin khác bằng đuôi YL
Ví dụ: Serin – Alanin – Methionin – Valin – Glycin Seryl – Alanyl – Methionyl – Valyl – Glycin
Gọi theo tên riêng:
Ví dụ: Glutathion:tripeptid gồm γ-glutamyl – cysteyl – glycin Glucagon: polypeptid gồm 29 acid amin
Insulin: polypeptid gồm 51 acid amin
Để biểu thị thành phần và thứ tự acid amin, dùng ký hiệu chữ hoặc một chữ (nếu chuỗi peptid dài) của acid amin viết liền nhau, từ đầu N tận đến đầu C tận, từ trái qua phải.
Ví dụ: Alanin – Valin – Leucin – Histidin – Prolin
Ala – Val – Leu – His – Pro A V L H P
H2N – Ala – Val – Leu – His – Pro – COOH
3.4. Tính chất hóa học
Phân tử peptid có các nhóm -NH2 và -COOH tự do có tính chất hóa học như acid amin nên các phương pháp điện di, sắc ký,… dùng xác định các acid amin cũng được dùng xác định các peptid.
Trong môi trường kiềm mạnh, liên kết peptid phản ứng với
Các gốc R của peptid cũng cho những phản ứng màu đặc trưng của các acid amin tự do tương ứng. Một trong những phản ứng màu đặc trưng nhất để xác định liên kết peptid đó là phản ứng màu Biuret. Biuret là sản phẩm ngưng tụ của 2 phân tử urê kèm theo sự giải phóng 1 phân tử NH3. Phản ứng này không xảy ra với acid amin tự do và với dipeptid.
NH2
NH2
NH2
O = C
O = C + O = C NH3 + NH NH2 NH2 O = C
Urê
Urê
NH2
Biuret
CuSO4 tạo phức chất màu tím đỏ (hình 3.11.), hấp thụ cực đại ở bước sóng 540 nm. Đây là phản ứng được sử dụng rộng rãi để định lượng protein.
3.5. Các peptid thường gặp trong thiên nhiên
Trong tự nhiên, tồn tại nhiều dạng peptid có chức phận quan trọng liên quan đến hoạt động sống của cơ thể: hormon, chất kháng sinh, những chất tiền thân của tế bào vi khuẩn v.v... Bên cạnh đó cũng có những peptid chức phận chưa rò ràng, có những peptid là sản phẩm thuỷ phân đang còn dang dở của protein.
M ột số peptide quan trọng,có nhiều ý nghĩa đối với cho hoạt động sống của sinh
vật.
3.5.1. Glutathion và các chất tương tự
NH2
CH2 - SH
HOOC- CH - CH2-CH2 -CO-NH- CH - CO-NH-CH2-COOH
Glutathion là một tripeptide γ-glutamyl-cysteyl-glycine có công thức cấu tạo:
Trong cấu trúc của 76lutathione, nhóm SH của 76lutathi là nhóm hoạt động, vì vậy người ta thường viết tắt chữ 76lutathione là GSH. Đây là 76lutathione dạng khử. Trong môi trường hoạt động 76lutathione có thể nhường hydrogen (H) để thành dạng oxy hoá (GSSG) và ngược lại có thể nhận H để thành dạng khử:
+ 2H
2 GSH GSSG
+ 2H
Glutathion là một trong những peptid nội bào phổ biến nhất, đóng vai trò là một hệ thống oxy hoá khử (vận chuyển hydrogen)., nó phân bố nhiều trong các mô và các cơ quan như: gan, thận, lách, tim, phổi, hồng cầu v.v…
3.5.2. Các hormon sinh trưởng (HGH)
Hormon sinh trưởng của người (HGH – human growth hormone) còn gọi STH (somatotropin hormone) là một chuỗi polypeptid gồm 191 acid amin có khối lượng phân tử 20.000. Trong cấu trúc có hai cầu disulfua được tạo thành giữa acid amin 53- 165 và giữa acid amin 182-189. Chuỗi hoạt động sinh học gồm 134 acid amin.
HGH có tác dụng đối với sự tăng trưởng nói chung, kích thích tạo sụn hơn là tạo xương, đây cũng là một chất chuyển hoá, kích thích sự tổng hợp protein và là hormon gây tăng đường huyết đồng thời kích thích sự thoái hoá lipid để đảm bảo nhu cầu năng lượng trong cơ thể, gây tăng acid béo tự do trong huyết tương.
3.5.3. Insulin
Từ 1953, Sanger (giải thưởng Nobel 1958) nghiên cứu, tinh chế và xác định hoàn toàn cấu trúc của phân tử insulin. Gồm 51 acid amin, khối lượng phân tử 5.700, gồm 2 chuỗi polypeptid (chuỗi A có 21 acid amin, chuỗi B có 30 acid amin) nối với nhau bằng 2 cầu disulfua. Trong chuỗi A cũng hình thành 1 cầu disulfua giữa acid amin thứ 6 và acid amin thứ 11. Phần đặc hiệu của loài chỉ tập trung vào các acid amin thứ 8-9-10, 12-14 của chuỗi A và đặc biệt là acid amin thứ 30 của chuỗi B.
Insulin có tác dụng rò nhất trong tất cả các hormon của tuyến tụy, đặc biệt đối với quá trình chuyển hoá glucid, có tác dụng hạ đường huyết, kích thích quá trình tổng hợp và ức chế quá trình thoái hoá glycogen ở cơ, gan và mô mỡ. Đặc biệt, insulin tăng cường tổng hợp acid béo, protein và kích thích sự đường phân. Tác dụng quan trọng nhất của insulin là kích thích sự thâm nhập glucose, một số ose, acid amin trong tế bào cơ, mỡ. Do vậy insulin làm giảm lượng glucose trong máu. Ngoài ra insulin cũng làm giảm sự tân tạo glucose do làm giảm nồng độ enzym như pyruvat carboxylase và fructose 1-6 diphosphatase.
3.6. Một số peptid có hoạt tính sinh học khác
a) Oxytocin: là một peptid có 9 acid amin, tác dụng trên cơ trơn của tử cung và tuyến vú, gây co khi tử cung sinh con và kích thích sự tiết sữa khi cho con bú.
b) Vasopressin: là một peptid 9 acid amin, tác dụng chống lợi niệu, tăng cường tái hấp thu nước ở thận, đồng thời làm co mạch, do đó có tác dụng tăng huyết áp.
c) Glucagon: có 29 acid amin, tác dụng làm tăng đường huyết.
d) Bradykinin: là chất gây hạ huyết áp cơ trơn, tăng hoạt động tự kích thích và phản ứng tự vệ, liều thấp có tác dụng giảm đau.
e) Kallidin: tác nhân gây hạ huyết áp cơ trơn.
f) Peptid kháng sinh: do vi khuẩn hoặc nấm sinh sản: gramicillin, penicilin, tyrocidin, bacitracin.
4. PROTEIN
4.1. Định nghĩa
Protein là những đại phân tử có khối lượng > 6000 dalton, gồm hàng trăm, hàng ngàn acid amin kết hợp lại với nhau tạo thành một chuỗi polypetid.
4.2. Phân loại
Protein có thể được phân loại theo nhiều cách: có thể dựa vào cấu tạo, khả năng hòa tan, hình dạng, chức năng v.v…
4.2.1. Phân loại theo cấu tạo
- Protein thuần ( protein đơn giản): là các protein khi thủy phân cho các acid amin thường gặp, ví dụ: albumin, globumin, protamine, histon, v.v…
- Protein tạp (protein liên hợp): gồm protein thuần và phần phi protein ( có bản chất không phải là protein, có thể là glucid, lipid, acid nucleic, kim loại, v.v…).
- Protein khi thủy phân dở dang tạo thành các peptid, khi thủy phân đến cùng biến thành các acid amin.
4.2.2. Phân loại theo hình dạng
- Protein hình cầu: là những protein có kích thước chiều dài/kích thước ngang < 10 dalton; gồm protein enzym và protein huyết thanh.
- Protein hình sợi: là những protein có kích thước chiều dài/kích thước chiều ngang
> 10, gồm keratin của tóc, móng và collagen của mô liên kết.
4.3. Cấu trúc của protein
- Cấu trúc bậc I: biểu thị thứ tự sắp xếp các acid amin trong chuỗi polypeptid, hoặc nhiều chuỗi polypeptide và vị trí của liên kết disulfid.
- Cấu trúc bậc II: biểu thị sự xoắn của chuỗi polypeptide, điển hình là cấu trúc bậc II của protein sợi, liên kết hydrogen đóng vai trò quan trọng trong cấu trúc bậc II.
- Cấu trúc bậc III: biểu thị sự xoắn và gấp khúc của chuỗi polypeplid, liên kết disulfide đóng vai trò quan trọng trong việc duy trì cấu trúc bậc III.
- Cấu trúc bậc IV: biểu thị sự kết hợp của nhiều chuỗi polypeptide có cấu trúc bậc III trong phân tử protein. Ví dụ: hemoglobin có cấu trúc bậc IV.
4.4. Tính chất của protein
4.4.1. Tính chất lý – hoá
a) Tính tan
Các loại protein khác nhau có khả năng hoà tan dễ dàng trong một số loại dung môi nhất định, như: albumin dễ tan trong nước, globulin dễ tan trong muối loãng, glutelin chỉ tan trong dung dịch kiềm hoặc acid loãng v.v...
b) Tính ngậm nước
Trong môi trường nước, protein kết hợp với nước trương lên thành dạng keo (hydrate hoá), các phân tử nước bám vào các nhóm ưa nước trong phân tử protein như
-NH2, -COOH... Lớp áo nước bao quanh phân tử protein là một trong các yếu tố làm bền vững cấu trúc, ngăn cách các phân tử protein không cho chúng dính vào nhau để thành tủa.
c) Độ nhớt của dung dịch protein
Các protein khác nhau có độ nhớt khác nhau khi hòa tan trong dung dịch . Tính chất này dùng để xác định khối lượng phân tử của protein (độ nhớt càng cao thì khối lượng phân tử càng cao).
d) Hằng số điện môi của dung dịch protein
Khi thêm các dung môi hữu cơ trung tính như ethanol, aceton vào dung dịch protein trong nước thì độ tan của protein giảm và protein sẽ kết tủa do việc giảm mức độ hydrate hoá của các nhóm ion hoá của protein, các phân tử protein kết hợp với nhau thành tủa. Như vậy, hằng số điện môi của dung môi làm ngăn cản lực tĩnh điện giữa các nhóm tích điện của protein và nước.
e) Tính chất điện li của protein
Cũng như acid amin, protein là chất điện li lưỡng tính vì trong phân tử có nhiều nhóm phân cực mạnh (gốc R) của acid amin.
Trạng thái tích điện của các nhóm này phụ thuộc vào pH của môi trường. Ở một pH nào đó mà tổng điện tích (+) và điện tích (-) của phân tử protein bằng không, phân tử protein không di chuyển trong điện trường gọi là pHi (isoelectric - điểm đẳng điện) của protein.
Trong môi trường có pH = pHi của protein, protein dễ dàng kết tụ lại với nhau, do đó, tính chất này dung để xác định pHi của protein cũng như để kết tủa protein. Mặt khác do sự sai khác nhau về pHi giữa các protein mà có thể điều chỉnh pH của môi trường để tách riêng các protein ra khỏi hỗn hợp của chúng.
f) Sự kết tủa bằng muối của dung dịch protein
Muối trung tính có ảnh hưởng rò tới độ hoà tan của protein hình cầu, nồng độ thấp làm tăng độ hoà tan. Khi tăng nồng độ muối, độ hòa tan giảm và ở nồng độ muối rất cao, protein có thể kết tủa hoàn toàn.
Các protein khác nhau bị kết tủa ở những nồng độ muối trung tính khác nhau. Người ta dùng tính chất này để chiết xuất và tách riêng protein khỏi hỗn hợp. Đó là phương pháp diêm tích (kết tủa protein bằng muối).
g) Sự biến tính
Khi các liên kết (trừ liên kết peptid) trong phân protein bị cắt đứt, làm cấu trúc protein thay đổi, protein bị biến tính. Hiện tượng biến tính làm giảm độ hòa tan, mất các hoạt tính sinh học. Khi bị biến tính, cấu trúc protein đảo lộn, các nhóm kỵ nước quay ra ngoài, các nhóm ưa nước quay vào trong, sự hydrat hóa giảm, các protein dễ kết hợp với nhau. Tính chất này được áp dụng trong xét nghiệm protein niệu.
Các tác nhân gây biến tính:
Vật lý: nhiệt độ, tia tử ngoại, áp suất cao, …
Hóa học: acid mạnh (a. tricloacetic, a. nitric,…), muối kim loại nặng (HgCl2), kiềm mạnh, alcol, …
Phân biệt 2 loại biến tính:
Thuận nghịch: protein biến tính có thể trở về trạng thái ban đầu (sự hoàn nguyên). Dung dịch trypsin bị biến tính khi bị đun nóng ở pH = 3 và hoàn nguyên sau khi làm lạnh trong một thời gian nhất định.
Không thuận nghịch: protein biến tính không thể trở về trạng thái ban đầu, như luộc trứng gà.
4.4.2. Các phản ứng hoá học của protein
Protein có các phản ứng hoá học tương tự các acid amin và peptid: phản ứng của các nhóm -COOH, -NH2, gốc R và phản ứng tạo màu đặc trưng của liên kết peptid như phản ứng biuret.
Ngoài ra, còn có một số phản ứng màu đặc trưng khác, có ý nghĩa quan trọng trong phát hiện protein và các gốc acid amin khác trong chuỗi polypeptid.
a) Phản ứng với thuốc thử Folin-Ciocateau
Thuốc thử Folin-Ciocateau chứa phosphomolipdic acid và phosphovolframic acid. Các chất này làm tăng độ nhạy của phản ứng biuret, mặt khác phản ứng với gốc Tyr và Trp trong phân tử protein. Các gốc này tham gia trong quá trình tạo phức chất màu xanh da trời.
b) Các phản ứng màu đặc trưng khác
Dùng để phát hiện acid amin, protein trong dung dịch nhớ vào sự có mặt của các nhóm chức hóa học trong phân tử protein.
Phản ứng xanthproteic: các gốc acid amin Tyr, Trp, Phe trong protein tác dụng với HNO3 đậm đặc tạo thành màu vàng và sau khi thêm kiềm sẽ chuyển thành da cam.
Phản ứng Pauli: các gốc Tyr, His tác dụng với diazobenzosulfonic acid tạo thành màu đỏ anh đào.
Phản ứng Millon: gốc Tyr tác dụng với thuỷ ngân nitrate trong HNO3 đậm đặc tạo thành kết tủa màu nâu đất.
Phản ứng Saccaguichi: gốc Arg tác dụng với dung dịch kiềm của α-naphtolvà hypobromite cho màu đỏ anh đào.
Phản ứng Adamkievich: gốc Trp tác dụng với glyoxylic acid và H2SO4 đặc tạo thành vòng tím đỏ ở mặt phân cách.
4.5. Chức năng sinh học của Protein
Protein tham gia mọi hoạt động sống trong cơ thể sinh vật, ngoài vai trò là thành phần chính trong cấu trúc của tế bào và mô, protein còn có nhiều chức năng phong phú
khác quyết định những đặc điểm cơ bản của sự sống như sự truyền đạt thông tin di truyền, sự chuyển hoá các chất do các 81ormone, các kháng thể chống lại bệnh tật, các 81ormone dẫn truyền các tín hiệu trong tế bào v.v…
4.5.1. Chức năng tạo hình
Ngoài các protein làm nhiệm vụ cấu trúc như vỏ virus, màng tế bào, còn gặp những protein thường có dạng sợi như: sclerotin có trong lớp vỏ ngoài của sâu bọ; fibroin của tơ tằm, nhện; collagen, elastin của mô liên kết, mô xương. Collagen đảm bảo cho độ bền và tính mềm dẻo của mô liên kết.
4.5.2. Chức năng xúc tác
Hầu hết các phản ứng trong cơ thể đều do các protein đặc hiệu đóng vai trò xúc tác, được gọi là các enzym. Hiện nay, đã biết được khỏang 3.500 enzym khác nhau, nhiều enzym đã được tinh sạch, kết tinh và nghiên cứu cấu trúc.
4.5.3. Chức năng bảo vệ
Protein tham gia vào hệ thống miễn dịch, đặc biệt nhiều loại protein thực hiện các chức năng riêng biệt tạo nên hiệu quả miễn dịch đặc hiệu và không đặc hiệu. Các protein miễn dịch được nhắc đến nhiều hơn cả là các kháng thể, bổ thể ...
Ngoài ra protein còn tham gia vào quá trình đông máu để chống mất máu cho cơ thể hoặc một số loài có thể sản xuất ra những độc tố có bản chất là protein như enzym nọc rắn, lectin v.v... có khả năng tiêu diệt kẻ thù để bảo vệ cơ thể.
4.5.4. Chức năng vận chuyển
Trong cơ thể có những protein làm nhiệm vụ vận chuyển như: hemoglobin, myoglobin, hemocyanin vận chuyển O2, CO2 và H+ đi khắp các mô, các cơ quan trong cơ thể; lipoprotein vận chuyển lipid, ceruloplasmin vận chuyển Cu trong máu…
4.5.5. Chức năng vận động
Nhiều protein làm nhiệm vụ vận động co rút cơ ( myosin, actin), chuyển vị trí của nhiễm sắc thể trong quá trình phân bào
4.5.6. Chức năng dự trữ và dinh dưỡng
Protein dự trữ là nguồn cung cấp dinh dưỡng quan trọng cho các tổ chức mô, phôi phát triển. Các protein dự trữ như: casein của sữa, ovalbumin của trứng, feritin của lách (dữ trữ sắt) v.v...
4.5.7. Chức năng dẫn truyền tín hiệu thần kinh
Protein tham gia vào việc dẫn tín hiệu thần kinh đồi với các kích thích đặc hiệu như: sắc tố thị giác rodopsi ở màng lưới mắt.
4.5.8. Chức năng điều hoà
Điều hoà quá trình trao đổi chất thông qua tác động lên bộ máy thông tin di truyền. Các hormon, các protein ức chế đặc hiệu enzym đều có chức năng điều hoà