augmentin (AMC) với cefotaxim (CTX), augmentin (AMC) với ceftazidim (CAZ), do men - lactamase phổ rộng của vi khuẩn ở 2 vùng này bị ức chế bởi chất ức chế axid clavulanic từ khoanh giấy kháng sinh augmentin nên cefotaxim và ceftazidim không bị phá huỷ, vi khuẩn bị tiêu diệt, làm xuất hiện sự mở rộng vòng vô khuẩn ở đây. Được gọi là hình ảnh hiệp đồng (hình ảnh nút chai sâm panh)
Kháng sinh:
4 khoanh giấy kháng sinh được lựa chọn để phát hiện sự sinh men - lactamaza phổ rộng của vi khuẩn được thử là:
- Aztreonam (ATM - thuộc họ monobactam).
- Cefotaxim (CTX) và Ceftazidim (CAZ) là hai cephalosporin thế hệ III, bị phá huỷ bởi men β-lactamase phổ rộng.
- Augmentin (AMC) là một kháng sinh phối hợp giữa amoxicillin với một chất ức chế - lactamase là axid clavulanic.
Các bước tiến hành:
Tiến hành các bước tương tự ở phương pháp khoanh giấy khuếch tán. Đầu tiên, pha canh khuẩn có nồng độ 108 vi khuẩn/ml, sau đó pha loãng thành nồng độ 106 vi khuẩn/ml. Láng canh khuẩn này lên bề mặt thạch, hút canh khuẩn thừa bỏ đi, để khô mặt thạch. Dùng kim tiêm sạch đặt 4 khoanh giấy lên bề mặt thạch theo sơ đồ hình 4
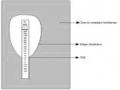
ATM
AMC
CTX
CAZ
Sơ đồ 2.2. Đặt khoanh giấy kháng sinh xác định men - lactamase phổ rộng.
Ghi chú: AMC - augmentin,ATM - Aztreonam, CTX - cefotaxim, CAZ – ceftazidim.
Sau khi để ở nhiệt độ phòng 30 phút cho kháng sinh khuếch tán đều, cho vào tủ ấm 35-370C/18 giờ với tư thế đảo ngược đĩa thạch.
Đánh giá kết quả
- lactamase phổ rộng dương tính (có sinh men β-lactamase phổ rộng) trong trường hợp chủng vi khuẩn nhạy cảm với AMC nhưng kháng CTX, CAZ, ATM và có hình ảnh hiệp đồng ở vùng giáp ranh giữa các khoanh giấy AMC với CTX, AMC với ATM hoặc AMC với CAZ.
Nghĩa là:
- Vi khuẩn sinh men β-lactamase phổ rộng bị ức chế bởi chất ức chế là axid clavulanic, nên nhạy cảm với AMC.
- Men β-lactamase này có phổ mở rộng nên đã tác động đến các cephalosporin thế hệ III, vì thế CTX, CAZ và ATM đều bị kháng hoặc giảm tính nhạy cảm ( R hoặc I).
- Nhưng riêng vùng giáp ranh giữa các khoanh giấy AMC với CTX hoặc AMC với CAZ hoặc AMC với ATM do có sự ức chế bởi chất ức chế là axid clavulanic nên men β-lactamase phổ rộng không tác động vào các cephalosporin thế hệ III, vi khuẩn bị diệt tạo hình ảnh mở rộng của vòng vô khuẩn. Được gọi là hình ảnh hiệp đồng (hình ảnh nút chai sâm panh)
Còn lại các trường hợp khác đều đọc là men β-lactamase phổ rộng âm tính (không sinh men β-lactamase phổ rộng ).
2.4.3.5. Xác định nồng độ kháng sinh tối thiểu ức chế vi khuẩn (Minimum Inhibitory Concentration - MIC)
- Mục đích: Kỹ thuật này nhằm mục đích xác định chính xác nồng độ nhỏ nhất của kháng sinh có tác dụng ức chế sự phát triển của một chủng vi khuẩn trong môi trường nuôi cấy (phương pháp định lượng).
- Nguyên lý: Nồng độ kháng sinh tăng dần trong môi trường nuôi cấy, khi đạt đến một nồng độ nhất định nó sẽ ức chế được sự phát triển của vi khuẩn và bằng mắt thường đã có thể xác định được điều này.
- Kỹ thuật [43], [77],[84], [87].
+ Pha dung dịch kháng sinh đậm đặc (dung dịch “mẹ”)
+Nếu sử dụng kháng sinh bột dùng cho phòng thí nghiệm: Dựa trên hoạt lực của kháng sinh (được ghi trên các nhãn lọ), cần tính để pha dung dịch “mẹ” theo công thức sau:
Ví dụ: Kháng sinh chloramphenicol có hoạt lực 99,13%, nếu cần pha 10 ml dung dịch kháng sinh “mẹ” có nồng độ 1600 g/ml, sẽ phải cân Xg kháng sinh:
10 ml x 1600
Xg kháng sinh = 99,13 = 16.140,421 g/ml = 0,016140 g/ ml
Kháng sinh bột sau khi được cân, sẽ pha với dung dịch đệm thích hợp, tùy mỗi loại kháng sinh khác nhau sẽ có những dung môi và dung dịch đệm khác nhau (phụ thuộc từng hãng sản xuất loại kháng sinh). Nhiều loại kháng sinh có thể hoà tan và được pha loãng trong nước cất. Một số khác cần phải hoà tan trong các dung
môi đặc biệt, sau đó mới được pha loãng trong nước cất. Dung dịch kháng sinh “mẹ” sau khi pha xong, chia nhỏ ra các ống nghiệm, bảo quản trong lạnh âm 200C (trừ kháng sinh Acid nalidixic bảo quản ở nhiệt độ phòng). Khi đã lấy ra sử dụng, chỉ dùng trong 24h.
+ Pha các nồng độ kháng sinh
Dung dịch đệm PBS * (hoặc nước cất) | Độ pha | Nồng độ trung gian (g/ml) | Nồng độ cuối cùng (g/ml)** | |
2,5 ml (1280 g/ml) 2 ml 1 ml 0,5 ml 0,5 ml | - 2ml 3 ml 3,5 ml 7,5 ml | - 1/2 1/4 1/8 1/16 | 1280 640 320 160 80 | 128 64 32 16 8 |
2ml (80 g/ml) 1 ml 0,5 ml 0,5 | 2 ml 3ml 3,5 ml 7,5 ml | 1/2 1/4 1/8 1/16 | 40 20 10 5 | 4 2 1 0,5 |
Có thể bạn quan tâm!
-
 Phát Hiện Các Đột Biến 158Delag, 5382Insc Và 6174Delt Bằng Real-Time Pcr (Scort Và Cs, 2006).
Phát Hiện Các Đột Biến 158Delag, 5382Insc Và 6174Delt Bằng Real-Time Pcr (Scort Và Cs, 2006). -
 Hình Ảnh Minh Hoạ Giải Trình Tự Một Đoạn Dna (Nguồn: Sanger Cequencing Read Display.gif)
Hình Ảnh Minh Hoạ Giải Trình Tự Một Đoạn Dna (Nguồn: Sanger Cequencing Read Display.gif) -
 Nuôi Cấy, Phân Lập, Xác Định Căn Nguyên Vi Khuẩn:
Nuôi Cấy, Phân Lập, Xác Định Căn Nguyên Vi Khuẩn: -
 Tỷ Lệ Và Sự Phân Bố Tỷ Lệ Chủng Klebsiella Phân Lập Từ Bệnh Nhi Nkhhct 0 Đến 6 Tuổi Với Một Số Yếu Tố Liên Quan
Tỷ Lệ Và Sự Phân Bố Tỷ Lệ Chủng Klebsiella Phân Lập Từ Bệnh Nhi Nkhhct 0 Đến 6 Tuổi Với Một Số Yếu Tố Liên Quan -
 Tỷ Lệ Phân Lập Vi Khuẩn Gram Âm Và Gram Dương Ở 2 Nhóm
Tỷ Lệ Phân Lập Vi Khuẩn Gram Âm Và Gram Dương Ở 2 Nhóm -
 Tỷ Lệ Nhiễm Một Số Loài Vi Khuẩn Thường Gặp Trên Bệnh Nhi Xin Về Và Tử Vong
Tỷ Lệ Nhiễm Một Số Loài Vi Khuẩn Thường Gặp Trên Bệnh Nhi Xin Về Và Tử Vong
Xem toàn bộ 134 trang tài liệu này.

2 ml 3ml 3,5 ml 7,5 ml | 1/2 1/4 1/8 1/16 | 2,5 1,25 0,64 0,32 | 0,25 0,125 0,064 0,032 | |
2ml (0,32 g/ml) 1 ml | 2 ml 3ml | 1/2 1/4 | 0,16 0,08 | 0,016 0,008 |
Ghi chú:
* PBS: Dung dịch đệm phosphat dùng để pha loãng kháng sinh.
** Nồng độ cuối cùng pha loãng 1/10 trong môi trường, được tính theo tỷ lệ trộn 2,5 ml dung dịch trung gian + 22,5 ml thạch MH.
- Các bước tiến hành
Ngày 1: Chuẩn bị chủng và môi trường
- Các chủng cần thử MIC và các chủng chuẩn quốc tế được cấy trong canh thang thường hoặc canh thang MH để có được canh khuẩn non, theo tỷ lệ sau: trực khuẩn Gram âm: cấy 0,1 ml;
- Chuẩn bị thạch MH: Cân thạch theo công thức (ghi trên hộp), đun sôi cho tan hết thạch, hấp thạch ở 1210C/15’.
- Khi thạch đã nguội còn khoảng 40-500C, dùng ống đong khắc vạch đong 22,5 ml thạch cho vào bình nón đã có sẵn 2,5 ml dung dịch kháng sinh theo các nồng độ như trong bảng pha kháng sinh, lắc kỹ và đổ vào hộp lồng, khi thạch đã đông cứng, bảo quản trong tủ lạnh 4 - 80C (có thể bảo quản được trong 2 tuần). Mỗi lần làm MIC cần 2 đĩa môi trường MH không có kháng sinh để làm đĩa chứng (cho thêm 2,5 ml PBS hoặc nước cất + 22,5 ml môi trường thạch MH).
Ngày 2: Cấy vi khuẩn trên bề mặt đĩa thạch MH có nồng độ kháng sinh khác nhau
- Cấy vi khuẩn thuần khiết từ canh khuẩn non (canh khuẩn đã cấy qua đêm 18h-tương đương 108 vi khuẩn/ml) hoặc lấy một số khuẩn lạc từ môi trường thạch thích hợp hoà vào 3 ml dung dịch đệm PBS (hoặc nước muối sinh lý 0,9%) để có độ đục bằng độ đục của ống Mc Farland 0,5 – tương đương 108 vi khuẩn/ml. Tiếp tục pha loãng 1/100 để có nồng độ 106vi khuẩn/ml bằng cách dùng micropipet hút 20 l cho vào 2 ml đệm PBS (hoặc nước muối sinh lý 0,9%).
- Dùng pipet Pasteur hút khoảng 0,5 ml huyền dịch (106 vi khuẩn/ml) cho vào mỗi giếng của bàn đinh, theo sơ đồ đã ghi số của các chủng:
1 | 2 | 3 | 4 | ||
5 | 6 | 7 | 8 | 9 | 10 |
11 | 12 | 13 | 14 | 15 | 16 |
17 | 18 | 19 | 20 | 21 | 22 |
23 | 24 | 25 | 26 | 27 | 28 |
29 | 30 | Chủng chuẩn* | Chủng chuẩn* |
* Chủng chuẩn là E.coli ATCC 25922.
- Dùng bộ phiên bản 32 chân đinh chấm vào giếng sau đó đặt lên đĩa thạch MH có các nồng độ kháng sinh khác nhau.
- Sau khi đặt lên các đĩa thạch, chờ cho đĩa thạch khô (các giọt nước tại các chân đường cấy thấm vào thạch (khoảng 15-20 phút) cất vào tủ ấm 35-370C/18h, lật úp đĩa thạch.
Ngày 3: Đọc kết quả
- Trước tiên đọc kết quả ở các đĩa thạch chứng không có kháng sinh để kiểm tra sự thuần khiết của chủng vi khuẩn và đảm bảo vi khuẩn không bị chết trước và trong khi tiến hành, nếu các chủng đảm bảo thuần khiết và phát triển tốt mới đọc tiếp.
- Đọc kết quả ở các chủng chứng (chủng chuẩn quốc tế), so sánh kết quả MIC của các chủng này với bảng chuẩn (Theo Viện chuẩn thức vi sinh lâm sàng Mỹ-CLSI ), nếu những kết quả này nằm trong giới hạn, sai số cho phép là một bậc nhỏ hơn hoặc một bậc lớn hơn, điều đó nói lên rằng các điều kiện của thí nghiệm đã đạt được chuẩn thức
- Đọc kết quả, lần lượt đọc từ đĩa thạch có nồng độ kháng sinh thấp nhất. Nồng độ MIC được xác định ở đĩa môi trường mà ở đó các vi khuẩn bị ức chế phát triển, nên mật độ vi khuẩn giảm hẳn chỉ còn 1-3 khuẩn lạc mọc.
- Kết quả MIC của các chủng với mỗi kháng sinh được ghi theo bảng mẫu.
- Ở nồng độ thấp nhất, không có vi khuẩn mọc thì kết quả được ghi nhận là: nhỏ hơn hoặc bằng nồng độ đó (). Trong trường hợp đến nồng độ cao nhất mà vẫn thấy vi khuẩn mọc thì kết quả được ghi nhận là lớn hơn nồng độ đó ().
- Kết quả MIC của các chủng sẽ được xác định theo ba mức độ nhạy cảm, dựa theo bảng chuẩn (CLSI): nhạy cảm (Susceptible - viết tắt S), trung gian (Intermediate - viết tắt I) hoặc đề kháng (Resistante - viết tắt R).
2.4.3.6. Kỹ thuật PCR (Polymerase Chain Reaction)
Kỹ thuật PCR được Karl Mullis người Mỹ thực hiện vào năm 1985 [104]. Từ đó đến nay kỹ thuật này được sử dụng rất phổ biến và ứng dụng rất nhiều trong các thí nghiệm về sinh học phân tử.
- Nguyên tắc của phản ứng PCR.
Nguyên tắc của phản ứng PCR dựa trên cơ sở tính chất biến tính, hồi tính của DNA và nguyên lý tổng hợp DNA nhờ hoạt tính của các DNA polymerase chịu nhiệt (Taq-polymerase) với nguyên liệu là 4 loại deoxyribonucleotide (dATP, dTTP, dGTP, dCTP). Enzym DNA - polymerase xúc tác tổng hợp một mạch DNA mới từ mạch DNA khuôn. Phản ứng đòi hỏi sự có mặt của những mồi xuôi và mồi ngược có trình tự bổ sung với hai đầu của trình tự DNA khuôn.
Taq-polymerase là một loại DNA - polymerase (tách chiết từ vi khuẩn chịu nhiệt Thermus aquaticus), còn mồi (primer) là những đoạn DNA ngắn có khả năng bắt cặp với một đầu của mạch khuôn, DNA polymerase sẽ nối dài mồi để hình thành đoạn mới. Các đoạn DNA mới hình thành lại được sử dụng để làm khuôn cho
các phản ứng tiếp theo. Sau mỗi chu kỳ, số lượng phân tử DNA tăng gấp đôi, vậy sau n chu kỳ số lượng sản phẩm PCR là 2n, đủ số lượng để tách ra, giải mã hoặc tách dòng.
- Các bước tiến hành
Phản ứng PCR là một chuỗi nhiều chu kỳ nối tiếp nhau, mối chu kỳ gồm 3 bước:
- Bước 1: Là giai đoạn biến tính (denaturation). Thành phần phản ứng PCR nói chung gồm những thành phần cơ bản sau: Dung dịch đệm PCR, dNTP, mồi xuôi và ngược,
Taq-polymerase và DNA khuôn. Trong giai đoạn này DNA được biến tính ở nhiệt độ cao hơn Tm (nhiệt độ nóng chảy) của phân tử, thường là 940C-950C với thời gian 30-60 giây.
- Bước 2: Giai đoạn bắt cặp (annealing-Ta). Nhiệt độ lúc này phải hạ thấp để các mồi bắt cặp với khuôn, nhiệt độ này trong khoảng 40-700C tuỳ thuộc nhiệt độ tối ưu cho bắt cặp của các mồi sử dụng và được kéo dài 30-60 giây.
- Bước 3: Giai đoạn tổng hợp hay kéo dài (extended). Nhiệt độ được tăng lên 720C để các enzym polymerase hoạt động tốt nhất. Thời gian tuỳ thuộc vào độ dài của trình tự DNA cần khuếch đại, thường kéo dài từ 30 phút đến nhiều phút .
Sau mỗi chu kỳ các chuỗi DNA mới tạo thành tiếp tục được dùng làm khuôn cho sự tổng hợp các DNA mới trong chu kỳ tiếp theo. Sản phẩm cuối của sản phẩm PCR là những đoạn DNA chuỗi đôi có chiều dài bằng khoảng cách giữa hai đoạn gen mồi và hai đầu tận cùng của sản phẩm được xác định bởi đầu tận 5' của 2 đoạn gen mồi.
Sản phẩm PCR được kiểm tra trên gel agarose 1,2% chạy cùng với marker để so sánh đối chiếu độ lớn của đoạn DNA cần quan tâm.
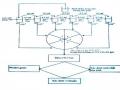
30 - 40 chu kỳ
Mỗi chu kỳ gồm 3 bước.
Bước 1: Biến tính 940C trong 1 phút
Bước 2: Bắt cặp 540C trong 45 giây
Mồi xuôi và mồi ngược
99
Bước 3: Kéo dài 720C trong 2 phút
(Nguồn: Vierrstraete, 19
)
Hình 2.2. Hình ảnh các bước phản ứng PCR
- Các bước tiến hành PCR với các gen nghiên cứu trong đề tài
Tách ADN từ vi khuẩn bằng nhiệt: một khuẩn lạc vi khuẩn được nuôi cấy
sau 24 giờ làm đồng nhất với 200 µl nước cất và ủ 1000C trong 5 phút, ly tâm 1200 vòng trong 5 phút, phần dịch trong chứa ADN vi khuẩn được dùng làm khuôn cho phản ứng PCR.
Thành phần PCR: Sử dụng PCR PreMix (Bioneer, Hàn Quốc) bao gồm 1pmol mồi mỗi loại, ADN vi khuẩn 1,5 µl, thêm H2O đến thể tích 20 µl.
PCR được tiến hành trên máy điều nhiệt Thermalcycler (Eppendorf, Đức)
với các bước sau: biến tính toàn bộ 950C trong 5 phút; phản ứng lặp lại 30 chu kỳ các bước biến tính cục bộ 950C trong 30 giây, bám mồi 500C (đối với gen kháng kháng sinh nhóm Quinolon và CTX-M) hoặc 560C (đối với gen SHV; TEM) trong 45 giây; tổng hợp ở 720C trong 1 phút; hoàn thành phản ứng tổng hợp ở 720C trong 10 phút và giữ mẫu ở 15oC. Kết quả PCR được kiểm tra bằng điện di gel agarose 1,2% với chất nhuộm Ethidium bromide và soi dưới ánh sáng tử ngoại.
Thông tin các mồi dùng để xác định sự có mặt của gen kháng kháng sinh nhóm Quinolon và β-lactamase phổ rộng nằm trên plasmid (Bảng 1).
ADN chuẩn của hãng Bioneer Hàn Quốc.
Chủng chứng dương Klebsiella đã chắc chắn có gen qnr, CTX-M, SHV, TEM .
2.4.3.7. Kỹ thuật Southern Blot [121]: ADN đã khuếch đại bằng PCR được mở vòng xoắn, phân tách thành sợi đơn và cắt bằng enzym giới hạn nuclease S1(enzym cắt đặc hiệu cho ADN plasmid); điện di xung trường (PFGE) để tách các đoạn ADN đã bị cắt; ii) Các đoạn ADN được chuyển sang màng lai nitrocellulose;
iii) Các đoạn ADN trên màng được lai với mẫu dò đặc hiệu dựa theo nguyên lý bổ xung ADN; iv) Cố định và phát hiện sự có mặt của phân tử lai ADN- mẫu dò được đánh dấu bằng biotin với mối liên kết chắc chắn với avadin. Avadin hỗn hợp với phosphatase kiềm dưới tác dụng của chất nền sinh mầu tạo ra mầu tím của sản phẩm.