pha tinh thể của Al2O3 và mangan oxit không xuất hiện. Điều này có thể được giải thích là do các hợp chất trên tồn tại ở dạng pha vô định hình.
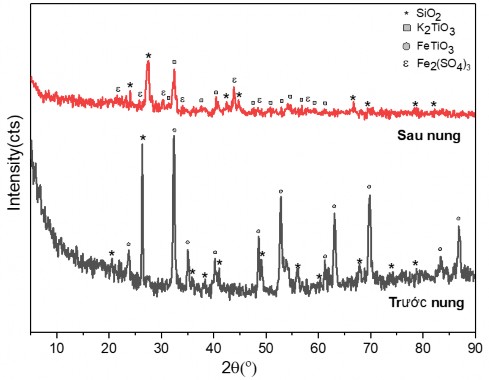
Hình 3.9. Giản đồ XRD của tinh quặng ilmenit 52% trước và sau khi nung Trên giản đồ XRD của mẫu vật liệu sau khi nung, có thể quan sát thấy
các pic đặc trưng cho pha tinh thể của FeTiO3 đã được thay thế bằng các píc đặc trưng cho pha tinh thể của K2TiO3. Kết quả này cho thấy toàn bộ FeTiO3 đã phản ứng hoàn toàn và sản phẩm của phản ứng tạo thành K2TiO3. Ngoài ra trên giản đồ XRD còn thấy xuất hiện của pha tinh thể của Fe2(SO4)3 và sự có mặt của pha tinh thể của SiO2. Như vậy, quá trình nung ilmenit 52% và muối KHSO4 ở 600oC có thể được mô tả bằng phản ứng như sau:
KHSO4 (rắn) → KHSO4 (lỏng) (3.1) FeTiO3 + 2KHSO4 → K2TiO3+ FeSO4 + H2SO4 (3.2) 4FeSO4 + O2 + 2H2SO4 →2 Fe2(SO4)3 + 2H2O (3.3)
Các pic đặc trưng cho pha tinh thể của SiO2 vẫn còn trên giản đồ sau nung. Điều này được giải thích là do SiO2 có trong thành phần sa khoáng của ilmenit không tham gia vào phản ứng với KHSO4.
3.1.2.2. Nghiên cứu điều chế dung dịch tiền chất tổng hợp tổ hợp hai oxit Fe2O3 và TiO2
Hòa tan phần tinh quặng của ilmenit 52% sau nung trong dung dịch H2SO4 phản ứng diễn ra như sau:
K2TiO3+ H2SO4→TiOSO4 + K2SO4 + H2O (3.4)
Thành phần trong dung dịch tiền chất bao gồm: TiOSO4, Fe2(SO4)3, K2SO4 và H2SO4. Ly tâm dung dịch hòa tan, tách thu phần cặn rắn không tan, rửa sạch nhiều lần bằng nước cất, đem sấy và đem phân tích xác định thành phần pha tinh thể. Kết quả phân tích XRD được thể hiện trên hình 3.10. Kết quả chỉ ra rằng trong phần cặn thu được chủ yếu là thành phần SiO2 không hòa tan trong axit loãng với các pic đặc trưng tại góc 2θ là 20,95; 26,95; 27,3; 40,15; 40,35 và 64,95. Ngoài ra độ tinh thể của SiO2 tăng lên so với ban đầu trước khi hòa tan (thể hiện ở cường độ của pic), điều này có thể được hiểu là do phần trăm SiO2 trong phần cặn rắn tăng lên đáng kể so với trước khi hòa tan.
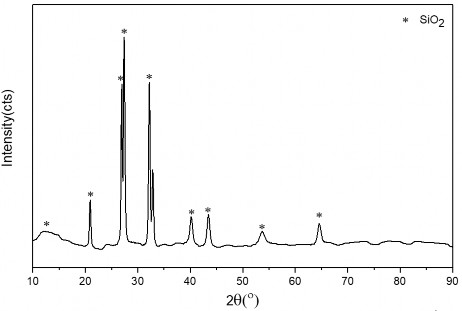
Hình 3.10. Giản đồ XRD của mẫu cặn sau khi hòa tan
Nhận xét chung: Dung dịch tiền chất để chế tạo tổ hợp oxit TiO2- Fe2O3 đã được thực hiện với hai giai đoạn bao gồm: nhiệt phân quặng ilmenit với KHSO4 ở 600 oC trong 2 giờ và hoà tan quặng sau nhiệt phân với H2SO4 10%.
Việc chế tạo tổ hợp oxit TiO2- Fe2O3 từ dung dịch tiền chất được nghiên cứu và trình bày kết quả ở phần tiếp theo.
3.1.3. Nghiên cứu quá trình chế tạo tổ hợp hai oxit Fe2O3 và TiO2
Tổ hợp oxit TiO2- Fe2O3 được chế tạo từ dung dịch tiền chất có chứa TiOSO4 và Fe2(SO4)3 bằng kỹ thuật thuỷ nhiệt trong bình autoclave. Quá trình thuỷ nhiệt được diễn ra theo các phản ứng sau:
TiOSO4 + (n+1) H2O = TiO2.nH2O + H2SO4 (3.5) Fe2(SO4)3 + (n+3)H2O = Fe2O3.nH2O + 3H2SO4 (3.6)
Sản phẩm của giai đoạn thuỷ nhiệt có kết tủa được tách ra khỏi dung dịch và tiếp tục dehydrat hoá ở 80 oC trong 2 giờ. Các yếu tố được khảo sát trong quá trình chế tạo bao gồm thời gian thuỷ nhiệt, pH dung dịch và thể tích dung dịch H2SO4 hòa tan. Nhiệt độ thủy nhiệt sẽ được khảo sát đối với mẫu vật liệu tổ hợp TiO2- Fe2O3/GNP. Các kết quả khảo sát sẽ được lần lượt trình bày dưới đây.

Hình 3.11. Mẫu vật liệu tổ hợp TiO2- Fe2O3 (TFG0)
Mẫu sản phẩm sau khi thủy nhiệt là vật liệu tổ hợp TiO2- Fe2O3, được ký hiệu là TFG0 trên hình 3.11, bằng trực quan có thể thấy mẫu dạng bột có màu vàng. Màu vàng đặc trưng cho sự có mặt của vật liệu chứa sắt oxit.
3.1.3.1. Ảnh hưởng của độ pH dung dịch thủy nhiệt
Điều chỉnh pH dung dịch thuỷ nhiệt ở các giá trị 5, 7 và 11 với nhiệt độ phản ứng là 150 oC và thời gian thực hiện là 8 giờ. Việc điều chỉnh pH được
thực hiện với việc thêm các thể tích NaOH 1M khác nhau và dung dịch được kiểm tra pH bằng thiết bị đo pH trước khi thực hiện phản ứng thủy nhiệt. Các mẫu vật liệu tổ hợp 2 oxit TiO2-Fe2O3 thu được sau phản ứng thủy nhiệt được đánh giá bằng kỹ thuật nhiễu xạ tia X để xác định sự hình thành vật liệu tổ hợp. Phổ nhiễu xạ tia X của các mẫu vật liệu sản phẩm được thể hiện trên hình 3.12.
Kết quả khảo sát cho thấy: Đối với môi trường trung tính và kiềm, vật liệu tổ hợp 2 oxit TiO2-Fe2O3 (TFG0), tồn tại ở dạng vô định hình, các pic đặc trưng cho các pha tinh thể của TiO2 và Fe2O3 không xuất hiện. Khi pH của dung dịch thủy nhiệt là môi trường axit, trên giản đồ XRD (pH5), xuất hiện các pic đặc trưng cho pha anatas của TiO2 (theo thẻ chuẩn JCPDS 21-1272).
Các pic đặc trưng cho pha tinh thể của Fe2O3 không xuất hiện trên phổ XRD của mẫu vật liệu TFG0 đã tổng hợp. Điều này có thể giải thích là do Fe2O3 tồn tại ở dạng vô định hình. Sự có mặt và trạng thái oxy hóa của sắt sẽ được chứng minh thông qua quá trình phân tích, đánh giá phổ quang điện tử XPS của vật liệu TFG tại mục 3.1.4.2.
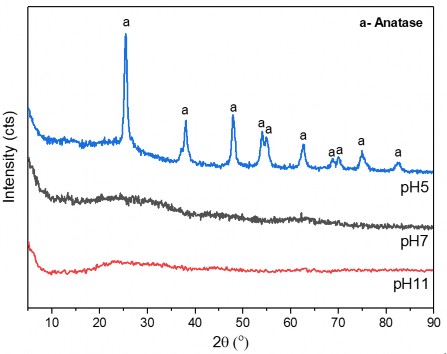
Hình 3.12. Giản đồ XRD của vật liệu TFG0 thủy nhiệt với môi trường axit (TFG0 (pH5)), trung tính (TFG0 (pH7)) và kiềm (TFG0 (pH11))
Kết luận: Môi trường phù hợp cho quá trình tổng hợp vật liệu tổ hợp 2 oxit TiO2- Fe2O3 là môi trường axit mà cụ thể ở đây là môi trường pH5. Dung dịch tiền chất có pH bằng 5 do đó khi thủy nhiệt không cần phải điều chỉnh pH.
3.1.3.2. Ảnh hưởng của thời gian thủy nhiệt
Để đánh giá ảnh hưởng của thời gian thủy nhiệt đến đặc trưng, tính chất vật liệu, tiến hành khảo sát ở các giá trị bao gồm 2 giờ, 4 giờ, 6 giờ, 8 giờ và 10 giờ với pH dung dịch được giữ nguyên từ dung dịch tiền chất là 5 và nhiệt độ thực hiện phản ứng thuỷ nhiệt là 150 oC. Mẫu vật liệu sau thực hiện phản ứng được đánh giá cấu trúc bằng kỹ thuật nhiễu xạ tia X.
Giản đồ XRD được trình bày trên hình 3.13. Kết quả cho thấy khi nhiệt độ thuỷ nhiệt tăng, độ tinh thể của vật liệu tổ hợp TiO2- Fe2O3 tăng dần từ 2 giờ lên đến 10 giờ.
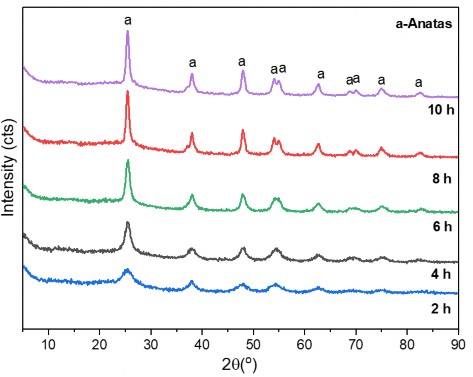
Hình 3.13. Giản đồ XRD của các mẫu vật liệu tổ hợp oxit Fe2O3 -TiO2 với thời gian thuỷ nhiệt khác nhau.
Các pic đặc trưng cho TiO2 (tham chiếu theo thẻ chuẩn JCPDS 21-1272) xuất hiện ở vị trí góc 2θ là 25,60o, 38,05o, 48,25o, 54,25o và 63,05o ở hầu hết
các mẫu nhưng chiều cao tăng dần từ 2 giờ lên đến 8 giờ. Trên giản đồ XRD của mẫu thuỷ nhiệt ở 4 giờ bắt đầu hình thành pic ở 74,95 o và 82,35 o với cường độ thấp. Ở mẫu thuỷ nhiệt với thời gian là 6 giờ pic đơn ở 55,25 o bắt đầu tách đôi thành hai pic 54,25 o và 55,05 o. Bộ pic đôi này được quan sát rõ ràng hơn ở mẫu thuỷ nhiệt với thời gian là 8 giờ và 10 giờ. Ngoài ra, bộ pic đôi ở 68,05 o và 70,55 o cũng tách biệt từ pic đơn không rõ ràng ở 69,85 o ở các mẫu thuỷ nhiệt với thời gian nhỏ hơn 8 giờ. Các bộ pic đôi này đều đặc trưng cho pha anatas của TiO2. Trong thành phần vật liệu có oxit Fe2O3, tuy nhiên có thể tồn tại ở dạng vô định hình nên không thể xác định bằng kỹ thuật XRD.
Mặt khác, việc xác định kích thước tinh thể được tính toán thông qua phương trình Debye-Scherrer. Kết quả xác định kích thước tinh thể theo phương trình này được lấy theo giá trị độ bán rộng β (FWHM) ở góc nhiễu xạ 25,6o là pic đặc trưng cho TiO2 dạng anatas, kết quả trình bày tại bảng 3.1.
Bảng 3.1. Kích thước tinh thể TiO2 ở thời gian thuỷ nhiệt khác nhau.
Thời gian thủy nhiệt (giờ) | Giá trị FWHM | Kích thước tinh thể trung bình (nm) | Khối lượng vật liệu (g) | |
1 | 2 | 0,292 | 27,146 | 3,262 |
2 | 4 | 0,312 | 25,406 | 4,933 |
3 | 6 | 0,395 | 20,068 | 6,251 |
4 | 8 | 0,463 | 17,120 | 6,827 |
5 | 10 | 0,464 | 17,083 | 6,834 |
Có thể bạn quan tâm!
-
 Quy Trình Kỹ Thuật Tổng Hợp Vật Liệu Gnp Từ Graphit Tự Nhiên
Quy Trình Kỹ Thuật Tổng Hợp Vật Liệu Gnp Từ Graphit Tự Nhiên -
 Xác Định Đặc Trưng Bề Mặt, Đặc Trưng Nhiệt Của Vật Liệu
Xác Định Đặc Trưng Bề Mặt, Đặc Trưng Nhiệt Của Vật Liệu -
 Đánh Giá Hiệu Quả Xử Lý Nước Nhiễm Cr (Vi) Sau Xử Lý
Đánh Giá Hiệu Quả Xử Lý Nước Nhiễm Cr (Vi) Sau Xử Lý -
 Nghiên Cứu Quá Trình Chế Tạo Vật Liệu Tổ Hợp Tio2- Fe2O3/gnp
Nghiên Cứu Quá Trình Chế Tạo Vật Liệu Tổ Hợp Tio2- Fe2O3/gnp -
 Giản Đồ Xrd Của Các Mẫu Tfg20 Thủy Nhiệt Ở Các Nhiệt Độ Khác Nhau
Giản Đồ Xrd Của Các Mẫu Tfg20 Thủy Nhiệt Ở Các Nhiệt Độ Khác Nhau -
 Khảo Sát Một Số Đặc Trưng Của Vật Liệu Tổ Hợp Tio2- Fe2O3/gnp
Khảo Sát Một Số Đặc Trưng Của Vật Liệu Tổ Hợp Tio2- Fe2O3/gnp
Xem toàn bộ 173 trang tài liệu này.
Hiệu suất của phản ứng thuỷ nhiệt tạo tổ hợp oxit TiO2- Fe2O3 được đánh giá thông qua khối lượng mẫu vật liệu thu được sau quá trình chế tạo. Kết quả cho thấy khi tăng thời gian từ 2 giờ đến 6 giờ thì khối lượng vật liệu tăng đáng kể. Tuy nhiên, khối lượng vật liệu thu được không tăng nhiều khi kéo dài thời
gian thuỷ nhiệt đến 8 giờ và gần như không tăng thêm vật liệu khi tăng thời gian phản ứng lên đến 10 giờ.
Kết quả nghiên cứu về kích thước tinh thể của TiO2 trong tổ hợp TiO2- Fe2O3 cũng cho thấy khi thời gian thuỷ nhiệt tăng từ 2 giờ lên đến 8 giờ thì kích thước hạt tinh thể giảm đáng kể nhưng không tiếp tục giảm khi tăng thời gian thuỷ nhiệt lên đến 10 giờ. Kết qủa đánh giá độ tinh thể của vật liệu cũng đã được tìm ra quy luật trong phạm vi nghiên cứu. Điều này cho thấy thời gian thuỷ nhiệt phù hợp hơn cả là 8 giờ.
3.1.3.3. Ảnh hưởng của nồng độ Ti trong dung dịch thủy nhiệt
Để khảo sát ảnh hưởng của nồng độ dung dịch thủy nhiệt ta tiến hành hòa tan tinh quặng ilmenit sau nung trong các thể tích dung dịch khác nhau 100 mL, 200mL, 500mL, 1000 mL và 1200 mL dung dịch H2SO4 10%, rồi tiến hành thủy nhiệt ở nhiệt độ 150oC, với pH dung dịch là 5, thời gian thủy nhiệt là 8 giờ. Kích thước hạt được xác định theo kích thước tinh thể của TiO2 theo phương trình Debye-Scherrer, kết quả tính toán được thể hiện trên bảng 3.2.
Bảng 3.2. Ảnh hưởng của thể tích dung dịch hòa tan đến kích thước hạt trung bình của vật liệu tổ hợp TFG0
Thể tích dung dịch sử dụng (mL) | Góc nhiễu xạ θ (o) | FWHM (o) | Kích thước hạt trung bình d (nm) | |
1 | 100 | 25,460 | 0,297 | 27,1 |
2 | 200 | 25,641 | 0,325 | 24,8 |
3 | 500 | 25,482 | 0,393 | 20,5 |
4 | 1000 | 25,405 | 0,463 | 17,4 |
4 | 1200 | 25,410 | 0,466 | 17,3 |
Khi thể tích dung dịch hòa tan tăng lên, nồng độ dung dịch giảm theo, các mẫu vật liệu tổ hợp thu được có kích thước giảm dần. Điều này có thể giải thích là với nồng độ dung dịch thủy nhiệt lớn, các mầm tinh thể được tạo thành
với mật độ cao cho nên các hạt tinh thể được tạo ra có xu hướng kết hợp với nhau tạo thành tinh thể có kích thước lớn hơn. Đối với nồng độ dung dịch thủy nhiệt nhỏ, các tinh thể khi tạo thành sẽ có không gian cho phát triển riêng rẽ và nhờ vào quá trình khuấy trộn sẽ phân tán đều trong dung dịch, do đó kích thước hạt sẽ nhỏ hơn so với trường hợp nồng độ dung dịch lớn. Khi thể tích dung dịch hòa tan vượt quá 1000 mL, kích thước hạt gần như không đổi. Như vậy, thể tích dung dịch hòa tan tối ưu là 1000 mL, ở thể tích này nồng độ Ti và Fe trong dung dịch sau khi hòa tan được xác định bằng phương pháp ICP-MS là 2,46 g/L và 0,57 g/L.
Vì vậy luận án lựa chọn thời gian thủy nhiệt thích hợp là 8 giờ, môi trường thủy nhiệt là môi trường axit với pH5, thể tích dung dịch hòa tan sử dụng 1000 mL dung dịch H2SO4 10% (nồng độ Ti trong dung dịch xác định bằng phương pháp ICP là 2,46 g/L). Mẫu TFG0 thủy nhiệt ở điều kiện tối ưu đã lựa chọn được đem đi khảo sát các đặc trưng của vật liệu.
3.1.3.4. Khảo sát các đặc trưng của vật liệu tổ hợp TiO2- Fe2O3
Hình thái học của vật liệu tổ hợp TiO2- Fe2O3 (TFG0) được khảo sát thông qua phương pháp chụp ảnh SEM. Kết quả đo được thể hiện trên hình 3.14.

Hình 3.14. Ảnh SEM (a) và TEM (b) của vật liệu tổ hợp TFG0
Hình 3.14 cho thấy hình thái học của vật liệu tổ hợp oxit 2 oxit Fe-Ti được tổng hợp từ ilmenit. Ảnh SEM của mẫu vật liệu cho thấy vật liệu phân bố tương






