Dự phòng HIV kháng thuốc thành công: là những bệnh nhân có tải lượng HIV RNA < 1.000 bản sao/ml khi kết thúc nghiên cứu, bệnh nhân vẫn còn tiếp tục điều trị phác đồ bậc 1 tại thời điềm 12 tháng sau khi bắt đầu điều trị ARV.
18. HIV kháng thuốc không được phân loại:
Những bệnh nhân tại điểm kết thúc chuyển đi hoặc tử vong có thể không được phân loại. Do vậy, bệnh nhân chuyển đi và và tử vong sẽ được loại ra khỏi tử số và mẫu số trước khi ước tính tỉ lệ hiện nhiễm của HIVKT tại điểm kết thúc.
2.2.2.4. Các kết quả của HIV kháng thuốc áp dụng trong nghiên cứu
HIV kháng thuốc trước điều trị ARV: Được xác định khi có các đột biến
HIV kháng thuốc vào thời điểm trước khi bắt đầu điều trị ARV.
Có thể bạn quan tâm!
-
 Hiv Kháng Thuốc Mắc Phải Trên Người Đang Điều Trị Arv
Hiv Kháng Thuốc Mắc Phải Trên Người Đang Điều Trị Arv -
 Mô Tả Thực Trạng Cảnh Báo Sớm Hiv Kháng Thuốc Tại Cơ Sở Điều Trị
Mô Tả Thực Trạng Cảnh Báo Sớm Hiv Kháng Thuốc Tại Cơ Sở Điều Trị -
 Cách Tính Các Chỉ Số Cảnh Báo Sớm Hiv Kháng Thuốc
Cách Tính Các Chỉ Số Cảnh Báo Sớm Hiv Kháng Thuốc -
 Mô Tả Thực Trạng Cảnh Báo Sớm Hiv Kháng Thuốc Tại 42 Cơ Sở Điều
Mô Tả Thực Trạng Cảnh Báo Sớm Hiv Kháng Thuốc Tại 42 Cơ Sở Điều -
 Tổng Hợp Các Phòng Khám Có Ít Nhất Một Chỉ Số Cảnh Báo Sớm Hiv
Tổng Hợp Các Phòng Khám Có Ít Nhất Một Chỉ Số Cảnh Báo Sớm Hiv -
 Đặc Tính Lâm Sàng, Miễn Dịch Tại Thời Điểm Kết Thúc Nghiên Cứu – 12
Đặc Tính Lâm Sàng, Miễn Dịch Tại Thời Điểm Kết Thúc Nghiên Cứu – 12
Xem toàn bộ 193 trang tài liệu này.
HIV kháng thuốc tại thời điểm 12 tháng sau điều trị ARV phác đồ bậc 1: gồm 3 kết quả sau:
- Dự phòng HIV kháng thuốc: được xác định khi người nhiễm HIV vẫn đang điều trị ARV phác đồ bậc 1 và có tải lượng HIV kháng thuốc < 1000 bản sao/ml.
- HIV kháng thuốc: được xác định khi gồm đủ các điều kiện dưới đây:
+) vẫn đang điều trị ARV phác đồ bậc 1 tại thời điểm 12 tháng sau khi bắt đầu điều trị hoặc vào thời điểm trước khi chuyển sang phác đồ ARV bậc 2 nhưng vẫn trong vòng 12 tháng sau điều trị;
+) có tải lượng HIV tại thời điểm trên ≥ 1000 bản sao/ml;
+) có các đột biến gen HIV kháng thuốc ARV.
- Có khả năng có HIV kháng thuốc: được xác định khi tại thời điểm 12 tháng sau điều trị ARV, khi bệnh nhân thuộc một trong các tình huống dưới đây:
+) bỏ điều trị hoặc ngừng điều trị;
+) có tải lượng HIV ≥ 1000 bản sao/ml nhưng không phát hiện được các đột
biến HIV kháng thuốc.
+) không có mẫu để thực hiện xét nghiệm tải lượng HIV
2.2.2.4. Các chỉ số nghiên cứu:
Tại thời điểm bắt đầu điều trị ARV
1. Tỷ lệ % bệnh nhân có tiền sử điều trị ARV
2. Tỷ lệ % bệnh nhân nữ tại cơ sở điều trị có uống ARV để dự phòng lây truyền HIV từ mẹ sang con trước đó.
3. Tỷ lệ % bệnh nhân có đột biến HIV kháng thuốc tại thời điểm bắt đầu điều
trị.
4. Các dạng đột biến HIV kháng thuốc ở các bệnh nhân bắt đầu điều trị ARV
với phác đồ bậc 1 tại thời thời điểm bắt đầu điều trị ARV.
5. Các yếu tố liên quan đến sự xuất hiện của HIV kháng thuốc tại thời điểm
bắt đầu điều trị.
Các đầu ra của HIV kháng thuốc tại thời điểm 12 tháng sau khi bắt đầu điều
trị ARV bậc 1:
1. Tỷ lệ % dự phòng HIV kháng thuốc thành công
2. Tỷ lệ % có khả năng HIV kháng thuốc
3. Tỷ lệ % HIV kháng thuốc
4. Tỉ lệ % xuất hiện mới đột biến HIV kháng thuốc
5. Các dạng đột biến HIV kháng thuốc
Các yếu tố liên quan
Các yếu tố này được phân tích tại thời điểm kết thúc nghiên cứu dựa vào các số liệu thu thập được từ các bệnh nhân tại thời điểm kết thúc (trừ các bệnh nhân chuyển đi và tử vong).
Các yếu tố liên quan
Các yếu tố này được phân tích tại thời điểm kết thúc nghiên cứu dựa vào các số liệu thu thập được từ các bệnh nhân tại thời điểm kết thúc (trừ các bệnh nhân chuyển đi và tử vong).
1. Một số đặc điểm nhân khẩu học: Tuổi, giới, đường lây truyền, nghề
nghiệp, nơi cư trú;
2. Tiền sử điều trị ARV; có đột biến HIV lúc khởi trị;
3. Tuân thủ điều trị của bệnh nhân: 1) Tỉ lệ % đến tái khám đúng hẹn; 2) Tỉ lệ % bệnh nhân theo dõi có >80% đến tái khám đúng hẹn giữa thời điểm bắt đầu và kết thúc; 3) Tỉ lệ bệnh nhân nhận thuốc đúng hẹn;4) Tỉ lệ tuân thủ điều trị ARV: Tỉ lệ bệnh nhânuống thuốc ARV trong vòng 30 ngày trước thời điểm T2.
4. Giai đoạn lâm sàng tại T1
5. Tế bào TCD4: lúc bắt đầu điều trị, sự thay đổi giữa T1 và T2
6. Tải lượng HIV tại T1
7. Các bệnh nhiễm trùng cơ hội, bao gồm mắc và điều trị lao lúc khởi trị và giữa T1 và T2
Cách tính các chỉ số nghiên cứu được mô tả ở phụ lục 15.
2.2.3. Quy trình thực hiện nghiên cứu
2.2.3.1. Thu nhận bệnh nhân tại thời điểm bắt đầu điều trị ARV (T1)
Trước khi thu thập số liệu tất cả các nghiên cứu viên đều được tập huấn về mục đích, quy trình nghiên cứu, cách thức thu thập thông tin. Các nghiên cứu viên đồng thời tiến hành tập huấn cho bác sĩ điều trị, cán bộ tư vấn, dược sĩ cấp phát thuốc tại các PKNT thực hiện nghiên cứu về mục đích và các quy định trong nghiên cứu,quy trình nghiên cứu, quy trình lấy mẫu, xử lý mẫu, bảo quản và vận chuyển mẫu, các biểu mẫu và cách thức thu thập thông tin vào các phiếu.
Trong ngày đầu tiên thực hiện nghiên cứu, các nghiên cứu viên trực tiếp làm việc với các cán bộ tại PKNT theo sát từng khâu trong quy trình nghiên cứu, từ việc
tư vấn bệnh nhân ban đầu cho đến lúc mẫu máu được lấy và xử lý. Tất cả các vấn đề phát sinh trong lần thu thập đầu tiên đều được các nghiên cứu viên thảo luận và rút kinh nghiệm với toàn bộ nhân viên của PKNT.
Các mẫu thu thập thông tin được chuyển về nhóm nghiên cứu. Khi có bất kỳ các thông tin nào không rõ ràng, thì các nghiên cứu viên đều hỏi lại nhân viên PKNT để được làm rõ. Nhóm nghiên cứu thảo luận với các cán bộ tại phòng khám và quyết định lựa chọn ngày bắt đầu thực hiện nghiên cứu. Các bệnh nhân nhiễm HIV đến đăng ký điều trị tại các PKNT đều được khám, đánh giá giai đoạn lâm sàng và tiến hành các xét nghiệm cần thiết theo quy định thường quy của Bộ Y tế. Các nhân viên y tế tại phòng khám rà soát tất cả các bệnh nhân chưa điều trị ARV. Các trường hợp đủ tiêu chuẩn điều trị ARV theo quy định của Bộ Y tế được tư vấn và tiến hành điều trị theo quy trình điều trị HIV/AIDS thường quy.
Trong lần tư vấn cuối cùng, các bệnh nhân đủ điều kiện tham gia nghiên cứu được cán bộ tư vấn giới thiệu về mục đích, nội dung nghiên cứu, ý nghĩa của nghiên cứu và tìm hiểu xem bệnh nhân có muốn tham gia nghiên cứu hay không. Nếu không đồng ý tham gia, bệnh nhân vẫn được tiến hành điều trị ARV theo quy trình thường quy tại cơ sở điều trị. Nếu bệnh nhân đồng ý tham gia nghiên cứu, bệnh nhân ký xác nhận vào “Phiếu đồng ý tham gia vào nghiên cứu” (Phụ lục 10).
Kể từ lúc bắt đầu triển khai nghiên cứu tại cơ sở điều trị, các bệnh nhân đồng ý tham gia được lấy vào nhóm nghiên cứu liên tục cho đến khi đạt được cỡ mẫu theo qui định. Nhằm đảm bảo tính bí mật tối đa cho bệnh nhân, mỗi bệnh nhân tham gia nghiên cứu có một mã số nghiên cứu (HIVKT-MID) riêng biệt mà không ghi lại tên tuổi hay các thông tin nhận dạng khác vào phiếu nghiên cứu. Mã số nghiên cứu được dán vào bệnh án, phiếu theo dõi cũng như các ống xét nghiệm.
2.2.3.2. Tiến trình nghiên cứu
Tiến trình nghiên cứu được trình bày trong Sơ đồ 2.1
Sơ đồ 2.1. Sơ đồ thực hiện nghiên cứu theo dõi HIV kháng thuốc
Thu thập mẫu tại thời điểm bắt đầu nghiên cứu (T1)
Tại thời điểm trước khi bắt đầu điều trị ARV, mỗi bệnh nhân được thu thập các thông tin sau vào Phiếu thu thập thông tin bệnh nhân tại thời điểm bắt đầu điều trị (Phụ lục 11):
- Đặc điểm nhân khẩu học, giai đoạn lâm sàng, số lượng tế bào CD4, tiền sử điều trị ARV, phác đồ ARV đã sử dụng và thời điểm bắt đầu điều trị. Các biến số thu thập được trình bày tại mục 2.2.7.1. Các biến số nghiên cứu này được thu thập từ bệnh án ngoại trú của bệnh nhân.
- Thông tin về việc thu thập, xử lý, vận chuyển và bảo quản mẫu.
- Ngày đầu tiên đến nhận thuốc (trước lúc bệnh nhân uống thuốc), mỗi bệnh
nhân được tư vấn và lấy máu để tiến hành xét nghiệm tải lượng HIV. Các trường hợp có xét nghiệm tải lượng HIV trên 1000 bản sao/ml được giải trình tự gen để làm xét nghiệm HIV kháng thuốc.
Trong thời gian theo dõi bệnh nhân từ T1 đến T2: Vào tất cả các lần bệnh nhân đến khám và lĩnh thuốc, các thông tin về ngày hẹn khám và ngày đến được ghi nhận trong Phiếu ngày tái khám (Phụ lục 13)
Thu thập dữ liệu và lấy mẫu tại thời điểm kết thúc (T2): mỗi bệnh nhân được thu thập các thông tin sau vào Phiếu thu thập thông tin bệnh nhân tại thời điểm kết thúc điều trị (Phụ lục 12):
Thời điểm T2 là thời điểm bệnh nhân duy trì phác đồ ARV bậc 1 sau 12 tháng điều trị ARV phác đồ bậc 1 hoặc được chuyển sang phác đồ bậc 2 nhưng vẫn nằm trong 12 tháng sau điều trị ARV phác đồ bậc 1. Các xét nghiêm liên quan đến quá trình theo dõi bệnh nhân như xét nghiệm tế bào TCD4, sinh hóa, huyết học được làm theo quy trình bình thường của phòng khám.
Tại thời điểm này, các bệnh nhân được:
- Thu thập thông tin về tuân thủ điều trị trong vòng 30 ngày trước thời điểm
T2 (phụ lục 14)
- Lấy máu xét nghiệm tải lượng vi rút.Các mẫu có tải lượng HIV>1.000 bản sao/ml đượcgiải trình tự gen và làm xét nghiệm gen HIV kháng thuốc.
- Thời điểm bắt đầu và thời điểm kết thúc nghiên cứu được ghi trực tiếp vào “Phiếu thu thập thông tin bệnh nhân tại thời điểm bắt đầu và kết thúc”. Tất cả các phân loại bệnh nhân tại thời điểm kết thúc của cơ sở điều trị được ghi nhận và xác minh trong quá trình phân tích.
- Tổng số có 501 BN được thu thập theo mã số nghiên cứu (phụ lục 16)
2.2.3.3. Thu thập, vận chuyển, xử lý và theo dõi mẫu
- Tại thời điểm T1: Các bệnh nhân tham gia nghiên cứu được lấy mẫu máu
vào buổi sáng của ngày nhận thuốc ARV đầu tiên.
- Tại thời điểm T2: các bệnh nhân vẫn còn duy trì phác đồ bậc 1 ở 12 tháng sau khi bắt đầu sử dụng thuốc ARV hoặc các bệnh nhân chuyển sang phác đồ bậc 2 được tiến hành lấy máu. Mẫu máu thu thập từ bệnh nhân chuyển sang phác đồ bậc 2 được lấy trước khi bệnh nhân uống thuốc ARV phác đồ bậc 2.
Bệnh nhân được lấy 6 ml máu để làm tải lượng HIV và xét nghiệm HIV kháng thuốc. Mỗi nhóm bệnh nhân đều được hẹn tái khám, nhận thuốc cùng một ngày, do vậy các mẫu của nhóm bệnh nhân vẫn còn duy trì phác đồ bậc 1 sau 12 tháng điều trị được lấy trong cùng một ngày. Với các bệnh nhân không đến tái khám và nhận thuốc theo lịch (có thể sớm hoặc trễ hơn) cũng được lấy mẫu và vận chuyển về phòng xét nghiệm để được tách huyết tương và lưu vào tủ âm sâu.
Quy trình lấy mẫu được thực hiện theo đúng quy định về thực hành tốt phòng xét nghiệm đối với xét nghiệm sinh học phân tử (GLP).
Các mẫu lấy tại thời điểm kết thúc cho những bệnh nhân chuyển sang phác đồ bậc 2 và những bệnh nhân còn duy trì phác đồ điều trị ARV bậc 1 tại thời điểm 12 tháng được đo tải lượng virút và những mẫu có tải lượng virút≥1000 bản sao/ml được làm xét nghiệm HIV kháng thuốc xác định tỷ lệ đột biến HIV kháng thuốc sau một năm điều trị ARV.
Các mẫu được làm xét nghiệm tải lượng HIV và xét nghiệm gen HIV kháng thuốc tại phòng xét nghiệm sinh học phân tử của Viện Pasteur Tp. HCM. Đây là phòng xét nghiệm được Tổ chức Y tế thế giới công nhận là phòng xét nghiệm định gen HIV kháng thuốc đạt tiêu chuẩn của Tổ chức Y tế thế giới vào năm 2012. Các kỹ thuật xét nghiệm tải lượng virút tại Viện Pastuer đã được chuẩn thức sau khi tham gia vào hệ thống kiểm tra chất lượng quốc tế (EQA): ARN được tách chiết bằng hệ thống máy tách chiết tự động MagNA Pure - Roche. Sử dụng kỹ thuật real- time RT-PCR với kit GeneriqueCharge Viral – Biocentric để xác định nồng độ HIV ARN tự do trong máu.
Quy trình tổ chức lấy mẫu được trình bày trong Sơ đồ2.2.
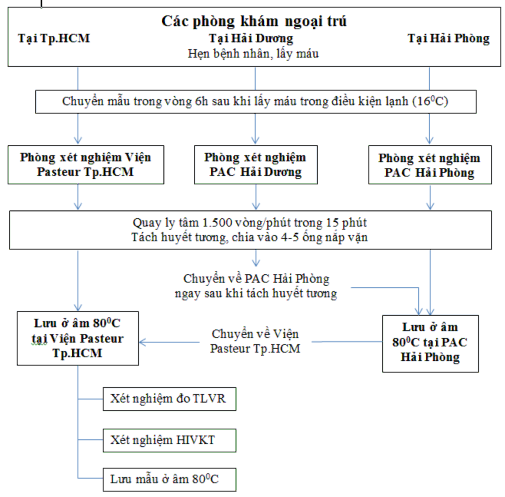
Sơ đồ 2.2. Sơ đồ lấy mẫu, vận chuyển và xử lý mẫu trong nghiên cứu
Những bệnh phẩm có nồng độ HIV-ARN ≥1000 bản sao/ml (tương đuơng 3logbảnsao/mL) được khuếch đại và giải trình tự trên vùng gen Pol (~1800bp) bao gồm toàn bộ gen Prot (protease)và tối thiểu 250 codon đầu của gen RT (reverse transcriptas). Đây là 2 gen liên quan đến đích tác động của thuốc ARV trong chu trình nhân lên của HIV.
Chuỗigen của các mẫu giải trình tự thành công sẽ được phân tích bằng phần mềm Seqman – DNASTAR V9.0, sau đó được nhập vào ngân hàng dữ liệu trực tuyến về HIVKT – Stanford phiên bản tháng 5/2013 để đánh giá tình trạng kháng