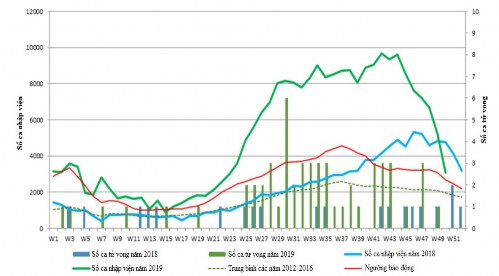
Hình 1.2: Số ca sốt xuất huyết Dengue nhập viện và tử vong theo tuần năm 2018 và 2019
* Nguồn: theo WHO (2020)
Ở Việt Nam, SXHD phân bố không đều. Theo báo cáo của cục y tế
dự phòng, số ca mắc SXHD tích lũy tới tuần 37 năm 2020 tập trung chủ
yếu ở khu vực phía Nam với 57%, thấp hơn ở miền Trung với 33% và khá ít ở khu vực Tây nguyên và miền Bắc chiếm lần lượt 6% và 5% .
1.2. Cơ chế bệnh sinh của sốt xuất huyết Dengue
Cho đến nay, cơ chế bệnh sinh của sốt xuất huyết Dengue còn nhiều điểm chưa rõ ràng. Dựa vào hai học thuyết được được công nhận nhiều nhất là thuyết độc lực virus và thuyết miễn dịch tăng cường và các nghiên cứu gần đây, cơ chế bệnh sinh của sốt xuất huyết Dengue có thể được tóm tắt thông qua vai trò của các yếu tố tham gia như sau:
Có thể bạn quan tâm!
-
 Nghiên cứu tính đa hình gen MBL2, FCN2 và nồng độ protein MBL, Ficolin-2 ở bệnh nhân sốt xuất huyết Dengue - 1
Nghiên cứu tính đa hình gen MBL2, FCN2 và nồng độ protein MBL, Ficolin-2 ở bệnh nhân sốt xuất huyết Dengue - 1 -
 Nghiên cứu tính đa hình gen MBL2, FCN2 và nồng độ protein MBL, Ficolin-2 ở bệnh nhân sốt xuất huyết Dengue - 2
Nghiên cứu tính đa hình gen MBL2, FCN2 và nồng độ protein MBL, Ficolin-2 ở bệnh nhân sốt xuất huyết Dengue - 2 -
 Giá Trị Phân Biệt 2 Nhóm Bệnh Dhf Và Dws Của Protein 83
Giá Trị Phân Biệt 2 Nhóm Bệnh Dhf Và Dws Của Protein 83 -
 Nghiên cứu tính đa hình gen MBL2, FCN2 và nồng độ protein MBL, Ficolin-2 ở bệnh nhân sốt xuất huyết Dengue - 5
Nghiên cứu tính đa hình gen MBL2, FCN2 và nồng độ protein MBL, Ficolin-2 ở bệnh nhân sốt xuất huyết Dengue - 5 -
 Chức Năng Của Protein Ficolin2 Gắn Với Carbohydrate
Chức Năng Của Protein Ficolin2 Gắn Với Carbohydrate -
 Vai Trò Của Mbl, Ficolin2 Và Tính Đa Hình Gen Mbl2, Fcn2 Trong Sốt Xuất Huyết Dengue
Vai Trò Của Mbl, Ficolin2 Và Tính Đa Hình Gen Mbl2, Fcn2 Trong Sốt Xuất Huyết Dengue
Xem toàn bộ 189 trang tài liệu này.
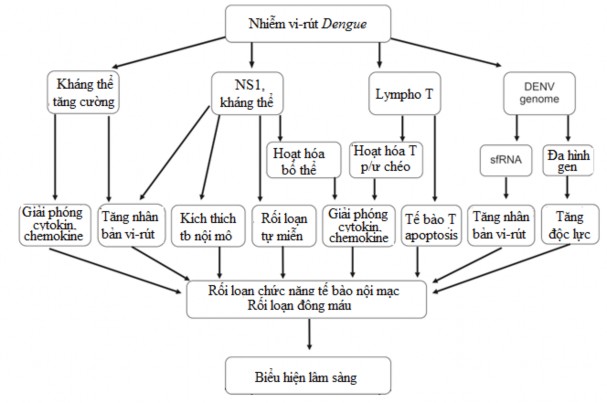
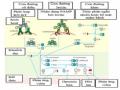
Hình 1.3: Cơ chế bệnh sinh của sốt xuất huyết Dengue
*Nguồn: theo Pang X. và cs (2017)
Vai trò của NS1 và kháng thể kháng NS1
NS1 là protein không cấu trúc của virus Dengue, được biểu hiện ở
nhiều dạng oligomer khác nhau gắn ở nhiều vị trí của tế bào: trong màng tế bào, bề mặt tế bào và hòa tan trong dịch ngoại bào . Trong quá trình nhiễm virus Dengue, protein NS1 được tiết mạnh vào huyết thanh của bệnh nhân, nồng độ NS1 tương quan với mức độ nghiêm trọng của bệnh và góp phần
vào cơ chế bệnh sinh của SXHD ở vật chủ , . Thật vậy, DENVNS1 có thể liên kết trực tiếp với bề mặt của tế bào chủ để gây tổn thương mô . Một nghiên cứu gần đây đã chứng minh DENVNS1 kích thích sản xuất cytokine
gây viêm bằng cách kích hoạt các đại thực bào và tế bào đơn nhân trong
máu ngoại vi của con người (PBMCs) thông qua thụ thể Tolllike 4 (TLR4), do đó dẫn đến sự phá vỡ tính toàn vẹn đơn lớp tế bào nội mô mạch máu .
Hơn nữa, DENVNS1 cũng kích hoạt hoạt hóa bổ thể, gây thoát huyết
tương. Trong quá trình này, DENVNS1 hòa tan được giải phóng từ các tế bào bị nhiễm và trực tiếp hoạt hóa bổ thể trong máu. Một mối tương quan chặt chẽ đã được tìm thấy giữa nồng độ DENVNS1 và sự hình thành phức
hợp C5bC9. Phức hợp C5bC9 có thể
kích thích sự
biểu hiện mạnh mẽ
của các cytokine gây viêm dẫn đến tiến triển bệnh sốt xuất huyết Dengue . Gần đây, DENVNS1 được chứng minh có thể tạo ra chế độ tự chuyển hóa trong dòng tế bào nội mô người (HMEC1) cũng như trên chuột từ đó làm rối loạn chức năng tế bào nội mô .
Ngoài protein NS1, các kháng thể kháng NS1 cũng góp phần quan
trọng vào cơ chế bệnh sinh của SXHD. Sự kết hợp giữa kháng thể kháng NS1 với protein GPINS1 trên màng tế bào có thể kích hoạt tín hiệu tế bào dẫn đến phosphoryl hóa tyrosine làm tăng cường sao chép DENV trong tế
bào bị nhiễm . Quá trình phosphoryl hóa protein và kích hoạt NFκB đã
được quan sát thấy sau khi kích thích các tế bào HMEC1 bằng các kháng thể kháng DENVNS1. Hơn nữa,biểu hiện một số cytokine và chemokine, như IL6, IL8, và MCP1 tăng lên sau khi tế bào nội mô được kích thích bởi kháng thể kháng DENVNS1 . Rối loạn giải phóng cytokine được coi là yếu tố chính trong cơ chế bệnh sinh của SXHD. Do đó, kích hoạt đáp ứng miễn dịch qua trung gian kháng thể kháng NS1 có thể đóng một vai trò quan
trọng trong sự tiến triển của giảm tiểu cầu và tăng tính thấm thành mạch. Sự khởi phát của các rối loạn tự miễn dịch do kháng thể kháng NS1 cũng
đã được mô tả
là một yếu tố
góp phần vào cơ
chế
bệnh sinh SXHD.
DENVNS1có sự tương đồng về trình tự với một số tự kháng nguyên, như plasminogen, các protein trên các tế bào nội mô và tiểu cầu, các tự kháng thể do NS1 kích thích tạo ra có thể phản ứng chéo với các tự kháng nguyên này , . Những phản ứng này kích thích tổng hợp oxit nitric (NO) và quá trình chết theo chu trình của các tế bào nội mô mạch máu. Tổn thương tế bào nội mô và tiểu cầu có thể góp phần gây giảm tiểu cầu, rối loạn đông máu và tăng tính thấm thành mạch trong SXHD .
Vai trò của bộ gen virus
Sự khác biệt về mặt di truyền giữa các chủng virus Dengue có liên quan đến độc lực virus từ đó dẫn tới sự khác biệt về mức độ nghiêm trọng của bệnh. Một số chủng virus Dengue có độc lực và khả năng gây dịch lớn
hơn những chủng khác. Bên cạnh sự
khác biệt trong bộ
gen giữa các
chủng, các đoạn ARN của virus (subgenomic flavivirus RNAsfRNA) có thể đóng một vai trò nhất định trong qua trình nhân lên của virus trong tế bào chủ, do đó góp phần gây bệnh SXHD. Trong quá trình sao chép DENV,
đoạn ARN 11 kb của virus có thể
bị thoái hóa không hoàn toàn từ
vùng
3’UTR bởi exoribonuclease của vật chủ để tạo ra các ARN nhỏ 0,3 đến 0,5 kb được gọi là sfRNA , . sfRNA có thể tích tụ trong các tế bào bị nhiễm để ngăn chặn các phản ứng miễn dịch kháng virus của vật chủ, như tín hiệu interferon , . sfRNA cũng có thể tạo điều kiện thuận lợi cho việc sao chép virus thông qua việc thay đổi tính ổn định của mARN tế bào bị nhiễm, do đó sfRNA đóng vai trò nhất định trong trốn tránh miễn dịch của virus Dengue và cơ chế bệnh sinh SXHD , .
Vai trò của kháng thể
Bằng chứng dịch tễ học đã chỉ ra rằng nguy cơ mắc SXHD tăng lên có liên quan đến nhiễm trùng thứ phát một chủng virus khác với chủng gây nhiễm nguyên phát . Nguy cơ phát triển SXHD trong lần nhiễm trùng thứ phát cao hơn ít nhất 10 lần so với nguy cơ phát triển tình trạng này trong lần nhiễm trùng nguyên phát . Tỷ lệ này là do các kháng thể gây ra từ lần
nhiễm trùng nguyên phát được gọi là hiện tượng tăng cường phụ thuộc
kháng thể (Antibodydependent enhancement –ADE). Các kháng thể kháng
virus Dengue không những không có hoạt tính trung hòa virus để loại trừ
virus mà còn tạo thành phức hợp virionkháng thể. Mặt khác, các kháng thể có bản chất là IgG có phần Fc gắn được vào thụ thể Fc gamma (FcγR) trên các tế bào đích. FcγR là một phức hợp đa tiểu đơn vị được phân bố trên bề mặt của nhiều loại tế bào miễn dịch, như tế bào đuôi gai, đại thực bào và tế bào mGOT, và nhận biết vùng Fc của các globulin miễn dịch. Sự hấp thu phức hợp virionkháng thể qua trung gian của thụ thể Fcγ (FcγR) vào các tế bào này có thể gây ra tăng lan tràn virus . Do đó, trong quá trình nhiễm virus Dengue, các phức hợp này có thể nhanh chóng xâm nhập vào các tế bào mang FcγR thông qua tương tác với FcγR, dẫn đến số lượng tế bào bị
nhiễm cao hơn khi có mặt so với khi không có kháng thể từ lần nhiễm
nguyên phát . Hơn nữa, các nghiên cứu trước đây cũng đã chỉ ra rằng:
nhiễm DENV qua trung gian FcγR có thể tăng cường sự tái sinh của virus thông qua việc ức chế các đáp ứng miễn dịch nội bào kháng virus, bao gồm các đáp ứng kháng virus qua trung gian interferon và tăng cường sản xuất
IL10 trong các tế
bào bị
nhiễm virus
Dengue. Việc ngăn chặn các phản
ứng miễn dịch của cơ thể có thể thúc đẩy việc sản sinh ra số lượng lớn các virion lây nhiễm.
Ngoài việc tăng cường sự
lan tràn virus
Dengue, hiện tượng tăng
cường phụ thuộc kháng thể qua trung gian FcγR trực tiếp kích thích tiết các cytokine từ các tế bào mast và các tế bào miễn dịch khác từ đó làm rối loạn chức năng tế bào nội mô mạch máu và tăng tính thấm thành mạch.
Vai trò của lympho T
Sự gia tăng sản xuất cytokine và hoạt hóa tế bào TCD8+ đã được
quan sát thấy ở bệnh nhân sốt xuất huyết Dengue nặng đã chỉ ra vai trò của các tế bào T phản ứng chéo trong cơ chế bệnh sinh của SXHD . Tế bào T có trí nhớ miễn dịch từ lần lây nhiễm nguyên phát đã được kích hoạt bởi một chủng virus Dengue khác trong lần lây nhiễm thứ hai. Tuy nhiên, đặc
tính phản
ứng chéo cao và ái lực thấp dẫn đến việc tiêu diệt tế
bào bị
nhiễm bệnh và loại bỏ kiểu huyết thanh vi rút mới nhiễm bệnh của các tế bào này không hiệu quả. Ngược lại, tế bào T phản ứng chéo còn góp phần tăng nguy cơ gây ra SXHD. Các tế bào này sau khi bị kích hoạt bởi chủng Dengue nhiễm thứ phát sẽ tăng cường sản xuất các cytokin và chemokine
như
IFNγ, IL2 và TNFα từ
đó làm tăng mức độ
trầm trọng SXHD , .
Hơn nữa, quá trình tự chết của tế bào T ở bệnh nhân SXHD gópphần vào
tăng mức độ
nghiêm trọng của SXHD , . Nồng độ
IL10 tăng cao trong
huyết thanh của bệnh nhân sốt xuất huyết nặng làm tăng cường chết theo chu trình của các tế bào lympho T từ đó làm giảm sự thanh thải virus và làm
giảm đáp sàng.
ứng kháng virus, dẫn đến các biểu hiện nghiêm trọng trên lâm
1.3. Hệ thống bổ thể
1.3.1. Hệ thống bổ thể
Miễn dịch tự nhiên hay miễn dịch bẩm sinh (natural immunity hay
innate immunity), còn gọi là miễn dịch không đặc hiệu (non specific immunity), là khả năng tự bảo vệ sẵn có và mang tính di truyền trong các cơ thể cùng loài . Miễn dịch tự nhiên không để lại trí nhớ, khá ổn định, ít bị
sai sót. Điểm đặc biệt là hệ miễn dịch bẩm sinh có tính chất di truyền,
khác nhau giữa các loài và các cá thể trong cùng một loài. Các yếu tố thuộc miễn dịch không đặc hiệu là phương tiện chung dùng để chống lại sự xâm nhập các các vi sinh gây bệnh không phân biệt đó là vi khuẩn hay ký sinh trùng hoặc virus. Có nhiều chất, phân tử trong các mô, các dịch của cơ thể tham gia vào quá trình đáp ứng miễn dịch tự nhiên, trong đó, hệ thống bổ thể đóng vai trò quan trọng hơn cả.
Bổ thể được phát hiện bởi Jules Bordet và Paul Ehrlich vào cuối thế kỷ XIX. Trong những năm sau đó, các nhà khoa học đã nghiên cứu và phát
hiện ra rằng sự
hoạt động của bổ
thể
là kết quả
của sự
tương tác giữa
một nhóm phức hệ các glycoprotein. Hầu hết các thành phần của bổ thể
được tổng hợp
ở gan bởi các tế
bào gan, mặc dù một số
cũng được sản
xuất bởi các loại tế bào khác như: bạch cầu đơn nhân, đại thực bào mô, fibroblasts và các tế bào biểu mô của đường tiêu hóa và đường sinh dục , .
Bổ thể hoạt động không có tính chất đặc hiệu loài, bổ thể của bất cứ loài động vật nào cũng có khả năng làm tan vi khuẩn sau khi ngưng kết
với kháng thể
của loài khác. Bất cứ
tế bào nào sau khi bị
kháng thể
làm
ngưng kết cũng có thể bị tan do bổ thể, do đó bổ thể được xếp vào miễn dịch không đặc hiệu. Tuy nhiên hoạt tính của bổ thể là khác nhau giữa các
loài như
cao nhất
ở chuột lang, trung bình ở
người và chó, thấp nhất ở
chuột nhắt và thỏ .
*Hệ thống bổ thể bao gồm các nhóm sau:
Những protein thành phần của bổ thể được đánh số từ C1 đến C9 theo trình tự mà chúng tham gia phản ứng (trừ C4 là ký hiệu theo trình tự phát hiện bổ thể). Trong suốt quá trình hoạt hóa, một vài thành phần cấu trúc bổ thể được phân tách làm 2 phần. Phần lớn hơn của phân tử được gọi là b (binding) thường gắn kết với mầm bệnh, trong khi phần nhỏ hơn gọi là a (activated) có thể phân tán đi (trừ C2: phần lớn là C2a và phần nhỏ là C2b, vì vậy ngày nay để tránh nhầm lẫn, một số tài liệu ký hiệu phần lớn là C2b và phần nhỏ là C2a).
Các yếu tố: B, H, I, P (properdin), MBL, MASP1, MASP2 (MBL Assosiated Serine Protease)
Yếu tố điều hòa: C1 Inhibitor (C1INH=Serpin), C4Binding protein (C4PB), yếu tố tăng cường thoái biến (Decay Accellerating factor), thụ thể 1 (CR1); ProteinS (vitronectin) .
*Các con đường hoạt hóa bổ thể
Sự hoạt hóa bổ
thể
theo phản
ứng dây truyền và theo một trật tự
nhất định. Một bổ thể sau khi hoạt hóa lại có khả năng kích thích sự hoạt hóa của bổ thể tiếp theo. Có 3 con đường hoạt hóa bổ thể là: con đường cổ điển (classical pathway), con đường lectin (lectin pathway), cuối cùng là con đường nhánh (Alternative pathway) .
Con đường cổ điển có thể được bắt đầu bằng sự liên kết của C1q (protein đầu tiên trong hệ thống bổ thể) trực tiếp lên bề mặt mầm bệnh.
Nó cũng có thể
được kích hoạt trong phản
ứng miễn dịch đáp
ứng bằng