cách gắn C1q với kháng thể. Con đường lectin được bắt đầu bằng cách liên kết của với carbohydrates chứa mannose trên bền mặt của vi khuẩn hoặc virus. Cuối cùng là còn đường nhánh có thể được khởi động khi một thành phần bổ thể được kích hoạt tự phát liên kết với bề mặt của mầm bệnh. Mỗi con đường theo một chuỗi các phản ứng khác nhau nhưng cuối cùng để tạo ra một protease gọi là C3 convertase (có khả năng phân tách phân tử C3 thành hai mảnh là C3a và C3b). Protease hoạt động được giữ lại ở bề mặt mầm bệnh và điều này đảm bảo rằng zymogen bổ sung tiếp theo trong con đường cũng được phân cắt và kích hoạt. Ngược lại, đoạn peptide nhỏ được giải phóng khỏi vị trí phản ứng có thể đóng vai trò trung gian hòa tan ,
.
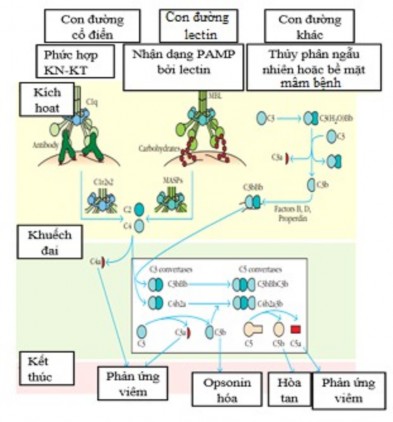
Hình 1.4: Các con đường hoạt hóa bổ thể.
*Nguồn: theo Company W. và cs (2013)
*Vai trò của hệ thống bổ thể:
Hoạt tính làm tan tế bào: phức hợp tấn công màng MAC (membrane
attack complex) chọc thủng màng tế bào, gây chết tế bào.
bào, tạo các lỗ
Có thể bạn quan tâm!
-
 Nghiên cứu tính đa hình gen MBL2, FCN2 và nồng độ protein MBL, Ficolin-2 ở bệnh nhân sốt xuất huyết Dengue - 2
Nghiên cứu tính đa hình gen MBL2, FCN2 và nồng độ protein MBL, Ficolin-2 ở bệnh nhân sốt xuất huyết Dengue - 2 -
 Giá Trị Phân Biệt 2 Nhóm Bệnh Dhf Và Dws Của Protein 83
Giá Trị Phân Biệt 2 Nhóm Bệnh Dhf Và Dws Của Protein 83 -
 Cơ Chế Bệnh Sinh Của Sốt Xuất Huyết Dengue
Cơ Chế Bệnh Sinh Của Sốt Xuất Huyết Dengue -
 Chức Năng Của Protein Ficolin2 Gắn Với Carbohydrate
Chức Năng Của Protein Ficolin2 Gắn Với Carbohydrate -
 Vai Trò Của Mbl, Ficolin2 Và Tính Đa Hình Gen Mbl2, Fcn2 Trong Sốt Xuất Huyết Dengue
Vai Trò Của Mbl, Ficolin2 Và Tính Đa Hình Gen Mbl2, Fcn2 Trong Sốt Xuất Huyết Dengue -
 Chỉ Tiêu Về Lâm Sàng, Cận Lâm Sàng
Chỉ Tiêu Về Lâm Sàng, Cận Lâm Sàng
Xem toàn bộ 189 trang tài liệu này.
trên màng làm tan tế
Tham gia cơ chế opsonin hóa: làm cho việc thực bào dễ dàng hơn.
Tăng cường đáp ứng viêm: các độc tố phản vệ có tác dụng co bóp
cơ trơn, tăng tính thấm thành mạch giúp cho sự thoát mạch, kích thích tế
bào Mast giải phóng các chất trung gian gây viêm như histamin.
Tính hóa hướng động: có khả năng thu hút các tế bào thực bào .
1.3.2. Con đường lectin hoạt hóa bổ thể
Con đường lectin giống với con đường cổ điển, được hoạt hóa thông
qua kích hoạt C3convertase nhờ C4b và C2a. Tuy nhiên, thay vì dựa vào
kháng thể để nhận ra các mối đe dọa từ vi sinh vật và kích hoạt quá trình hoạt hóa. Con đường lectin được khởi động khi protein trong huyết thanh có tên gọi là mannosebinding lectin (lectin gắn mannose, viết tắt là MBL) gắn vào các gốc mannose là thành phần của các glycoprotein hoặc các phân tử carbohydrate trên bề mặt của các vi sinh vật. Vì các gốc mannose chỉ có
trên bề
mặt các vi sinh vật như:
Salmonella, Listeria, Neisseria,
Cryptococcus neoformans của nấm và thậm chí màng của một số virus như
HIV1, chứ
không có trên các tế
bào của động vật có vú nên con đường
lectin được coi là một biện pháp để hệ thống miễn dịch phân biệt “lạ
quen” . Bên cạnh MBL, một họ protein huyết tương có cấu trúc giống
collagen đã được công nhận cũng có thể hoạt hóa bổ thể theo con đường lectin này, trong đó có Ficolin.
Về cơ chế hoạt động, con đường lectin khá giống với con đường cổ
điển. MBL là một protein của pha cấp được tạo ra trong các phản ứng
viêm. Về cấu trúc thì MBL có hình dạng tương tự như phân tử C1q và về chức năng protein này cũng hoạt động tương tự như phân tử C1q trong quá trình hoạt hoá con đường cổ điển. Phân tử MBL gắn với hai phân tử enzym
protease có cấu trúc và hoạt tính tương tự
như
C1r và C1s bám vào là
mannoseassociated serine protease 1 và 2 (lần lượt được kí hiệu là MASP1
và MASP2). Phức hợp MBLMASP1MASP2 hoạt hoá C4 và C2 để tạo
thành C4bC2a mang hoạt tính C3 convertase trong con đường cổ điển. Như vậy con đường lectin hoà vào với con đường cổ điển từ bước hoạt hoá C3.
Các cấu thành liên quan đến sự hình thành của C3/C5 convertase trong các con đường cổ điển .
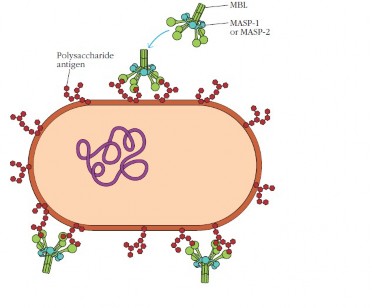
Hình 1.5: Bước đầu khởi động con đường lectin.
*Nguồn: theo Company W. và cs (2013)
1.4. Protein MBL và gen MBL2
1.4.1. Protein MBL
1.4.1.1. Cấu trúc protein MBL
Protein MBL là một phức hợp có cấu trúc xoắn bậc ba. Mỗi chuỗi polypeptid chứa 4 vùng: (1) vùng giàu cysteine gồm 21 acid amin ở đầu N tham gia vào quá trình oligomer hóa bằng cách hình thành các liên kết disulfide nội bộ và giữa các tiểu đơn vị, (2) vùng giống collagen có 59 acid amin bao gồm 20 đoạn lặp song song của GlycineXaaYaa (ngoại trừ đoạn
lặp 8, chỉ bao gồm GlycineGlutamine) chiếm phần cuống dài của phân tử,
(3) một vùng xoắn 30 amino acid, là vùng cổ kỵ nước, rất quan trọng để bắt đầu quá trình oligomer hóa và (4) vùng nhận biết carbohydrate đầu cuối gồm 188 acid amin (Hình 1.6) .
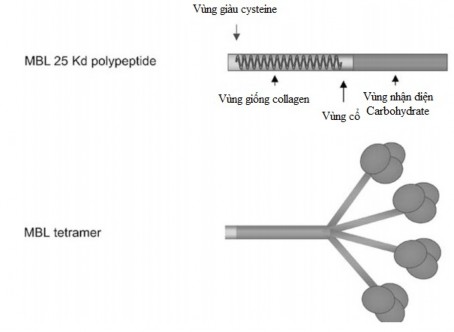
Hình 1.6: Cấu trúc phân tử protein MBL
*Nguồn: theo Garred P. và cs (2006)
Rất nhiều tác giả cho rằng protein MBL trưởng thành bao gồm các
oligomer, mỗi oligomer có ba chuỗi polypeptid giống nhau có kích thước 32 kDa như được đánh giá bằng kỹ thuật SDSPAGE , . Tuy nhiên, trong điều kiện không khử cấu trúc bậc cao, hai dạng MBL chính di chuyển trong gel SDSPAGE tạo các dải có trọng lượng phân tử trên và dưới 250 kDa, trong
khi dải thấp nhất được quan sát có trọng lượng phân tử khoảng 50 kDa
(Hình 1.7). Bên cạnh đó, dựa trên trình tự
acid amin để
tính toán, trọng
lượng phân tử phải vào khoảng 25 kDa. Giả thiết này được khẳng định khi
MBL tái tổ hợp được tinh sạch và đo khối phổ, trọng lượng phân tử MBL của người được tìm thấy vào khoảng 25,3–25,5 kDa , .
của
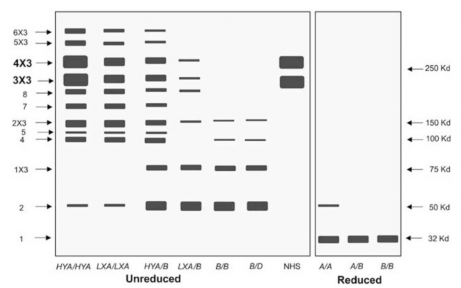
Hình 1.7: Mô hình kết quả phân tách hỗn hợp MBL bằng kỹ thuật SDSPAGE
*Nguồn: theo Garred P. và cs (2006)
Như vậy, MBL có thể bao gồm nhiều xoắn ba của chuỗi polypeptid 25 kDa được xây dựng theo cấu trúc phức tạp của các loại oligomer khác
nhau, trong đó dạng phân tử thấp nhất của MBL được xác định bằng
phương pháp SDSPAGE gồm hai chuỗi polypeptid. Minh chứng quan điểm này là khi MBL tái tổ hợp có ba cysteine nằm ở đầu N được thay thế bằng các đột biến serin chỉ thể hiện một dải trong kỹ thuật SDSPAGE, trong khi việc duy trì một hoặc nhiều cystein tạo thành các dimer polypeptid 50 kDa . Lý do cho sự khác biệt giữa 25 và 32 kDa khi phân tích bằng SDS
PAGE vẫn chưa được làm sáng tỏ. Tuy nhiên, nó có thể
phát sinh từ
hai
đặc điểm của MBL: (i) hàm lượng glycine cao trong MBL so với các protein khác, nghĩa là khi chạy trong gel SDSPAGE, trọng lượng phân tử
sẽ được đánh giá cao trên mức bình thường vì gel SDSPAGE xác định
chiều dài của protein tốt hơn là khối lượng, (ii) các protein giống collagen có thể khó bị biến tính trong gel SDSPAGE do cấu trúc xoắn ba cứng của chúng làm các phân tử SDS liên kết ít hơn trên mỗi acid amin. Trong cả hai
trường hợp, trọng lượng phân tử thực được đánh giá cao hơn bình thường. Một yếu tố khác có thể góp phần là sự bổ sung 1–2 kDa do các biến đổi
sau dịch mã, chẳng hạn như hydroxyl hóa proline thừa.
glycosyl hóa liên kết O của lysine thừa và
Mặc dù MBL huyết thanh là một hỗn hợp phức tạp của các oligomer, hiện nay, người ta chấp nhận rằng thành phần chính của MBL trong huyết thanh bao gồm các trimer và tetramer của ba và bốn vòng xoắn các tiểu đơn
vị MBL chức năng, nhưng các dạng pentamers và hexamers cũng như dạng oligomer thấp hơn cũng có thể được tìm thấy (Hình 1.7) , .
1.4.1.2. Chức năng của MBL
Chức năng gắn với các vi sinh vật
các
Quan sát đầu tiên cho thấy MBL tương tác với vi sinh vật có thể có từ hơn 60 năm trước khi Frank Macfarlane Burnet cùng với John McCrea, đã
xác định được ba chất ức chế trong huyết thanh (được gọi là , , và ) có
thể bất hoạt virus cúm. Bốn mươi năm sau lần quan sát ban đầu đó, chất
ức chế huyết thanh được xác định là MBL .
Hiện nay, MBL được chứng minh là liên kết với nhiều loại vi sinh vật bao gồm vi khuẩn Gram dương và Gram âm, virus, nấm và động vật nguyên sinh. Khả năng gắn của MBL với tất cả những mục tiêu trên bị ức chế bởi mannan và phụ thuộc Ca2+, điều này chỉ ra chúng tương tác thông qua vùng nhận dạng carbonhydrate (CRD). Một ví dụ là khi liên kết với vi khuẩn S. aureus, MBL được lắng đọng trên toàn bề mặt vi sinh vật. Nghiên cứu này cho thấy rằng phối tử của MBL trên S. aureus được phân bố trên khắp bề mặt. Một nghiên cứu khác chỉ ra khả năng liên kết của MBL với
S. aureus không chỉ bị ức chế bởi mannan mà còn đối với thành phần thành tế bào vi khuẩn, acid lipoteichoic (LTA) điều này chỉ ra MBL cũng có thể
có ái lực với acid teichoic, các chuỗi dài của đường được tạo ra bởi ribitol
hoặc glycerol và phosphate và được gắn vào lớp peptidoglycan . Sự gắn
của MBL với bề mặt vi sinh vật làm thay đổi về cấu trúc MBL cho phép MBL thực hiện các chức năng như kích hoạt bổ thể, kích thích thực bào và điều tiết phản ứng viêm. Do đó, không có gì ngạc nhiên khi các vi sinh vật có thể tiến hóa làm giảm chức năng và khả năng gắn kết của MBL để tồn tại. Ví dụ, việc tạo vỏ polysaccharide và sialyl hóa cấu trúc lipopolysaccharide trên bề mặt vi khuẩn có thể làm giảm khả năng gắn của MBL , . Để hiểu sâu hơn về sự tương tác giữa MBL với vi sinh vật ta cần xác định các phối tử của MBL trên bề mặt vi sinh vật. Các nghiên cứu đã chứng minh rằng MBL liên kết với các phân tử bề mặt mầm bệnh bao gồm peptidoglycan và acid lipoteichoic từ S. aureus, lipoarabinomannan từ M. avium, mannan từ C. albicans và lipophosphoglycan từ L. donovanii. Nhiều
phối tử trong số này cũng được nhận biết bởi các thụ thể nhận diện mẫu
(PRR) khác như TLR , , . Do đó, có khả năng các phối tử như vậy được nhận biết đồng thời bởi nhiều thụ thể miễn dịch bẩm sinh từ đó cung cấp nhiều hơn các tín hiệu kích thích hệ thống miễn dịch.
Tương tác với tế bào tự thân bị biến đổi
Một đặc điểm của tế bào chết do quá trình apoptosis là các loại đường ở tận cùng các glycoprotein bề mặt có thể bị thay đổi do đó làm lộ ra các loại đường là phối tử tiềm năng cho MBL. MBL đã được chứng minh là liên kết trực tiếp với các tế bào apoptotic và các tế bào hoại tử tạo điều kiện thuận lợi cho việc loại bỏ các tế bào đang chết này bằng cách thực bào , . Một giả định dựa trên những quan sát này là sự thiếu hụt MBL có
thể
dẫn đến sự
tích tụ
của các tế
bào apoptotic, do đó khiến vật chủ có
khả năng bị bệnh tự miễn dịch hệ thống. Trên thực tế, sự loại bỏ chậm các