cateniannulata CPA14V thu được 7,9g cao chiết tổng dichloromethane (CD) đạt hiệu suất chiết 31,6% sinh khối khô. Cao chiết tổng dichloromethane (CD) được chiết phân lớp với n-hexane. Sau khi đuổi dung môi thu được 3,0g cao chiết n-hexane (CCH) và 4,8g cao chiết dichloromethane (CCD). Hiệu suất chiết phân đoạn CCD đạt hiệu suất 60,8% khối lượng CD tương đương 19,2% lượng sinh khối nấm.
- Kết quả phân lập các chất từ cao chiết dichloromethane (CCD) bằng sắc ký cột
Tiến hành phân lập 4,8g cao chiết dichloromethane (CCD) bằng sắc ký qua cột silica gel. Kết quả thu được 3 phân đoạn chính (CCD1-CCD3). Kiểm tra bằng sắc ký bản mỏng xác định trong đó phân đoạn CCD2 có chứa hoạt chất COD. Đuổi dung môi thu được thu được 1,6g phân đoạn CCD2 có chứa hoạt chất COD, hiệu suất đạt 33,3% khối lượng CCD tương đương 6,4% sinh khối nấm.
Phân tách 1,6g phân đoạn CCD2 trên cột pha đảo RP - 18 với hệ dung môi MeOH:H2O (3:7) thu được 3 phân đoạn nhỏ (CCD2.1-CCD2.3). Kiểm tra bằng sắc ký bản mỏng xác định trong đó phân đoạn CCD2.1 có chứa hoạt chất COD. Đuổi dung môi thu được 0,5g phân đoạn CCD2.1, hiệu suất đạt 31,3% khối lượng CCD2 tương đương 2% sinh khối nấm.
Phân đoạn CCD2.1 (0,5g) được tinh chế lại qua cột sephadex LH20 với dung môi rửa giải MeOH thu được 2 phân đoạn nhỏ (CCD2.1.a-CCD2.1c). Kiểm tra bằng sắc ký bản mỏng xác định trong đó phân đoạn CCD2.1b có chứa hoạt chất COD.
Tiến hành kết tinh phân đoạn CCD2.1b lại trong dung môi acetone thu được hợp chất CC1 (dạng bột, màu trắng, Rf= 0,38 (hệ dung môi CH2Cl2:MeOH = 20:1), khối lượng 93,8mg), độ tinh sạch đạt 98,1% theo HPLC. Hiệu suất đạt 0,375% sinh khối nấm đông khô.
Nấm C. cateniannulata tươi
Có thể bạn quan tâm!
-
 Khả Năng Sinh Tổng Hợp Cyclooligomer Depsipeptide Của Các Chủng Nấm Ký Sinh Côn Trùng Đã Phân Lập
Khả Năng Sinh Tổng Hợp Cyclooligomer Depsipeptide Của Các Chủng Nấm Ký Sinh Côn Trùng Đã Phân Lập -
 Kết Quả Xây Dựng Cây Phát Sinh Loài Dựa Trên Vùng Gen Its1-5.8S Rdna-Its2
Kết Quả Xây Dựng Cây Phát Sinh Loài Dựa Trên Vùng Gen Its1-5.8S Rdna-Its2 -
 Ảnh Hưởng Của Độ Ph Môi Trường Đến Sự Sinh Trưởng Và Khả Năng Sinh Tổng Hợp Cyclooligomer Depsipeptide Của Chủng C. Cateniannulata Cpa14V
Ảnh Hưởng Của Độ Ph Môi Trường Đến Sự Sinh Trưởng Và Khả Năng Sinh Tổng Hợp Cyclooligomer Depsipeptide Của Chủng C. Cateniannulata Cpa14V -
 Dữ Liệu Phổ 1H, 13C-Nmr Của Cc1 Và Tài Liệu Tham Khảo
Dữ Liệu Phổ 1H, 13C-Nmr Của Cc1 Và Tài Liệu Tham Khảo -
 Hoạt Tính Kháng Vi Sinh Vật Kiểm Định In Vitro Của Cao Chiết Và Beauvericin Từ Chủng Nấm C. Cateniannulata Cpa14V
Hoạt Tính Kháng Vi Sinh Vật Kiểm Định In Vitro Của Cao Chiết Và Beauvericin Từ Chủng Nấm C. Cateniannulata Cpa14V -
 Nghiên cứu đa dạng và sinh tổng hợp Cyclooligomer depsipeptide của nấm ký sinh côn trùng tại Khu Bảo tồn thiên nhiên Copia và Vườn quốc gia Xuân Sơn - 19
Nghiên cứu đa dạng và sinh tổng hợp Cyclooligomer depsipeptide của nấm ký sinh côn trùng tại Khu Bảo tồn thiên nhiên Copia và Vườn quốc gia Xuân Sơn - 19
Xem toàn bộ 228 trang tài liệu này.
Rửa, đông khô
Nấm C. cateniannulata khô
1. Ngâm chiết bằng CH2Cl2 (2 lít x 3)
2. Cất loại dung môi dưới áp suất thấp
Cao chiết dichloromethane
1. Bổ sung nước (0,05 lít)
2. Chiết lần lượt với n-hexan (0,3 lít x 3),
3. Cất loại dung môi dưới áp suất thấp
Cao chiết n-hexane
Cao chiết dichloromethane
Silica gel Gradient CH2Cl2:MeOH (99:1→20:1) Kiêm tra các phân đoạn bằng sắc ký mỏng
Phân đoạn chứa COD sau sắc ký cột silica gel
RP-18, MeOH−H2O (3:7)
Kiêm tra các phân đoạn bằng sắc ký mỏng
Phân đoạn chứa COD sau phân tách cột pha đảo RP-18
Sephadex LH20, MeOH Kiêm tra các phân đoạn
Phân đoạn chứa COD sau tinh chế qua cột sephadex
Kết tinh acetone
Chất sạch COD
Hình 3.35. Quy trình thu nhận COD (CC1) quy mô phòng thí nghiệm
Từ kết quả trên, chúng tôi đề xuất quy trình thu nhận COD từ sinh khối nấm ở quy mô phòng thí nghiệm, quy trình được mô tả ở hình 3.35.
3.5.1.2. Một số yếu tố ảnh hưởng đến thu nhận cyclooligomer depsipeptide
- Ảnh hưởng của dung môi đến hàm lượng COD (CC1)
Khảo sát ảnh hưởng của dung môi chiết đến quá trình chiết tách COD (CC1) từ cao chiết tổng. Kết quả trình bày ở hình 3.36 cho thấy sự khác biệt khi thay đổi các loại dung môi chiết. Sử dụng dung môi dichloromethane (D) hàm lượng CC1 thu được là 0,376 % và giảm đáng kể khi chiết bằng các loại dung môi: ethyl acetate (E), ethanol (M) và n-hexane (H).
Kết quả trên cũng chỉ ra rằng sử dụng dichloromethane thì hàm lượng CC1 thu được đạt hiệu suất cao nhất. Vì thế, chúng tôi lựa chọn dichloromethane cho các quá trình nghiên cứu tiếp theo trong quy trình công nghệ tách chiết hoạt chất CC1 bằng phương pháp dung môi hữu cơ.
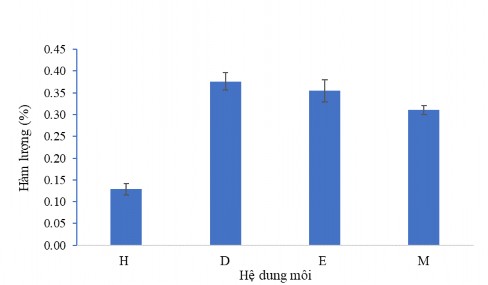
Hình 3.36. Ảnh hưởng của dung môi chiết đến hàm lượng CC1
- Ảnh hưởng của nhiệt độ chiết xuất tới hàm lượng COD (CC1)
Khảo sát ảnh hưởng của nhiệt độ đến quá trình chiết xuất CC1 đã thu được kết quả như hình 3.37. Kết quả này cho thấy ở nhiệt độ cao, thu được hàm lượng hoạt chất CC1 cao. Khi càng tăng nhiệt độ thì hàm lượng hoạt chất CC1 tăng dần. Để thuận tiện các thí nghiệm tiếp theo nhiệt độ chiết mẫu ở khoảng 50oC.
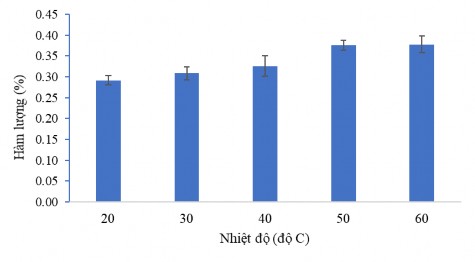
Hình 3.37. Ảnh hưởng của nhiệt độ đến hàm lượng CC1
- Ảnh hưởng của thời gian tách chiết tới hàm lượng COD (CC1)
Các kết quả thu nhận hàm lượng hoạt chất CC1 ở các khoảng thời gian khác nhau cũng có sự biến đổi khác nhau. Quá trình xử lý mẫu và tách chiết mẫu càng lâu thì hàm lượng các hoạt chất có được càng nhiều, tuy nhiên khoảng thời gian này là có giới hạn, sau khoảng thời gian đó hàm lượng các chất thu được cũng không thay đổi. Hình 3.38 dưới đây thể hiện rõ sự biến đổi này. Từ các kết quả đó, chúng tôi lựa chọn thời gian chiết siêu âm là 2 giờ cho quy trình công nghệ tách chiết hoạt chất CC1.
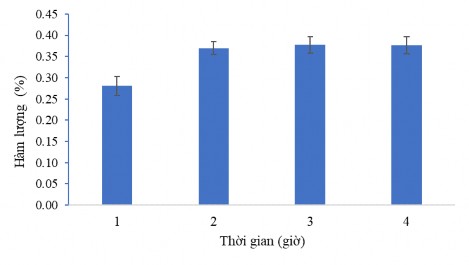
Hình 3.38. Ảnh hưởng của thời gian siêu âm đến hàm lượng CC1
Nghiên cứu tách chiết và tinh sạch COD từ chủng C. cateniannulata CPA14V cho thấy trình tự sử dụng dung môi chiết phù hợp là dichloromethane, nước, n-hexane và kết hợp với hệ thống sắc kí bản mỏng, sắc kí cột thường với silicagel, sắc ký pha đảo với YMC RP 18 và sắc ký ray phân tử với pha tĩnh là sephadex LH-20 và kết tinh bằng axeton cho hiệu suất (0,37% CDW) và tinh sạch beauvericin cao (98,1%). Hiệu suất chiết và tinh sạch tốt nhất ở điều kiện siêu âm sinh khối với dichloromethane trong 2 giờ, ở nhiệt độ 50oC. Kết quả nghiên cứu thu được về khả năng sinh tổng hợp, thu hồi, tinh sạch và hoạt tính
của hợp chất COD từ chủng nấm C. cateniannulata CPA14V cho thấy tiềm năng nghiên cứu và ứng dụng của hợp chất này ở Việt Nam.
3.5.2. Xác định cấu trúc hóa học của cyclooligomer depsipeptide
3.5.2.1. Các kết quả đo phổ Phổ LC/MS Q-TOF
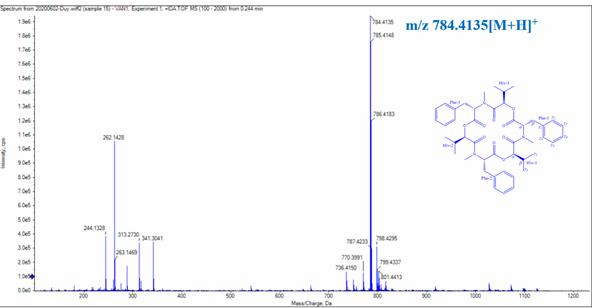
Hình 3.39. Phổ LC/MS Q-TOF của CC1
Hợp chất CC1 thu được dưới dạng bột, màu trắng. Phổ LC/MS Q-TOF cho m/z 784.4135 [M + H]+ tương ứng với công thức phân tử C45H57N3O9 (Hình 3.40)
Phổ 1H-NMR
Phổ 1H-NMR cho biết trong phân tử của CC1 có 3 metyl tại 𝛿H 0,88 (3H, d, J= 6,5 Hz, Hγ1-Hiv), 0,29 (3H, d, J= 7,0 Hz, Hγ2-Hiv) và 3,16 (3H, s,
N-CH3); 1 nhóm metylen tại 𝛿H 3,40 (1H, dd, J= 4,5 và 14,5 Hz, Hβ1-Phe) và 3,05 (1H, m, Hβ2-Phe); 3 nhóm metin tại 𝛿H 1,84 (1H, m, Hβ-Hiv), 4,88 (1H, d, J= 9,0 Hz, Hα-Hiv), và 5,83 (1H, dd, J= 4,5 và 12,5 Hz, Hα-Phe); và proton vòng benzene tại 𝛿H 7,19-7,27 (5H, m, Hγ2,3,4,5,6 -Phe) (Hình 3.40)
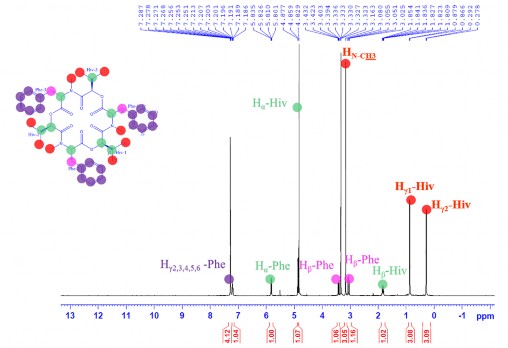
Hình 3.40. Phổ 1H-NMR của CC1
Phổ 13C-NMR, phổ DEPT và phổ HSQC
Phổ 13C-NMR kết hợp với phổ DEPT và HSQC của CC1 xuất hiện tín hiệu của 15 cacbon, gồm 2 nhóm cacbonyl tại 𝛿C 173,0 (CO-Phe) và 170,9 (CO-Hiv); 3 nhóm metin tại 𝛿C 31,2 (Cβ-Hiv), 57,8 (Cα-Phe) và 77,2 (Cα-Hiv); 1 nhóm metylen tại 𝛿C 35,5 (Cβ-Phe), 3 nhóm metyl tại 𝛿C 17,2 (Cγ1-Hiv), 18,3 (Cγ2-Hiv) và 32,2 (N-CH3) và các cacbon vòng benzene tại 𝛿C 127,9- 129,8 (Cγ2,3,4,5,6 -Phe) (Hình 3.41). Phân tích dữ liệu phổ NMR kết hợp với phổ khối lượng cho biết hợp chất CC1 gồm ba nhóm chất giống nhau với mỗi nhóm có 15 nguyên tử cacbon.
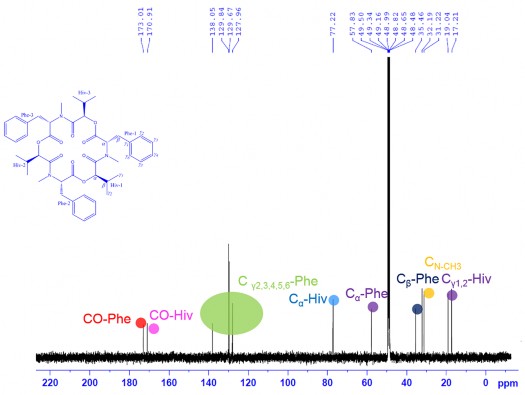
Phổ 13C-NMR của CC1
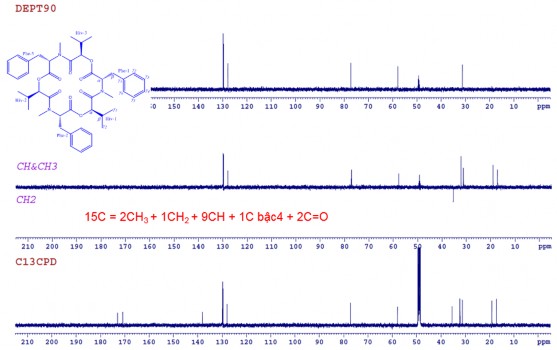
Phổ DEPT của CC1
Phổ HSQC của CC1
Hình 3.41. Phổ 13C-NMR, phổ DEPT, phổ HSQC của CC1
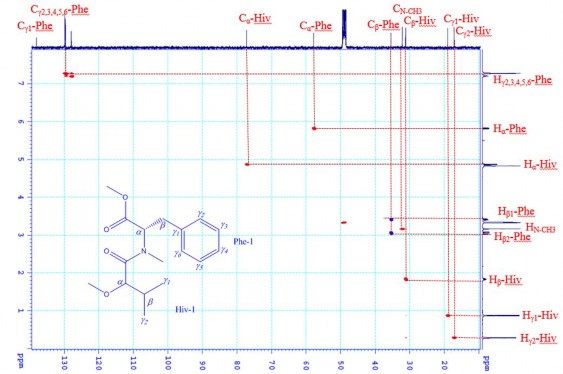
Phổ COSY, phổ NOESY và phổ HMBC
Tương tác 1H-1H COSY và 13C-1H HMBC của CC1 được thể hiện trong hình 3.42, hình 3.43. Trên phổ 1H-1H COSY của CC1 quan sát được tương tác của Hβ-Hiv với Hγ1-Hiv, Hγ2-Hiv và Hα-Hiv và của các proton vòng benzene Hγ2,3,4,5,6-Phe. Trên phổ HMBC của CC1 cho biết tương tác của Hβ- Hiv (δH 1,84), Hγ1-Hiv (δH 0,88), Hγ2-Hiv (δH 0,29), Hα-Hiv (δH 4,88) với Cβ-
Hiv (δC 31,2), Cγ1-Hiv (δC 17,2), Cγ2-Hiv (δC 18,3) và Cα-Hiv (δC 77,2) tương ứng; tương tác của Hα-Phe (δH 5,83) với CO-Phe (δC 170,9), N-CH3-Phe (δC 32,2) và Cβ-Phe (δC 35,5); tương tác của Hβ-Phe (δH 3,05 và 3,40) với CO-Phe (δC 170,9), Cα-Phe (δC 57,8), Cγ1-Phe (δC 138,1), Cγ2-Phe (δC 129,8) và Cγ6-
Phe (δC 129,8).






