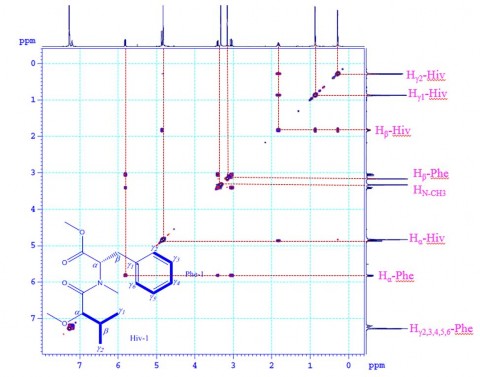
Phổ COSY của CC1

Phổ NOESY của CC1

Phổ HMBC của CC1
Hình 3.42. Phổ COSY, phổ NOESY và phổ HMBC của CC1
3.5.2.2. Cấu trúc hóa học của cyclooligomer depsipeptide
Các phân tích NMR (1H, 13C, DEPT135, COZY, NOESY, HMQC và
HMBC; trong MeOD) kết hợp với dữ liệu phổ trong tài liệu tham khảo [26],
[215] cho biết hợp chất CC1 gồm ba nhóm N-MePhe và ba nhóm Hiv, có tên gọi là (3S,6R,9S,12R,15S,18R)-3,9,15-tribenzyl-4,10,16-trimethyl -6,12,18- tri(propan-2-yl)-1,7,13-trioxa-4,10,16-triazacyclooctadecane-2,5,8,11,14,17- hexone hay còn gọi là beauvericin. Đây là một hợp chất COD, một chất chuyển hóa sinh học mới có nguồn gốc từ loại nấm, thể hiện hoạt tính kháng ung thư rất mạnh, hoạt tính gây độc tế bào, kháng kết tập tiểu cầu và kháng khuẩn [163].
Vị trí | Hợp chất CC1 | Beauvericin [26] | ||
δC | δH (mult., J Hz) | #δC | #δH (mult., J Hz) | |
Phe (3 đơn vị): | ||||
CO | 173,0 | - | 172,3 | - |
Α | 57,8 | 5,83 (1H, dd, J= 12,5; 4,5) | 56,5 | 5,82 (1H, dd, J= 12,7; 4,5) |
Β | 35,5 | 3,40 (1H, dd, J= 14,5, 4,5) 3,05 (1H, m) | 34,7 | 3,42 (1H, dd, J= 14,8; 4,5) 3,06 (1H, dd, J= 14,8; 12,7) |
γ1 | 138,1 | - | 136,9 | - |
γ2 | 129,8 | 7.25-7.28 (1H, m) | 128,3 | 7,26-7,30 (1H, m) |
γ3 | 129,7 | 7.25-7.28 (1H, m) | 128,3 | 7,26-7,30 (1H, m) |
γ4 | 127,9 | 7.19 (1H, m) | 126,2 | 7,20 (1H, tt, J= 6.0, 3.1) |
γ5 | 129,7 | 7.25-7.28 (1H, m) | 128,3 | 7,26-7,30 (1H, m) |
γ6 | 129,8 | 7.25-7.28 (1H, m) | 128,3 | 7,26-7,30 (1H, m) |
N- CH3 | 32,2 | 3,16 (1H, s) | 31,2 | 3,17 (1H, s) |
Hiv (3 đơn vị): | ||||
CO | 170,9 | - | 169,5 | - |
Α | 77,2 | 4,88 (1H, d, J = 9,0) | 75,5 | 4,86 (1H, s) |
Β | 31,2 | 1,84 (1H, m) | 29,8 | 1,83 (1H, dq, J= 8,8; 6,7) |
γ1 | 17,2 | 0,88 (3H, d, J = 6,5 Hz) | 17,8 | 0,87 (3H, d, J = 6,6) |
γ2 | 18,3 | 0,29 (3H, d, J = 7,0 Hz) | 16,1 | 0,27 (3H, d, J = 6,9) |
Có thể bạn quan tâm!
-
 Kết Quả Xây Dựng Cây Phát Sinh Loài Dựa Trên Vùng Gen Its1-5.8S Rdna-Its2
Kết Quả Xây Dựng Cây Phát Sinh Loài Dựa Trên Vùng Gen Its1-5.8S Rdna-Its2 -
 Ảnh Hưởng Của Độ Ph Môi Trường Đến Sự Sinh Trưởng Và Khả Năng Sinh Tổng Hợp Cyclooligomer Depsipeptide Của Chủng C. Cateniannulata Cpa14V
Ảnh Hưởng Của Độ Ph Môi Trường Đến Sự Sinh Trưởng Và Khả Năng Sinh Tổng Hợp Cyclooligomer Depsipeptide Của Chủng C. Cateniannulata Cpa14V -
 Một Số Yếu Tố Ảnh Hưởng Đến Thu Nhận Cyclooligomer Depsipeptide
Một Số Yếu Tố Ảnh Hưởng Đến Thu Nhận Cyclooligomer Depsipeptide -
 Hoạt Tính Kháng Vi Sinh Vật Kiểm Định In Vitro Của Cao Chiết Và Beauvericin Từ Chủng Nấm C. Cateniannulata Cpa14V
Hoạt Tính Kháng Vi Sinh Vật Kiểm Định In Vitro Của Cao Chiết Và Beauvericin Từ Chủng Nấm C. Cateniannulata Cpa14V -
 Nghiên cứu đa dạng và sinh tổng hợp Cyclooligomer depsipeptide của nấm ký sinh côn trùng tại Khu Bảo tồn thiên nhiên Copia và Vườn quốc gia Xuân Sơn - 19
Nghiên cứu đa dạng và sinh tổng hợp Cyclooligomer depsipeptide của nấm ký sinh côn trùng tại Khu Bảo tồn thiên nhiên Copia và Vườn quốc gia Xuân Sơn - 19 -
 Nghiên cứu đa dạng và sinh tổng hợp Cyclooligomer depsipeptide của nấm ký sinh côn trùng tại Khu Bảo tồn thiên nhiên Copia và Vườn quốc gia Xuân Sơn - 20
Nghiên cứu đa dạng và sinh tổng hợp Cyclooligomer depsipeptide của nấm ký sinh côn trùng tại Khu Bảo tồn thiên nhiên Copia và Vườn quốc gia Xuân Sơn - 20
Xem toàn bộ 228 trang tài liệu này.
Bảng 3.3. Dữ liệu phổ 1H, 13C-NMR của CC1 và tài liệu tham khảo
#δH và #δC của beauvericin (1H: 300 MHz, 13C: 75 MHz, methanol-d4) [26]
![]()
Hình 3.43. Cấu trúc hóa học, tương tác 1H-1H COSY và HMBC (HC) chính của CC1
Như đã trình bày ở mục 1.1.2. beauvericin là một COD thuộc cyclohexadepsipeptide được phân lập đầu tiên từ loài Beauveria bassiana. Đây là loài phổ biến và được sử dụng làm thuốc trừ sâu mycoinsecticide. Ngoài ra, beauvericin có thể được sinh tổng hợp bởi một số loài thuộc chi nấm như Beauveria, Cordyceps, Paecilomyces, Polyporus, Isaria và Fusarium [79, 134, 171]. Ở chi Cordyceps, beauvericin được ghi nhận tìm thấy ở các loài C. cicadae, C. militaris, C. takaomontana [34, 103, 139, 193]. Đây là nghiên cứu đầu tiên ghi nhận về khả năng sinh beauvericin của nấm C. catenianulata.
Như vậy, sử dụng dung môi chiết dichloromethane, trong điều kiện nhiệt độ 40-50oC siêu âm trong 2h và quy trình tách chiết đã đề xuất ở trên để tách chiết và thu hồi COD từ sinh khối chủng nấm C. cateniannulata CPA14V, chúng tôi thu được COD sạch 98,1% với hiệu suất thu hồi đạt 0,37% lượng sinh khối khô. COD thu được từ chủng C. cateniannulata CPA14V có ba nhóm N-MePhe và ba nhóm Hiv, có tên gọi là beauvericin.
3.6. Nghiên cứu khảo sát một số hoạt tính sinh học của các cao chiết tổng, phân đoạn và chất sạch beauvericin của chủng nấm C. cateniannulata CPA14V
Từ lâu nhờ sự đa dạng, phong phú và phổ hoạt tính sinh học rộng mà các hoạt chất chuyển hóa thứ cấp nói chung và các COD nói riêng từ các loài thuộc chi nấm Cordyceps đã thu hút được sự quan tâm của nhiều nhà khoa học trên thế giới. Nhiều các hoạt chất như cordycepin, adenosine,.. từ các loài như C. militaris, C. kyushuensis hay C. nutans đã và đang được ứng dụng sử dụng rộng rãi trong nhiều lĩnh vực [34, 40]. Mặc dù đã được phân lập và mô tả trong các nghiên cứu của các tác giả Liang và cs (2005) hay Kepler và cs (2017) nhưng cho đến không có nhiều nghiên cứu về nấm C. cateniannulata, đặc biệt là về hoạt tính của chúng. Hiện C. cateniannulata mới được ghi nhận về khả năng diệt côn trùngSpodoptera frugiperda [219]. Chính vì vậy nhằm bổ sung những hiểu biết về hoạt tính sinh học của các hoạt chất từ nấm C. cateniannulata, chúng tôi tiến hành đánh giá hoạt tính gây độc tế bào, hoạt tính chống oxy hóa, hoạt tính kháng vi sinh vật kiểm định của các mẫu cao chiết ethanol tổng (CCM), n-hexane (CCH), dichloromethane (CCD), ethyl acetate (CCE), nước (CCN) và chất sạch beauvericin (CC1) từ chủng nấm C. cateniannulata CPA14V.
3.6.1. Đánh giá hoạt tính gây độc tế bào in vitro
Hoạt tính gây độc tế bào in vitro của cao chiết ethanol tổng (CCM), n- hexane (CCH), dichloromethane (CCD), ethyl acetate (CCE), nước (CCN) và chất sạch beauvericin (CC1) từ nấm C. cateniannulata được thử nghiệm trên các dòng tế bào ung thư gan (Hep-G2), ung thư tuyến tiền liệt (PC-3) và tế bào thường (Vero) theo phương pháp MTT. Kết quả thể hiện trong bảng 3.3.
Kết quả cho thấy, tất cả các mẫu đều không gây độc đối với dòng tế bào thường (Vero) ở nồng độ thử nghiệm. Ngoại trừ cao chiết nước (CCN) không thể hiện hoạt tính, hầu hết các mẫu biểu hiện hoạt tính gây độc đối với các dòng tế bào ung thư HepG2 và PC3 ở các mức độ khác nhau, trong đó,
phân đoạn dichloromethane (CCD) và chất sạch beauvericin (CC1) thể hiện hoạt tính tốt nhất với giá trị IC50 trong khoảng 19,17 đến 45,29 µg/mL.
Đối với dòng tế bào ung thư HepG2 và PC3: cao chiết ethanol tổng
(CCM) thể hiện hoạt tính ức chế trung bình với giá trị IC50= 60,12 µg/mL (đối với dòng tế bào ung thư gan HepG2) và 80,97 µg/mL (đối với dòng tế bào ung thư tiền liệt tuyến PC3). Các phân đoạn n-hexane (CCH), dichloromethane (CCD), ethyl acetate (CCE) thể hiện hoạt tính từ trung bình đến khá đối với dòng tế bào ung thư HepG2 và PC3 với giá trị IC50trong khoảng 22,90 đến 95,64 µg/mL (ngoại trừ cao chiết CCE không thể hiện hoạt tính với dòng tế bào Hep-G2), phân đoạn nước (CCN) không thể hiện hoạt tính với các dòng tế bào được thử nghiệm. Cao chiết dichloromethane (CCD) thể hiện hoạt tính tốt nhất với giá trị IC50= 22,90 µg/mL (đối với dòng tế bào ung thư gan HepG2) và 45,29
µg/mL (đối với dòng tế bào ung thư tiền liệt tuyến PC3). Chất sạch beauvericin (CC1) thể hiện hoạt tính mạnh với giá trị IC50= 19,17
µg/mL (đối với dòng tế bào ung thư gan HepG2) và 23,52 µg/mL (đối
với dòng tế bào ung thư tiền liệt tuyến PC3). Kết quả đối với dòng tế bào ung thư gan HepG2 được so sánh với kết quả về khả năng gây độc tế bào của COD trong các nghiên cứu của Juan-García và cộng sự
[82] và Ivanova và cs [76] (IC50dao động từ 0-25 µM). Hiện có rất ít nghiên cứu về khả năng gây độc của COD nói chung và beauvericin nói riêng đối với dòng tế bào ung thư tiền liệt tuyến PC3. Kết quả này bổ sung thêm về khả năng kháng các dòng tế bào ung thư của các COD nói chung và beauvericin từ nấm nói riêng.
Bảng 3.4. Hoạt tính gây độc tế bào in vitro của cao chiết và beauvericin từ chủng nấm C. cateniannulata CPA14V
Ký hiệu mẫu | Tế bào HepG2 | Tế bào PC3 | Tế bào Vero | ||||
Tỷ lệ ức chế tế bào (%) | IC50 (µg/mL) | Tỷ lệ ức chế tế bào (%) | IC50 (µg/mL) | Tỷ lệ ức chế tế bào (%) | IC50 (µg/mL) | ||
1 | CCM | 80,55 ± 3,1 | 60,12 | 88,61 ± 0,6 | 80,97 | 22,86 ± 0,1 | >100 |
2 | CCH | 53,17 ± 2,0 | 95,64 | 78,33 ± 1,8 | 69,37 | 31,31 ± 1,5 | >100 |
3 | CCD | 96,56 ± 0,9 | 22,90 | 90,33 ± 1,5 | 45,29 | 26,25 ± 1,3 | >100 |
4 | CCE | 56,49 ± 1,9 | 93,48 | 46,64 ± 2,1 | >100 | 35,43 ± 2,0 | >100 |
5 | CCN | 42,25 ± 2,4 | >100 | 44,36 ± 2,3 | >100 | 40,75 ± 2,2 | >100 |
6 | CC1 | 97,02 ± 1,8 | 19,17 | 95,16 ± 0,8 | 23,52 | 46,53 ± 1,8 | >100 |
Paclitaxel 50nM | 54,2 ± 1,8 | 47,2 nM | 64,09 ± 2,4 | 40,74 nM | 39,16 ± 2,6 | >100 Nm | |
Đối với dòng tế bào thường Vero: các mẫu thử nghiệm cho tỷ lệ ức chế tế bào từ 22,86 đến 46,53% và giá trị IC50> 100µg/mL, biểu hiện gây độc trên dòng tế bào ung thư gan và tiền liệt tuyến, không gây độc trên các dòng tế bào thường vero ở nồng độ thử nghiệm.
3.6.2. Đánh giá hoạt tính chống oxi hóa
Hoạt tính chống oxy hóa bằng phương pháp DPPH của cao chiết ethanol tổng (CCM), n-hexane (CCH), dichloromethane (CCD), ethyl acetate (CCE), nước (CCN) và chất sạch beauvericin (CC1) từ nấm C. cateniannulata được thử nghiệm. Kết quả thể hiện trong bảng 3.4. Kết quả cho thấy, cao chiết ethanol tổng (CCM) và dichloromethane (CCD) thể hiện hoạt tính chống oxi hóa trung hòa gốc tự do trung bình với giá trị SC50 lần lượt là 102,95 và 86,87 μg/mL, các mẫu còn lại không thể hiện hoạt tính ở nồng độ thử nghiệm.
Bảng 3.5. Hoạt tính chống oxi hóa in vitro của cao chiết và beauvericin từ chủng nấm C. cateniannulata CPA14V
Ký hiệu mẫu | Khả năng trung hòa gốc tự do (SC, %) | SC50 (μg/mL) | |
Chứng (+) [axit ascorbic] | 86,53 ± 0,3 | 12,6 μg/mL | |
Chứng (-) [DPPH/EtOH+ DMSO] | 0,0 ± 0,0 | - | |
1 | CCM | 72,68 ± 2,8 | 102,95 |
2 | CCH | 1,54 ± 0,1 | >200 |
3 | CCD | 79,07 ± 2,6 | 86,87 |
4 | CCE | 2,88 ± 1,5 | >200 |
5 | CCN | 19,26 ± 1,8 | >200 |
6 | CC1 | 1,23 ± 0,6 | >200 |
CCM là dịch chiết thô (dịch chiết ethanol) sau đó được tinh chế bằng các dung môi khác, cho thấy hoạt tính chống oxy hóa tương đối mạnh với SC 72,68 ± 2,8% và SC50 102,95 μg/mL. Tuy nhiên, trong số 5 cao chiết, chỉ có CCD cho thấy hoạt tính chống oxy hóa cao hơn một chút (SC 79,07 ± 2,6% và SC50 86,87 μg/mL) so với CCM, có thể do sự gia tăng nồng độ các hoạt chất chống oxi hóa có trong cao chiết dichloromethane (CCD). 4 cao chiết còn lại không thể hiện hoạt tính hoặc hoạt tính chống oxy hóa yếu (SC nhỏ hơn 20% và SC50 lớn hơn 200 μg/mL). Một điều đáng chú ý ở đây là, mặc dù cao chiết CC1 chiếm hơn 50% trọng lượng của CCD nhưng hoạt tính chống oxy hóa yếu giảm hẳn so với CCD. Trong khi đó các COD như beauvericin, enniatins... là các độc tố nấm và thường có đặc tính oxy hóa. Vì vậy, có thể cao chiết thô hoặc sự tương tác của các hợp chất trong cao chiết của các sinh vật có các đặc tính khác với các hợp chất tinh khiết riêng lẻ [51, 108].
3.6.3. Đánh giá hoạt tính kháng vi sinh vật ki m định
Hoạt tính kháng vi sinh vật kiểm định của cao chiết ethanol tổng (CCM), n-hexane (CCH), dichloromethane (CCD), ethyl acetate (CCE),






