
Hình 3.28. Kết quả xây dựng cây phát sinh loài dựa trên vùng gen ITS1-5.8S rDNA-ITS2
Khi so sánh trên ngân hàng gen NCBI, khi nghiên cứu trình tự vùng ITS chủng CPA14V có tỷ lệ tương đồng với chủng nấm C. cateniannulata TBRC 7258 trình tự gen MF140753.1 là 100%, với chủng nấm C. cateniannulata NTUCC 18-108 trình tự gen MT966056.1 là 99,28%. Cây phát sinh chủng loại dựa trên vùng gen ITS1-5.8S rDNA-ITS2 cho thấy chủng nấm CPA14V có mối quan hệ gần gũi với chủng nấm C. cateniannulata TBRC 7258 với chỉ số NJ là 81% (Hình 3.28).
Cây phát sinh chủng loại khi nghiên cứu vùng gen LSU cho thấy chủng CPA14V được xếp vào cùng một nhóm với các loài C. cateniannulata với chỉ số NJ là 99% (Hình 3.29). Tương tự khi so sánh trên ngân hàng gen NCBI, trình tự vùng LSU của chủng CPA14V có tỷ lệ tương đồng với các chủng nấm C. cateniannulata NTUCC 18-111 trình tự gen MT974310.1, NTUCC 18-110 trình tự gen MT974275.1, NTUCC 18-109
trình tự gen MT974273.1, NTUCC 18-108 trình tự gen MT974270.1, CBS
152.83 trình tự gen NG 067333.1, TBRC 7258 trình tự gen MF140753.1 đạt từ 99,65-100%. Đối với vùng gen mục tiêu Rpb1, chủng CPA14V có tỷ lệ tương đồng với chủng nấm C. cateniannulata TBRC 7258 trình tự gen MF140767.1 là 99,47%.
Ở nấm, vùng ITS trung bình dài khoảng 527 - 700 bp, là các vùng tiến hóa nhanh nên có thể thay đổi về trình tự cũng như độ dài. Các vùng bên cạnh ITS lại rất bảo thủ. Do đó, ITS được sử dụng rộng rãi trong phân loại nấm cũng như để đánh giá phát sinh loài ở cấp độ loài [41]. Tuy nhiên, đối với nhiều nhóm nấm, các trình tự bổ sung là cần thiết để có thể định loại một cách chính xác, và một số trình tự LUS, Rpb1, Rpb2, EF, Actin,… thường được sử dụng. Khi kết hợp sử dụng ITS với các DNA barcoding khác như Rpb1, LSU thì xác suất nhận dạng chính xác (chỉ số PCI) đến loài tăng lên 0,78. Khi kết hợp 3, 4 DNA barcoding thì chỉ số PCI tăng dần [105, 152]. Do đó, nghiên cứu trình tự và xây dựng cây phát sinh chủng loại dựa trên vùng gen ITS, LSU, Rpb1 và kết hợp ba vùng gen là vô cùng cần thiết, tăng độ chính xác trong định loại nấm nói chung và nấm ký sinh côn trùng nói riêng. Chính vì vậy chúng tôi tiến hành xây dựng cây phát sinh chủng loại dựa trên kết hợp của cả 3 vùng gen ITS, LSU và Rpb1. Kết quả cho thấy chủng nấm CPA14V được xếp cùng một nhóm với C. cateniannulata TBRC 7258 với chỉ số NJ là 100% (Hình 3.30).
Có thể bạn quan tâm!
-
 Nghiên cứu đa dạng và sinh tổng hợp Cyclooligomer depsipeptide của nấm ký sinh côn trùng tại Khu Bảo tồn thiên nhiên Copia và Vườn quốc gia Xuân Sơn - 11
Nghiên cứu đa dạng và sinh tổng hợp Cyclooligomer depsipeptide của nấm ký sinh côn trùng tại Khu Bảo tồn thiên nhiên Copia và Vườn quốc gia Xuân Sơn - 11 -
 Định Loại Phân Tử Các Chủng Nấm Ký Sinh Côn Trùng Đ Phân Lập Ở Khu Vực Nghiên Cứu
Định Loại Phân Tử Các Chủng Nấm Ký Sinh Côn Trùng Đ Phân Lập Ở Khu Vực Nghiên Cứu -
 Khả Năng Sinh Tổng Hợp Cyclooligomer Depsipeptide Của Các Chủng Nấm Ký Sinh Côn Trùng Đã Phân Lập
Khả Năng Sinh Tổng Hợp Cyclooligomer Depsipeptide Của Các Chủng Nấm Ký Sinh Côn Trùng Đã Phân Lập -
 Ảnh Hưởng Của Độ Ph Môi Trường Đến Sự Sinh Trưởng Và Khả Năng Sinh Tổng Hợp Cyclooligomer Depsipeptide Của Chủng C. Cateniannulata Cpa14V
Ảnh Hưởng Của Độ Ph Môi Trường Đến Sự Sinh Trưởng Và Khả Năng Sinh Tổng Hợp Cyclooligomer Depsipeptide Của Chủng C. Cateniannulata Cpa14V -
 Một Số Yếu Tố Ảnh Hưởng Đến Thu Nhận Cyclooligomer Depsipeptide
Một Số Yếu Tố Ảnh Hưởng Đến Thu Nhận Cyclooligomer Depsipeptide -
 Dữ Liệu Phổ 1H, 13C-Nmr Của Cc1 Và Tài Liệu Tham Khảo
Dữ Liệu Phổ 1H, 13C-Nmr Của Cc1 Và Tài Liệu Tham Khảo
Xem toàn bộ 228 trang tài liệu này.
Có thể thấy, đoạn ITS khi so sánh trên NCBI chỉ có trên 90% độ bao phủ (query cover) vì vậy mặc dù tỷ lệ tương đồng của chủng nấm CPA14V so với chủng nấm C. cateniannulata TBRC 7258 và chủng nấm C. cateniannulata NTUCC 18-108 tương đối cao nhưng khi xây dựng cây phân loại để so sánh thì tỷ lệ tương đồng sẽ giảm do sự chênh lệch chiều dài giữa các đoạn gen. Đối với trình tự gen LSU, do trình tự khi so sánh đủ dài nên mức độ tương đồng trên cây phân loại sẽ lớn >99%. Nghiên cứu vùng gen LSU rất có ý nghĩa trọng việc xác định chính xác mức độ phân loại trên loài [152]. Từ kết quả nghiên cứu trên, chúng tôi đưa ra kết luận chủng nấm CPA14V thuộc họ Cordycipitaceae. Ngoài ra, khi so sánh trên cây phát sinh chủng loại dựa trên sự kết hợp của cả 3 vùng gen ITS, LSU và Rpb1, chủng CPA14V nằm cùng nhóm với loài C. cateniannulata với chỉ số NJ đạt tuyệt đối 100%. Qua phân tích cây phát sinh chủng loại khi sử dụng đơn lẻ từng vùng gen mục tiêu ITS, LSU, Rpb1 và kết hợp cả ba vùng gen trên khẳng định chủng nấm CPA14V nghiên cứu thuộc loài Cordyceps cateniannulata, chi Cordyceps, họ Cordycipitaceae.

Hình 3.29. Kết quả xây dựng cây phát sinh loài dựa trên vùng gen LSU
Kết hợp với phân tích đặc điểm hình thái nhận thấy các đặc điểm hình thái của chủng CPA14V tương tự với đặc điểm hình thái của chủng C. cateniannulata được ghi nhận trong các nghiên cứu trước đó của Shimazu [154], Liang [94], Kepler [85]. Như vậy, thông qua phân tích cây phát sinh chủng loại và đặc điểm hình thái có thể kết luận chủng CPA14V là loài
Cordyceps cateniannulata CPA14V. Đây là loài mới được ghi nhận phân lập ở Việt Nam.

Hình 3.30. Kết quả xây dựng cây phát sinh loài dựa trên 3 vùng gen ITS1- 5.8S rDNA-ITS2, LSU và Rpb1
Khi nghiên cứu về chi nấm Cordyceps, ở cả các loài tự nhiên và nhân tạo người ta đã phát hiện được rất nhiều chất chuyển hóa thứ cấp đáng chú ý như là nucleosides, sterols flavonoids, cyclic peptides, phenolic,
bioxanthracenes, polyketides và alkaloids [130]. Nhưng theo Kuo và cs rất hiếm khi COD được tìm thấy trong chi Cordyceps [90]. Tuy nhiên, trong một số nghiên cứu gần đây ghi nhận COD được tìm thấy ở một số loài thuộc chi Cordyceps như C. cicadae [193], C. militaris [139], C. takaomontana [103]. Trong quá trình tìm kiếm các loại thuốc chống lại tế bào ung thư, ba hợp chất COD mới là cardinalisamides A, B, C đã được phân lập từ việc nuôi cấy chủng nấm ký sinh côn trùng C. cardinalis NBRC 103832 [180]. Đặc biệt, chưa có công trình nào trước đây trên thế giới và Việt Nam công bố về khả năng sinh tổng hợp COD của loài C. cateniannulata.
Như vậy, dựa trên nghiên cứu một số đặc điểm hình thái và định loại chủng nấm CPA14V đã tuyển chọn bằng phương pháp sinh học phân tử xác định được chủng nấm CPA14V loài Cordyceps cateniannulata, chi Cordyceps, họ Cordycipitaceae. Đây là lần đầu tiên ghi nhận sự có mặt của loài Cordyceps cateniannulata tại Việt Nam.
3.4. Nghiên cứu môi trường và điều kiện nuôi cấy sinh tổng hợp cyclooligomer depsipeptide của chủng nấm C. cateniannulata CPA14V
3.4.1. Lựa chọn môi trường lên men sinh tổng hợp cyclooligomer depsipeptide
Hiện tại trên thế giới cũng như ở Việt Nam có rất ít các nghiên cứu về lựa chọn môi trường lên men sinh tổng hợp COD của nấm ký sinh côn trùng. Trong các nghiên cứu hiện có, hầu như các tác giả đều sử dụng môi trường dịch chiết khoai tây PGB làm môi trường nuôi cấy và sinh tổng hợp COD [118, 168, 203, 219]. Ngoài ra, gần đây trong nghiên cứu của Lee và cs hay Paszkiewicz và cs, các tác giả sử dụng môi trường MM, môi trường Czapek-Dox (CzD); môi trường FDM, môi trường LB làm môi trường nuôi cấy thu beauvericin từ nấm Fusarium oxysporum, Conidiobolus coronatus [91, 133]. Đặc biệt là chưa có nghiên cứu nào về sự sinh tổng hợp COD của nấm C. cateniannulata. Tuy nhiên, các nghiên cứu về nấm C. cateniannulata chủ yếu sử dụng môi trường môi trường PGB, môi trường Sabouraud (SBR) để nuôi cấy.
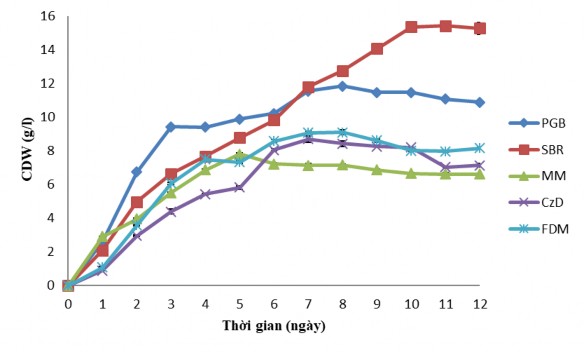
a) Khả năng sinh trưởng của chủng nấm C. cateniannulata CPA14V trong 05 loại môi trường nghiên cứu
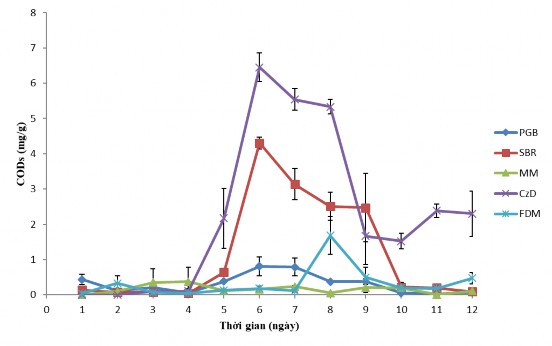
b) Khả năng sinh tổng hợp COD của chủng nấm
C. cateniannulata CPA14V trong 05 loại môi trường nghiên cứu
Hình 3.31. Khả năng sinh trưởng và sinh tổng hợp COD của chủng nấm
C. cateniannulata CPA14V trong 05 loại môi trường nghiên cứu
Chính vì vậy, dựa trên khảo sát các nghiên cứu trên chúng tôi tiến hành nuôi cấy chủng nấm C. cateniannulata CPA14V trên 05 loại môi trường nuôi cấy khác nhau (bao gồm: môi trường PGB; môi trường Sabouraud (SBR); môi trường MM; môi trường Czapek-Dox (CzD); môi trường FDM) để tìm ra môi trường dinh dưỡng phù hợp nhất cho sự sinh tổng hợp COD. Theo dõi sự thay đổi độ pH môi trường, khối lượng tế bào khô và hàm lượng COD tích lũy của chủng C. cateniannulata CPA14V trong 05 loại môi trường từ 01-12 ngày. Trong 05 loại môi trường nuôi cấy trên, chủng C. cateniannulata CPA14V đều có khả năng sinh trưởng và sinh COD. Kết quả nghiên cứu về khả năng sinh trưởng được thể hiện trong Hình 3.31a và khả năng sinh COD được thể hiện trong Hình 3.31b.
Môi trường PGB và Sabouraud là hai loại môi trường phù hợp cho sự sinh trưởng của chủng C. cateniannulata CPA14V. Trong 3 ngày nuôi cấy đầu tiên, tốc độ sinh trưởng của chủng nghiên cứu ở môi trường PGB vượt trội so với các môi trường còn lại, sinh khối khô đạt 9,44 g/l; tiếp theo là môi trường Sabouraud, đạt 6,65 g/l. Tuy nhiên, sinh khối tích lũy của chủng nghiên cứu là gần bằng nhau ở 02 loại môi trường PGB và Sabouraud vào ngày thứ 6 của quá trình nuôi cấy, đạt lần lượt ở môi trường PGB và Sabouraud là 10,23 g/l và 9,84 g/l. Đến ngày thứ 7 của quá trình nuôi cấy, sinh khối tích lũy trong môi trường Sabouraud là cao nhất, đạt 11,81 g/l; tiếp tục tăng cho tới ngày nuôi cấy thứ 10, đạt 15,36 g/l và duy trì khá ổn định cho tới ngày thứ 12 của quá trình nghiên cứu. Trong khi đó, ở 04 môi trường nghiên cứu còn lại, sinh khối của chủng C. cateniannulata CPA14V đạt cực đại vào ngày thứ 7-8 lần lượt ở các môi trường PGB, FDM, CzD và MM là 11,85 g/l; 9,11 g/l; 8,71 g/l và 7,16 g/l; biểu hiện sự suy giảm chậm ở các ngày tiếp theo (xem phụ lục 2,3). Mặc dù Sabouraud là môi trường phù hợp cho sinh trưởng của chủng nghiên cứu nhưng lượng sinh khối tích lũy cực đại thấp hơn so với khả năng






