1.2.3. Tổng hợp nano silica xốp (PNS) bằng phương pháp ngưng tụ hóa học (chemical vapor condensation gọi tắt là CVC)
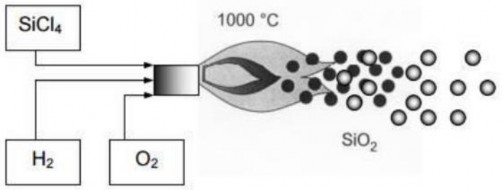
Phương pháp ngưng tụ hóa học là phương pháp tổng hợp silica từ quá trình thủy phân một silica halogen (thường là silic tetraclorua –SiCl4) sử dụng lò hồ quang có nhiệt độ trên 100oC trong hơi nước ở áp suất cao. SiCl4 và nước sẽ được bơm vào thiết bị bay hơi. Sau đó hơi nước và hơi SiCl4 được đưa vào lò phản ứng bằng khí mang nitơ đã làm nóng đến 100oC. SiCl4 được chuyển sang pha hơi và phản ứng với nước hoặc oxi và hydro theo các phương trình phản ứng sau [21]:
2H2 + O2 → 2H2O (1)
SiCl4 + 2H2O → SiO2 + 4HCl (2)
Có thể viết gọn như sau:
SiCl4 + 2H2 + O2 → SiO2 + 4HCl
Sau phản ứng, thu được hỗn hợp hạt nano silica và HCl. Để thu hồi riêng biệt nano silica và HCl dùng phương pháp khô hoặc ướt. Đối với phương pháp thu hồi khô, sau khi ống lò phản ứng được làm mát các hạt nano silica sẽ kết tụ và bám trên thành ống; khí nitơ sẽ thổi HCl vào thiết bị ngưng tụ khí và sau đó HCl sẽ được hấp thụ bởi dung dịch NaOH. Ở phương pháp thu hồi ướt, hỗn hợp nano silica và HCl được thổi vào dung dịch NaOH, ống lò phản ứng và bộ thu được nối bởi ống co, các ống co này được giữ ấm~120oC dẫn đến các hạt nano silica kết tụ trong bộ thu[19].
Phương pháp ngưng tụ hóa học rất khó khăn trong việc kiểm soát kích thước hạt, hình thái hạt và thành phần pha. Tuy nhiên, đây là phương pháp được sử dụng chủ yếu để sản xuất thương mại hạt nano silica ở dạng bột.
Có thể bạn quan tâm!
-
 Nghiên cứu biến tính bề mặt nano silica làm chất mang thuốc chống ung thư - 1
Nghiên cứu biến tính bề mặt nano silica làm chất mang thuốc chống ung thư - 1 -
 Nghiên cứu biến tính bề mặt nano silica làm chất mang thuốc chống ung thư - 2
Nghiên cứu biến tính bề mặt nano silica làm chất mang thuốc chống ung thư - 2 -
 Mô Tả Quá Trình Hình Thành Nano Silica Xốp, Biến Tính Và Mang Thuốc
Mô Tả Quá Trình Hình Thành Nano Silica Xốp, Biến Tính Và Mang Thuốc -
 Ứng Dụng Công Nghệ Nano Làm Chất Dẫn Truyền Thuốc Chống Ung Thư
Ứng Dụng Công Nghệ Nano Làm Chất Dẫn Truyền Thuốc Chống Ung Thư -
 Biến Tính Pns Bằng Gelatin (Tổng Hợp Pns-Aptes-Cooh-Ge Là Chất Mang 4) Tổng Hợp Pns-Aptes- Anhydridesuccinic
Biến Tính Pns Bằng Gelatin (Tổng Hợp Pns-Aptes-Cooh-Ge Là Chất Mang 4) Tổng Hợp Pns-Aptes- Anhydridesuccinic -
 Sơ Đồ Qui Trình Tổng Hợp Nano Silica Xốp (Pns) Bằng Phương Pháp Sol-Gel
Sơ Đồ Qui Trình Tổng Hợp Nano Silica Xốp (Pns) Bằng Phương Pháp Sol-Gel
Xem toàn bộ 137 trang tài liệu này.
Hình 1.3. Nguyên lý tạo hạt silica bằng phương pháp CVC
1.3. Các chất dùng để biến tính bề mặt nano silica
Một nhược điểm của nano silica khi được chọn làm vật liệu mang thuốc là không thể bảo vệ thuốc trong quá trình vận chuyển dẫn đến thuốc dễ bị rò rỉ ra ngoài từ đó có thể gây hại cho các tế bào lành tính cũng như khiến hiệu quả điều trị giảm sút. Vì vậy để đạt hiệu quả mang thuốc cao, các nhà khoa học đã bắt đầu nghiên cứu các phương pháp biến tính bề mặt hạt nano silica bằng cách gắn thêm các polymer khác để bảo vệ lượng thuốc bên trong, tạo liên kết hóa học với thuốc nhằm nâng hiệu quả mang thuốc [22].
Việc biến tính bề mặt vật liệu trở nên tương đối dễ dàng vì bề mặt PNS có chứa các nhóm OH- có thể dễ dàng tạo liên kết cộng hóa trị với các tác nhân biến tính khác nhau [23].
Hạt nano được biến tính với các polymer sinh học có khả năng vượt qua những rào cản của hệ thống miễn dịch cơ thể, kiểm soát duy trì quá trình vận chuyển thuốc lưu thông trong máu và giải phóng thuốc đúng mục tiêu xác định là tế bào bệnh. Các chất dùng để biến tính bề mặt nano silica (PNS) thường là những polymer có tính tương thích sinh học, có độc tính thấp, giá thành thấp, sẵn có trong tự nhiên, an toàn cho con người và thân thiện với môi trường. Trong số đó, gelatin (viết tắt là GEL hoặc GE) hoặc chitosan (CS) đang chiếm được rất nhiều sự quan tâm từ các nhà nghiên cứu do sự tương thích sinh học cao và ít mang độc tính hơn rất nhiều so với những loại vật liệu khác [24].
Ngoài ra, một số tác nhân khác như hydrazine, methoxy ethyleneglycol (mPEG), dithiodipropionic acid (DTDP) cũng được chọn biến tính lên vật liệu nano silica với những tính chất đặc trưng như sau:
1.3.1. Hydrazine
Hydrazine ( N2H4 là loại diamine đơn giản nhất và duy nhất trong nhóm vì có liên kết N
- N. Nó được phát hiện lần đầu tiên vào năm 1887 bởi Curtius dưới dạng muối sunfat từ este diazoacetic. Thiele (1893) cho rằng quá trình oxy hóa amoniac với hypochlorite sẽ tạo ra hydrazine và vào năm 1906 Raschig đã chứng minh quá trình này, tạo thành phương pháp sản xuất thương mại chính trong những năm 1990 [14].
![]()
Ứng dụng trong y tế là một trong những ứng dụng quan trọng nhất của hydrazine, như đã biết hydrazine tuy độc nhưng khi gắn nhóm amino trên vật liệu mang thuốc thì tính chất của hydrazine thay đổi chỉ còn một gốc amin vì vậy làm tăng hoạt tính sinh học và không gây độc đối với cơ thể người [25].
Hydrazine được sử dụng nhiều trong dẫn truyền thuốc do tạo được liên kết hydrazone rất nhạy với pH. Tại pH thấp của môi trường tế bào ung thư, liên kết hydrazone sẽ phá vỡ giải phóng thuốc đúng mục tiêu [26].
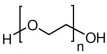
1.3.2. Polyethylene glycol (PEG)
Polyethylene glycol (PEG), là một loại polymer sinh học ưa nước, được sử dụng như một thành phần quan trọng đối với nhiều hệ thống dẫn thuốc khác nhau. PEG có khả năng kéo dài thời gian lưu thông trong máu để mang thuốc hướng đích.
Sự kết hợp PEG và thuốc có một vài thuận lợi:
- Tăng thời gian tồn tại của thuốc trong cơ thể.
- Giảm khả năng đào thải các enzyme cũng như các protein bởi hệ thống miễn dịch. Nhờ vào những thuận lợi đó, sự PEG hóa đóng vai trò quan trọng trong việc dẫn truyền thuốc.
PEG được tổng hợp từ quá trình polymer hóa mở vòng bởi tương tác nucleophilic bằng ion OH- lên vòng epoxide. Tuy nhiên, PEG có nhóm OH ở hai đầu mạch nên có độ đa phân tán và trọng lượng phân tử cao do phản ứng polymer hóa xảy ra ở cả hai đầu mạch. Để giải quyết vấn đề đó, người ta đã tiến hành thay thế chúng bằng monomethoxy PEG hay mPEG.
Về mặt dược học, gắn mPEG vào bề mặt giúp giảm một số quá trình không mong muốn. Cụ thể là mPEG gắn trên bề mặt gắn lên bề mặt thuốc giúp tránh đi sự đào thải của hệ miễn dịch [27].
Trong sinh học, mPEG phân tách giữa môi trường nước và màng tế bào do đó mPEG có khả năng dung hợp tế bào [13].
1.3.3. Biến tính bằng chitosan (CS)
Chitosan là một polymer sinh học, là một polysaccharide và là dẫn xuất của chitin. Chitin là một loại polymer tuyến tính của β (1→ 4) được liên kết N-acetyl-D-Glucosamine đơn vị gồm mucopolysaccharides (các polysaccharide chứa đường amine và acid uronic) và đường amino. Chitin là polymer hữu cơ thứ hai phổ biến trong tự nhiên sau cellulose. Chitin được tìm thấy trong các lớp biểu bì hoặc bộ khung xương ngoài của động vật giáp xác như tôm cua, côn trùng như châu chấu, chuồn chuồn.
Chitosan được tạo thành bởi các phản ứng deacetyl hóa chitin. Khi chitin được xử lý với các chất kiềm đặc ở nhiệt độ cao khoảng 120oC trong dung dịch, trong thời gian 1-3 giờ nó sẽ bị loại nhóm acetyl và bị phân hủy khác nhau để cho ra một sản phẩm là chitosan. Mức độ deacetyl hóa của chitosan thay đổi theo nguồn gốc của chitin và phương pháp chế biến. Vậy chitosan không phải là một đơn chất mà nó là một nhóm sản phẩm của chitin bị loại nhóm acetyl từng phần [28, 29].
![]()
![]()
![]()
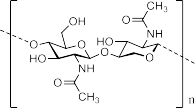
Hình 1.4. Sự tạo thành chitosan từ chitin.
Trong vòng 20 năm qua, nhiều công trình nghiên cứu đã được công bố về ứng dụng chitosan trong các lĩnh vực dẫn truyền thuốc. Trái ngược với tất cả các polysaccharid khác trong dược điển, chitosan có đặc tính cation vì các nhóm amin của chính nó. Nhờ vào các nhóm amin này giúp cho đặc tính giải phóng thuốc được kiểm soát, tăng tính bám dính niêm mạc, tăng cường thẩm thấu của thuốc [30].
1.3.4. Biến tính bằng dithiodipropionic acid (DTDP)
Dithiodipropionic acid hay 3,3’-dithiodipropionic acid là một tác nhân được phát triển cho nhiều lĩnh vực nghiên cứu. Gần đây, nhiều nhà nghiên cứu đã bắt đầu sử dụng DTDP trong hệ phân phối thuốc nhạy oxy hóa khử nhờ vào độ ổn định và ít độc, đặc biệt là trong cấu trúc có một liên kết disulfide và hai nhóm carboxylic acid ở hai đầu[31-34].
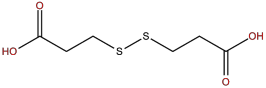
Hình 1.5. Cấu trúc hóa học của 3,3’-dithiodipropionic acid
Liên kết disulfide (-SS-) là liên kết mạnh, với năng lượng phân ly vào khoảng 60 kcal. Tuy nhiên yếu hơn khoảng 40% so với liên kết C-C và C-H. Một đặc tính quan trọng nhất của liên kết disulfide là khả năng phân cắt của chúng – phân cắt khi có mặt chất khử. Có rất nhiều chất khử có thể được sử dụng, chẳng hạn như các thiol như mercaptoethanol (b-ME), dithiothreitol (DTT),…
Glutathione (GSH) là một tác nhân khử có khả năng cắt đứt liên kết disulfide. Nhiều nghiên cứu đã cho thấy tác nhân này được tạo ra nhiều trong tế bào ung thư hơn là tế bào bình thường (nồng độ của GSH trong tế bào ung thư (2–8 mM) cao hơn 1000 lần so với nồng độ GSH trong máu và tế bào thường (1–2 µM)). Do đó khi kết hợp liên kết disulfide (hay sử dụng DTDP) sẽ giúp tăng tính giải phóng chọn lọc của thuốc khi cho vào cơ thể [35, 36].
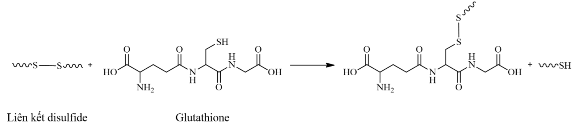
Hình 1.6. Liên kết disulfide ban đầu bị cắt đứt và tái hình thành liên kết disulfide khác
1.3.5. Biến tính bằng Gelatin
Gelatin đã được nghiên cứu rộng rãi như là một chất vận chuyển thuốc cho nhiều nhóm thuốc do tính chất của nó là một vật liệu sinh học tự nhiên và lịch sử sử dụng an toàn trong một loạt các ứng dụng y tế và dược phẩm. Tính chất gelatin có thể được điều chỉnh để tối đa hóa hiệu quả nạp thuốc. Điểm đẳng điện gelatin có thể được điều chỉnh theo tính chất
tĩnh điện của phân tử thuốc được chọn bằng cách sử dụng phương pháp xử lý bằng kiềm hoặc acid. Hơn nữa, bản chất ưa nước của gelatin tạo điều kiện cho sự xâm nhập của chất lỏng cơ thể vào các hạt và do đó làm tăng sự giải phóng qua trung gian khuếch tán của các phân tử hoạt tính sinh học. Là chất mang thuốc, gelatin đã được chứng minh có hoạt tính sinh học vượt trội.
Gelatin là một thành phần thực phẩm dạng mờ đục, không màu, không hương vị, giòn ở dạng rắn và có độ nhớt cao khi ẩm. Gelatin có nguồn gốc từ collagen lấy từ các bộ phận cơ thể động vật, nên còn được gọi là collagen thủy phân, collagen hydrolyzate, gelatin hydrolyzate, gelatin thủy phân và collagen peptide [37].
Gelatin được công bố là một vật liệu có tính độc hại rất thấp chỉ khi ở hàm lượng rất cao mới có độc tính với cơ thể người.
Các vi hạt gelatin có thể đóng vai trò là phương tiện để khuếch đại tế bào và cung cấp các phân tử hoạt tính sinh học lớn, trong khi đó các hạt nano gelatin có sự hấp thu nội bào cao hơn và phù hợp hơn cho việc truyền tĩnh mạch hoặc đưa thuốc vào não. Sợi gelatin chứa tỷ lệ diện tích bề mặt lớn và độ xốp cao, trong khi đó gelatin hydrogel có thể bẫy các phân tử trong khoảng trống giữa các liên kết polymer, cho phép thuốc khuếch tán vào dòng máu.
Một lĩnh vực khác đang được quan tâm phát triển là sự kết hợp giữa gelatin dựa trên mô sinh học với sự giải phóng thuốc có kiểm soát để kiểm soát cơn đau và chữa lành vết thương.
Các hệ thống dựa trên gelatin thể hiện khả năng hấp thụ nước cao do có nhiều phần ưa nước trên bề mặt vật liệu.
Thành phần hóa học cơ bản của gelatin bao gồm: 85–90% protein, 0,5–2% muối khoáng, 8–13% nước.
Cấu trúc phân tử gelatin gồm có 20 amino acid khác nhau liên kết với nhau theo một trật tự xác định, tuần hoàn, tạo nên chuỗi polypeptide có khoảng 1000 acid amin hình thành nên cấu trúc bậc 1. Các chuỗi peptide có chiều dài khác nhau phụ thuộc nguồn nguyên liệu và phương pháp sản xuất và độ dài của chuỗi sẽ ảnh hưởng đến tính mềm dẻo của gelatin. Mỗi chuỗi có một đầu là nhóm amino, còn một đầu là nhóm carboxyl.
Về mặt cấu trúc, các phân tử collagen và gelatin chứa các chuỗi lặp lại của bộ ba Gly- X-Y, trong đó X và Y chủ yếu là các axit amin proline (Pro), hydroxyproline (Hypro) và Gly là thành phần chiếm ưu thế, là acid amin nhỏ nhất [37].
Gelatin có nhiều nhóm glycine, proline và 4-hydroxyproline và có thứ tự sắp xếp là– Ala Gly Pro Arg Gly Glu Hyp Gly Pro
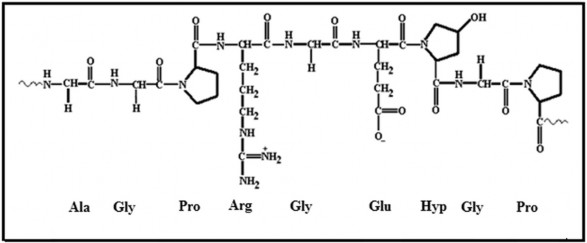
Hình 1.7. Cấu trúc cơ bản của Gelatin
1.4. Thuốc trị bệnh ung thư (hóa trị)
Hóa trị là một phương pháp sử dụng một hoặc nhiều loại thuốc chống ung thư (gây độc tế bào) để làm hư hỏng các tế bào ung thư, vì vậy các khối u không thể phát triển và tăng sinh. Hóa trị có hiệu quả cao nhất trên các tế bào đang tích cực phát triển và phân chia. Bởi vì hầu hết các tế bào ung thư có xu hướng phát triển và phân chia nhanh nên chúng rất nhạy với những tác động của tác nhân hóa trị[38].
Tất cả các tế bào đều trải qua chu trình tế bào. Đây là quá trình mà các tế bào phân chia để tạo ra nhiều tế bào hơn. Các loại thuốc hóa trị làm gián đoạn chu trình tế bào ung thư và làm chậm hoặc ngưng quá trình sao chép các tế bào. Một số loại thuốc hóa trị chỉ ảnh hưởng đến một số giai đoạn nhất định của chu trình tế bào ung thư, các loại thuốc còn lại thường ảnh hưởng đến tất cả các giai đoạn trong chu trình tế bào, bất kể là tế bào đang phân chia hay không phân chia.
1.4.1. Thuốc 5-Fluorouracil (5-FU)
1.4.1.1. Giới thiệu
5-FU được tìm thấy vào năm 1950, sử dụng rộng rãi trong điều trị ung thư như ung thư ruột, ung thư vú, ung thư hệ tiêu hóa. Trong đó 5-FU thường được sử dụng để điều trị ung thư đường ruột [39].
Nhóm nghiên cứu chọn 5-FU vì đây là loại thuốc thông dụng đặc trị cho ung thư tiêu hóa, ung thư đại tràng là loại ung thư phổ biến hiện nay.
Hình 1.8. Công thức của Fluorouracil (5-FU)
1.4.1.2. Cơ chế của 5-FU
5-FU là một chất tương tự uracil với một nguyên tử flo tại vị trí C5. Khi vào cơ thể người bệnh, 5-FU chuyển hóa thành fluorodeoxyuridine monophosphate (FdUMP) là chất ức chế Thymidylate synthetase (TS) gây thiếu thymine dẫn đến mất cân bằng các loại nucleotide cho quá trình tổng hợp DNA. 5-FU cũng có thể chuyển hóa thành fluorodeoxyuridine triphosphate (FdUTP) cạnh tranh làm đứt gãy DNA. Tương tự, fluorouridine triphosphate (FUTP) hình thành từ 5-FU làm đứt gãy RNA. Hậu quả đều làm protein p53 được kích hoạt mạnh, đưa tế bào vào chương trình tự chết (apoptosis) [39, 40]
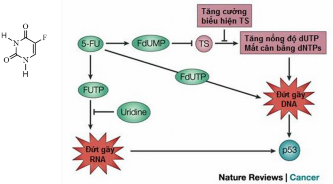
Hình 1.9. Công thức hóa học của Fluorouracil (5-FU) và cơ chế tiêu diệt tế bào ung thư của 5-FU[40]