1.4.2. Thuốc Doxorubicin (DOX)
1.4.2.1. Giới thiệu
Doxorubicin là một kháng sinh nhóm anthracyclin gây độc tế bào được phân lập từ môi trường nuôi cấy Streptomyces peucetius var., caeciu. Hiện nay được dùng phổ biến trong hóa trị liệu ung thư, có công thức cấu tạo như hình bên dưới [41].
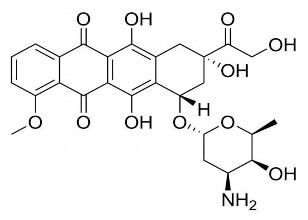
Hình 1.10. Công thức cấu tạo của doxorubicin[41]
Có thể bạn quan tâm!
-
 Nghiên cứu biến tính bề mặt nano silica làm chất mang thuốc chống ung thư - 2
Nghiên cứu biến tính bề mặt nano silica làm chất mang thuốc chống ung thư - 2 -
 Mô Tả Quá Trình Hình Thành Nano Silica Xốp, Biến Tính Và Mang Thuốc
Mô Tả Quá Trình Hình Thành Nano Silica Xốp, Biến Tính Và Mang Thuốc -
 Tổng Hợp Nano Silica Xốp (Pns) Bằng Phương Pháp Ngưng Tụ Hóa Học (Chemical Vapor Condensation Gọi Tắt Là Cvc)
Tổng Hợp Nano Silica Xốp (Pns) Bằng Phương Pháp Ngưng Tụ Hóa Học (Chemical Vapor Condensation Gọi Tắt Là Cvc) -
 Biến Tính Pns Bằng Gelatin (Tổng Hợp Pns-Aptes-Cooh-Ge Là Chất Mang 4) Tổng Hợp Pns-Aptes- Anhydridesuccinic
Biến Tính Pns Bằng Gelatin (Tổng Hợp Pns-Aptes-Cooh-Ge Là Chất Mang 4) Tổng Hợp Pns-Aptes- Anhydridesuccinic -
 Sơ Đồ Qui Trình Tổng Hợp Nano Silica Xốp (Pns) Bằng Phương Pháp Sol-Gel
Sơ Đồ Qui Trình Tổng Hợp Nano Silica Xốp (Pns) Bằng Phương Pháp Sol-Gel -
 Biến Tính Pns Bằng Gelatin-Mpeg (Tổng Hợp Pns-Aptes-Cooh-Gel-Mpeg Hay Còn Gọi Là Pns -Gel-Mpeg Là Chất Mang Thuốc 5)
Biến Tính Pns Bằng Gelatin-Mpeg (Tổng Hợp Pns-Aptes-Cooh-Gel-Mpeg Hay Còn Gọi Là Pns -Gel-Mpeg Là Chất Mang Thuốc 5)
Xem toàn bộ 137 trang tài liệu này.
Tên khoa học: (7S,9S)-7-[(2R,4S,5S,6S)-4-Amino-5-hydroxy-6-methyloxan-2-yl]oxy-6,9,11
-trihydroxy-9-(2-hydroxyacetyl)-4-methoxy-8,10-dihydro-7H-tetracene-5,12-dione.
Sau khi tiêm tĩnh mạch, Doxorubicin nhanh chóng thải trừ khỏi máu và phân bố vào mô bao gồm phổi, gan, tim, lá lách và thận. Doxorubicin bị chuyển hóa một phần tại gan tạo thành các dẫn chất chuyển hóa, bao gồm cả doxorubicinol là một chất giảm hoạt tính. Khoảng 40 – 50% lượng doxorubicin bắt đầu được thải trừ qua mật trong vòng 7 ngày; chỉ khoảng 5% được thải trừ qua nước tiểu trong vòng 5 ngày [42].
Doxorubicin là loại thuốc khá phổ biến ở Việt Nam hiện dùng điều trị nhiều loại ung thư như ung thư vú, buồng trứng, dạ dày…
1.4.2.2. Cơ chế tác dụng
Doxorubicin gắn vào DNA làm ức chế các enzym cần thiết để sao chép và phiên mã DNA, đặc biệt Doxorubicin gây gián đoạn mạnh chu kỳ phát triển tế bào ở giai đoạn phân bào S và giai đoạn gián phân, nhưng thuốc cũng tác dụng trên các giai đoạn khác của chu kỳ phát triển tế bào.
1.4.2.3. Chỉ định
Chỉ định chính: Doxorubicin được dùng phổ biến trong điều trị nhiều loại ung thư, bao gồm ung thư vú, u xương ác tính (sarcom xương) và u xương Ewing, u mô mềm, u khí phế quản, u lympho ác tính cả hai dạng Hodgkin và không Hodgkin, ung thư biểu mô tuyến giáp (carcinoma tuyến giáp). Ung thư đường tiết niệu và sinh dục: ung thư tử cung, ung thư bàng quang, ung thư tinh hoàn. Khối u đặc ở trẻ em: Sarcom cơ vân, u nguyên bào thần kinh, u Wilm, bệnh leucemi cấp…
Chỉ định tương đối: ung thư tuyến tiền liệt, cổ tử cung, âm đạo, dạ dày. Có tác dụng tốt trên một số ung thư hiếm gặp như đa u tủy xương, u màng hoạt dịch, u nguyên bào võng mạc.
1.4.3. Tác dụng phụ [43]
Thuốc hóa trị tiêu diệt tế bào ung thư, nhưng cũng gây hại cho các tế bào khỏe mạnh.
Các tế bào khỏe mạnh bị hư hại là nguyên nhân gây ra tác dụng phụ.
Các tế bào và mô bên trong cơ thể có khả năng chịu đựng được hóa trị liệu là khác nhau. Thuốc thường ảnh hưởng lớn nhất lên các tế bào phát triển nhanh, chẳng hạn tế bào tủy xương, tế bào trong miệng, tế bào trong đường tiêu hóa, tế bào nang và tóc.
Các tác dụng phụ thường gặp là:
Ức chế tủy xương: đây là tác dụng phụ thường gặp và nghiêm trọng nhất của hóa trị. Chúng làm giảm lượng tế bào máu sinh ra do tủy xương.
Viêm miệng, viêm niêm mạc miệng hoặc viêm màng nhầy.
Buồn nôn ói mửa rụng tóc
Chán ăn, mệt mỏi.
Táo bón, hoặc tiêu chảy mất nước
Trong đề tài này, nhóm nghiên cứu chọn doxorubicin và 5-Fluorouracil vì tính cần thiết của 2 loại thuốc này trong nhiều phác đồ điều trị ung thư tại Việt Nam.
1.5. Ứng dụng công nghệ nano làm chất dẫn truyền thuốc chống ung thư
Trong y khoa hiện đại, các nhà khoa học luôn tìm kiếm các vật liệu dẫn truyền thuốc mới nhằm cải thiện khả năng phân phối thuốc đồng thời tăng tác dụng của thuốc và tăng hiệu quả chữa bệnh. Chất nano dẫn truyền thuốc phải được tổng hợp dựa trên 3 tiêu chí sau:
Kéo dài thời gian và cải thiện hiệu quả chữa bệnh của thuốc
Giảm độ chuyển hóa của thuốc
Giảm độ độc của cả hệ thống và dẫn truyền thuốc đúng mục tiêu
Trong vài thập kỹ qua, nghiên cứu trong lĩnh vực nano dẫn truyền thuốc đang được chú ý. Hệ thống hạt nano dẫn truyền thuốc được biến tính nhằm cải thiện các tính chất dược động lực học và dược tính của các loại phân tử thuốc[2].
Theo hệ thống phân phối thuốc, các hạt nano có thể ngậm thuốc hay phân tử sinh học thành những cấu trúc bên trong của chúng hoặc hấp phụ thuốc hoặc phân tử sinh học lên các bề mặt bên ngoài của chúng [44].
Kích thước hạt và đặc điểm bề mặt có thể được thao tác dễ dàng để đạt được cả hai mục tiêu thụ động và chủ động của thuốc sau khi đưa thuốc vào cơ thể.
1.5.1. Cơ chế mang thuốc hướng đích thụ động:
Khi thuốc được đưa vào cơ thể, hệ dẫn thuốc nano sẽ theo hệ thống tuần hoàn qua mạch máu để đi đến mục tiêu là tế bào bệnh. Kích cỡ hạt nano là yếu tố quan trọng cho việc mang thuốc, kích cỡ này phải trong phạm vi từ 10 đến 200 nm. Nếu nhỏ hơn 10 nm thì hạt có thể sẽ bị thải ra theo đường bài tiết hoặc chui vào các khe hở lớp nội mô thành mạch máu tế bào bình thường. Nếu lớn hơn 200 nm, hạt sẽ không khuyếch tán được qua thành mạch máu và sẽ bị đào thải ra ngoài theo cơ chế miễn dịch. Vậy cơ chế này vận dụng sự khác biệt giữa vùng mô thường và mô ung thư nghĩa là nhờ hiện tượng tăng tính thấm và tăng hiệu quả lưu giữ (Enhanced permeability and Retention Effect – EPR) [45].
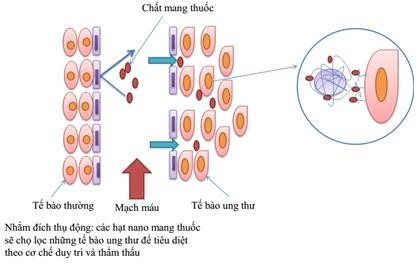
Hình 1.11. Nhắm mục tiêu thụ động [46]
1.5.2. Cơ chế mang thuốc hướng đích chủ động:
Giữa tế bào ung thư và tế bào lành có 3 yếu tố khác nhau cơ bản: tế bào ung thư có độ pH thấp (pH khoảng 4-5), có nhiệt độ cao (38-40oC) và trên bề mặt có nhiều loại vitamin (nhiều nhất là nhóm B9), trong khi đó tế bào thường có pH (7,2-7,4) và nhiệt độ (36-37oC). Vậy để tạo hạt nano mang thuốc chủ động ta nên biến tính hạt tạo thành các nhóm chức năng đặc biệt hướng đến tế bào ung thư. Chẳng hạn như tế bào ung thư có ái lực với acid folic nên thường gắn acid folic làm tác nhân hướng đích chủ động [45].
Vị trí dẫn truyền thuốc vào mục tiêu cụ thể có thể đạt được bằng cách gắn các phối tử mục tiêu lên bề mặt hạt nano mang thuốc hoặc sử dụng các chất có từ tính.
Ưu điểm của phân phối thuốc qua trung gian cấu trúc nano bao gồm khả năng để cung cấp các phân tử thuốc trực tiếp vào các tế bào và khả năng nhắm mục tiêu các khối u trong mô khỏe mạnh.
1.5.3. Những nghiên cứu của vật liệu nano silica trong lĩnh vực dẫn truyền thuốc
Vật liệu nano silica xốp thể hiện những đặc điểm riêng biệt khiến chúng trở thành vật mang nano lý tưởng để lưu trữ, bảo vệ và vận chuyển thuốc đến vị trí mục tiêu. Một thách thức quan trọng khác là tránh tình trạng giải phóng thuốc quá sớm trước khi đạt mục tiêu là tế bào ung thư. Theo cách này, các lỗ của vật liệu nano silica xốp có thể được giới hạn bằng cách sử dụng những chất giữ thuốc lại.
Một trong những lợi thế của nano silica xốp là có thể dễ dàng biến tính để giữ thuốc trong lỗ xốp và mang thuốc đến đúng tế bào ung thư, giải phóng đúng vị trí và kiểm soát liều lượng một cách tinh tế dựa trên cơ chế giải phóng nhạy pH[47]. Các tác nhân hydrazine, chitosan, gelatin là những chất có khả năng năng tạo liên kết hydrazon, imine với thuốc và rất nhạy pH nhả thuốc đúng mục tiêu.
Các hạt nano silica đã tạo ra một cuộc cách mạng trong lĩnh vực nghiên cứu hệ thống phân phối và dẫn truyền thuốc hướng đích. Kể từ năm 2001, Vallet-Regí và các công sự của ông [48] lần đầu tiên đã chế tạo ra vật liệu MSNs (nano silica xốp còn gọi là PNS-porous nano silicas) đa chức năng để điều trị các bệnh lý đa dạng. Theo khảo sát của Vallet-Regí, người tiên phong nghiên cứu vật liệu nano silica xốp ứng dụng trong y sinh, cho biết vật liệu nano silica xốp đã cho ra đời những thành tựu nghiên cứu khoa học trong lĩnh vực dẫn truyền thuốc đáng kể từ năm 2001 cho đến nay [47].
Việc đưa nanomedicine vào lĩnh vực này được kỳ vọng sẽ thay đổi tương lai gần của ngành dược phẩm và công nghệ sinh học. Công cụ công nghệ nano mới này sẽ khắc phục được những hạn chế lớn của y học thông thường như độ hòa tan và độ ổn định thấp, thiếu tính đặc hiệu và cấu hình dược động học không đầy đủ và tác dụng phụ nghiêm trọng của thuốc [49]. Mặc dù trong vài thập kỷ qua, việc đưa vật liệu nano vào y học đã cung cấp hơn 250 sản phẩm đã được phê duyệt hoặc đang trải qua các giai đoạn thử nghiệm lâm sàng khác nhau, ứng dụng lâm sàng cuối cùng của chúng vẫn là một thách thức lớn [50].
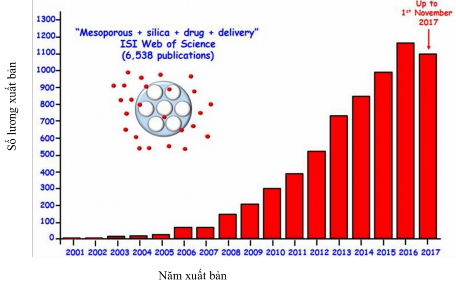
Hình 1.12. Thành tựu nghiên cứu khoa học trong lĩnh vực dẫn truyền thuốc[47].
1.6. Nội dung và phương pháp nghiên cứu
1.6.1. Tổng hợp nanosilica xốp và tạo cầu nối biến tính
1.6.1.1. Tổng hợp vật liệu nano silica xốp bằng phương pháp sol-gel
Nano silica xốp (porous nano silicas) được tổng hợp bằng phương pháp sol-gel sao cho kích thước hạt đồng đều dưới 100 (nm). Với kích thước này hạt nano sau khi biến tính hoàn toàn có khả năng xâm nhập vào các thành mạch máu và màng tế bào để giải phóng.
Phương pháp sol-gel là một kỹ thuật phổ biến được sử dụng để tạo ra một số vật liệu có kích thước ở cấp độ nano. Quá trình này thường liên quan đến những phân tử alkoxide kim loại mà chúng sẽ bị thủy phân trong điều kiện được kiểm soát.
Phản ứng thủy phân thay thế nhóm alkoxide (–OR) trong liên kết kim loại – alkoxide bằng nhóm hydroxyl (–OH) để tạo thành liên kết kim loại –hydroxyl.
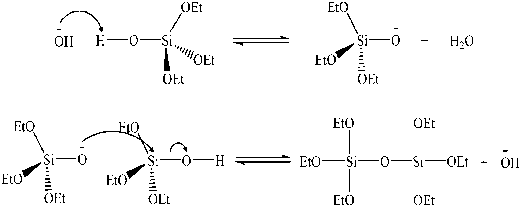
Hình 1.13. Cơ chế phản ứng thủy phân và ngưng tụ.
Trong phản ứng thủy phân, các nhóm alkoxide (–OR) trong liên kết kim loại – alkoxide được thay thế bằng nhóm hydroxyl (–OH) của môi trường để tạo thành liên kết kim loại – hydroxyl. Trong khi đó, phản ứng ngưng tụ tạo nên liên kết kim loại – oxide – kim loại, đây là cơ sở cấu trúc cho các màng oxide kim loại. Hiện tượng ngưng tụ diễn ra liên tục làm cho liên kết kim loại–oxi–kim loại không ngừng tăng lên đến khi tạo ra một mạng lưới trong khắp dung dịch.
Sử dụng chất hoạt động bề mặt Cetyltrimethylamnonium bromide (CTAB) như một tác nhân định hình cấu trúc lỗ xốp cho vật liệu nano, đây cũng có thể xem là khung sườn để TEOS có thể thủy phân và bao lấy tạo điều kiện cho việc hình thành các hạt nano silica xốp sau này, các hạt nano silica xốp được tạo ra với mong muốn có thể mang thuốc được nhiều hơn nhờ vào cấu trúc lỗ xốp của vật liệu [51].
1.6.1.2. Tạo cầu nối biến tính
Như đã trình bày, việc biến tính bề mặt vật liệu nano silica nhằm tăng hoạt tính sinh học, nâng cao hiệu quả mang thuốc, kéo dài thời gian lưu thông thuốc và giải phóng tại đúng mục tiêu.
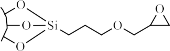
Để thuận lợi cho việc biến tính, chúng ta thường tạo cầu nối trước khi biến tính. Chất làm cầu nối thường có một đầu tạo liên kết hóa học với nhóm OH trên bề mặt nano silicas và đầu còn lại thường mang nhóm có hoạt tính mạnh dễ dàng tạo phản ứng với các chất biến tính. Trong đề tài chúng tôi chọn (3-glycidoxypropyl)trimethoxysilane (GPTMS) và (3- aminopropyl)triethoxysilane (APTES) làm cầu nối.
Tổng hợp PNS-GPTMS
Cầu nối này có một số tính chất thuận lợi như sau:
Hình 1.14. Cấu trúc (3-glycidoxypropyl)trimethoxysilane
Nhóm epoxide hoạt động hóa học rất tốt và nó có khả năng tham gia nhiều phản ứng. Bởi vì glycidyl ether có chứa nhóm epoxide nên nó được ứng dung rất nhiều trong hóa sinh. Khi tồn tại ion H+, vòng epoxide sẽ bị ion hóa, hoạt tính mạnh sẽ tham gia phản ứng với các tác nhân thân hạch (ái nhân). Vòng epoxide bị bẻ gãy và kết quả là hình thành nhóm alcol.
Với các acid hữu cơ, các alcol được hình thành sau đó là phản ứng ester hóa diễn ra.
Các phenol phản ứng để tạo ra nhóm alcol và vòng thơm được gắn vào thông qua liên kết ether.
Một vài chất ái nhân (thân hạch) có thể phản ứng trên epoxide, kết quả là vòng này bị bẻ gãy và nguyên tử oxy trở nên rất thân hạch.
Vòng epoxide còn được biết như là một trong những tác nhân alkyl hóa hoặc là tác nhân thân điện tử, bởi việc hình thành ion carbonium, ion này có thể phản ứng với các tác nhân thân hạch (ái nhân).
![]()
![]()
![]()
![]()
Hình 1.15. Phản ứng tạo cầu nối GPTMS trên nano silica xốp (PNS-GPTMS).
Giai đoạn này có thể xem là giai đoạn hoạt hóa hạt silica, bởi ngoài những thuận lợi của cầu nối epoxy thì GPTMS không gây độc cho cơ thể và phản ứng của nó lên bề mặt silica là rất êm dịu, tránh được những biến đổi bề mặt không cần thiết trên hạt silica.
Tổng hợp PNS-APTES
Các hạt nano PNS-APTES cũng được tổng hợp bằng phương pháp sol-gel, sử dụng APTES như nguồn cung cấp -NH2 cho bề mặt hạt nano silica xốp.
Ban đầu sử dụng CTAB như một tác nhân tạo khung sườn để TEOS thủy phân và ngưng tụ để tạo thành các hạt nano silica xốp, các hạt nano silica xốp được tạo ra và tiếp tục được gắn APTES với mục đích làm cầu nối cho giai đoạn biến tính với Gelatin
Có nhiều yếu tố ảnh hưởng đến phản ứng tổng hợp bao gồm nhiệt độ, tốc độ khuấy, xúc tác. Tuy nhiên, để đạt được kích thước mong muốn như trên thì phản ứng này nên được
tiến hành ở 60C, xúc tác NH3 với nồng độ 2,8%, cũng như tốc độ khuấy khoảng 350 vòng/phút.
Hình 1.16. Phản ứng tạo cầu nối APTES trên nano silica xốp (PNS-APTES).
1.6.2. Biến tính vật liệu nano silica xốp (PNS)
1.6.2.1. Biến tính PNS bằng Hydrazine (tổng hợp PNS-GPTMS-Hydrazine là chất mang thuốc 1)
Nhằm mục đích tạo nên nhóm hydrazine trên bề mặt nanosilica xốp và dựa trên liên kết hydrazone bền với doxorubicin tại môi trường trung tính. Chất mang sẽ mang thuốc đến đúng tế bào ung thư (có pH kém) mới giải phóng, tăng hiệu quả của phương pháp hóa trị.
![]()
![]()
Hình 1.17. Phản ứng biến tính nano silica xốp(PNS) bằng hydrazine
1.6.2.2. Biến tính PNS bằng Chitosan-mPEG (tổng hợp PNS-GPTMS-CS-mPEG là chất mang thuốc 2)
Tổng hợp Chitosan-mPEG
Qui trình tiến hành gồm 2 bước, đầu tiên hoạt hóa mPEG bằng p-nitrophenyl carbonate (NPC) trước sau đó mới tổng hợp chitosan-mPEG
![]() Hoạt hóa mPEG bằng p-nitrophenyl carbonate (NPC)
Hoạt hóa mPEG bằng p-nitrophenyl carbonate (NPC)
Phản ứng thế ái nhân (thân hạch) trên carbon của nhóm carbonyl diễn ra thuận lợi ở nhiệt độ 65C.