kháng thuốc và phân đoạn gen mã hóa HA để xác định sự tiến hóa của vi rút [46, 112, 113]. Tuy nhiên, để thực hiện mục tiêu của nghiên cứu về sự tiến hóa của vi rút, toàn bộ chủng cúm A trong nghiên cứu được giải trình tự hai phân đoạn gen mã hóa HA và NA.
2.3. Vật liệu và kỹ thuật xét nghiệm
2.3.1. Vật liệu
2.3.1.1. Chủng vi rút
Cỡ mẫu trong nghiên cứu được xác định là cỡ mẫu toàn bộ 342 chủng bao gồm: 42 chủng H1N1 thu thập từ năm 2001 đến 2009; 157 chủng H1N1pdm09 thu thập từ tháng 6 năm 2009 đến 2012; 115 chủng H3N2 thu thập từ năm 2003 đến 2012 và 28 chủng H5N1 thu thập từ năm 2004 đến 2012
Các chủng cúm thu thập theo năm được sử dụng trong nghiên cứu
Số lượng chủng | ||||
A/H1N1 | A/H1N1 pdm09 | A/H3N2 | A/H5N1 | |
2001 | 8 | - | 0 | - |
2002 | 4 | - | 0 | - |
2003 | 14 | - | 4 | 1 |
2004 | - | - | 13 | 4 |
2005 | - | - | 2 | 3 |
2006 | 3 | - | 0 | - |
2007 | - | - | 16 | 8 |
2008 | 7 | - | 1 | 5 |
2009 | 6 | 86 | 36 | 4 |
2010 | - | 13 | 12 | 3 |
2011 | - | 58 | 1 | - |
2012 | - | - | 30 | - |
Tổng | 42 | 157 | 115 | 28 |
342 | ||||
Có thể bạn quan tâm!
-
 Sự Trao Đổi Và Tích Hợp Trong Hệ Gen Của Vi Rút Cúm A
Sự Trao Đổi Và Tích Hợp Trong Hệ Gen Của Vi Rút Cúm A -
 Tình Hình Kháng Thuốc Của Vi Rút Cúm A Với Thuốc Kháng Vi Rút
Tình Hình Kháng Thuốc Của Vi Rút Cúm A Với Thuốc Kháng Vi Rút -
 Kỹ Thuật Xác Định Mức Độ Kháng Oseltamivir Dựa Trên Hoạt Động Của Neuraminidase
Kỹ Thuật Xác Định Mức Độ Kháng Oseltamivir Dựa Trên Hoạt Động Của Neuraminidase -
 Giải Trình Tự Gen Sử Dụng Phương Pháp Thông Thường (Sanger) Nguyên Lý
Giải Trình Tự Gen Sử Dụng Phương Pháp Thông Thường (Sanger) Nguyên Lý -
 Xác Định Giá Trị Ic50 Ngưỡng Của Các Phân Típ Vi Rút Cúm A
Xác Định Giá Trị Ic50 Ngưỡng Của Các Phân Típ Vi Rút Cúm A -
 Sự Tương Tác Của Oseltamivir Với Các Vi Rút Cúm A/h3N2
Sự Tương Tác Của Oseltamivir Với Các Vi Rút Cúm A/h3N2
Xem toàn bộ 147 trang tài liệu này.

2.3.1.2. Tế bào
Tế bào thường trực thận chó MDCK (Madin – Darby Canine Kidney) có nguồn gốc từ trung tâm kiểm soát bệnh dịch Hoa Kỳ (US-CDC)
2.3.1.3. Sinh phẩm
Sinh phẩm cho phương pháp phân lập vi rút
Sinh phẩm Xuất xứ
Tế bào Madin-Darby Canine Kidney (MDCK) US-CDC
Chai nuôi cấy tế bào T-75 Corning Cat.No. 430720 Dulbecco’s Modified Eagle Medium (D-MEM) GIBCO Cat.No. 11965-092
Penicillin-Streptomycin, dạng dung dịch đặc (10,000 U/ml penicillin G; 10,000 μg/ml streptomycin sulfate)
GIBCO Cat.No. 15140-023
Dung dịch Bovine serum albumin fraction V, 7.5% GIBCO Cat.No. 15260-011
Fetal bovine serum, 40 nm filtered HyClone Laboratories, Inc Cat.No. A-1111-L
Trypsin-EDTA
(0.05% trypsin; 0.53 mM EDTA.4Na)
GIBCO Cat.No. 25300-054
Trypsin, TPCK Sigma Cat.No. T-8642
Gentamicin reagent dạng dung dịch (50mg gentamicin sulfate/ml)
GIBCO Cat.No 15750-011
Cồn (96-100%) Merck Cat.No.1.00983.1000
Sinh phẩm cho phương pháp giải trình tự gen
* Tạo đoạn DNA bổ sung
- Mồi Universal 12 (Invitrogen)
- Enzyme Superscript III reverse transcriptase – Invitrogen (Mã catalog 18080085).
* PCR
- PCR kit
- Qiagen HotStar Hifidelity (Mã catalog 202602)
- Qiagen One step RT-PCR (Mã catalog 210212)
- Mồi cho PCR và giải trình tự phân đoạn gen mã hóa NA
Trình tự | Hướng | |
Ba-NA-1F | AGCGAAAGCAGGAGT | Xuôi |
Ba-NA-1413R | AGTAGAAACAAGGAGTTTTTT | Ngược |
N1-780F | GGGGAAGATTGTYAAATCAGTYGA | Xuôi |
N1-1273R | CWACCCAGAARCAAGGYCTTATG | Ngược |
- Mồi cho PCR và giải trình tự phân đoạn gen mã hóa HA
H5-3F | CTC GGA AAC CCA ATG TGT GAC | Xuôi |
H5-R1 | GAC AGT ATT TGG TAA ATT CC | Ngược |
H5-5R | GGA CTC AAG AAT TAT GAA AAG TG | Xuôi |
H5-3R | CTC CCC TGC TCA TTG CTA TG | Ngược |
H1HA và Bm-HA-1F | AGCGAAAGCAGGGG | Xuôi |
Phân típ cúm Mồi Trình tự Hướng
H5HA
H1pdm09 HA Bm-NS-890R AGTAGAAACAAGGGTGTTTT Ngược
* Tinh sạch sản phẩm
- Kit làm tinh sạch sản phẩm PCR (khi sản phẩm PCR thu được một băng đặc hiệu) của hãng Qiagen: Purification kit Qiaquick (250) Mã catalog 28106
- Kit làm tinh sạch sản phẩm PCR (khi sản phẩm PCR thu được một gồm nhiều băng không đặc hiệu, trong số đó có băng là sản phẩm mong muốn) của hãng Qiagen: Qiaquick Gel Extraction kit (250) Mã catalog 28706
- Kit làm tinh sạch sản phẩm sau khi chạy chu trình nhiệt gắn dideoxynucleotide của hãng Qiagen: DyeEx 2.0 Spin kit Qiagen Mã catalog 63206
* Giải trình tự gen
- Kit BigDye Terminator v3.1 ABI. Mã catalog 4336917
- Polymer: POP 7 ABI. Mã catalog 4352759
Sinh phẩm cho phương pháp xác định nồng độ oseltamivir ức chế neuraminidase
- 2-Morpholinoethanesulfonic acid (MES) (Sigma-Aldrich Mã catalog M3671)
- Oseltamivir Carboxylate (Roche. GS4071)
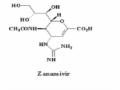
- Zanamivir (Glaxo-Smithkline. GR121167X)
- MUNANA [2’ 2’-(4-Methylumbelliferyl)-α-D-N-acetylneuraminic acid sodium salt hydrate] (Sigma - Aldrich Mã catalog M8639)
2.3.1.4. Thiết bị và dụng cụ Thiết bị
Thiết bị Xuất xứ
Phòng thí nghiệm an toàn sinh học cấp 3 Viện Vệ sinh Dịch tễ Trung ương
Tủ an toàn sinh học cấp 2 Bioquell – Anh
Máy khuếch đại gen Biorad – Mỹ
Máy giải trình tự gen ABI3130 Hitachi – Nhật
Máy đọc tín hiệu huỳnh quang Perkin Elmer – Mỹ
Máy ly tâm Beckman Coulter – Mỹ
Votex IKA – Malaysia
Dụng cụ
Dụng cụ sử dụng trong các thí nghiệm bao gồm:
- Pipet vi lượng 10µl - 1000µl
- Đầu côn có lọc vô trùng 10µl - 1000µl
- Phiến nuôi cấy tế bào 25cm2, 75 cm2
- Phiến 96 giếng màu đen đáy phẳng
- Tuýp Eppendorf 1,5ml – 2ml Và các dụng cụ khác.
2.3.2. Kỹ thuật xét nghiệm
2.3.2.1. Phân lập vi rút Chuẩn bị
- Tế bào MDCK mọc đẹp thành một lớp trong tuýp nuôi cấy tế bào.
- Dung dịch phát triển gồm: D-MEM x10, Fetal Bovine Serum 7,5%, Penicillin 100 U/ml và Streptomycin 100 µg/ml , NaHCO3 và nước cất hai lần vô trùng.
- Dung dịch môi trường nuôi cấy vi rút gồm:D-MEM x10, Bovine serum albumine 2%, Penicillin 100 U/ml và Streptomycin 100 µg/ml , TPCK- treated trypsin và nước cất hai lần vô trùng.
Các vi rút cúm A/H1N1, A/H1N1pdm09 và A/H3N2 được phân lập tại PTN ATSH cấp 2, vi rút A/H5N1 được phân lập tại PTN ATSH cấp 3
Tiến hành
- Cho 250 µl bệnh phẩm vào phiến nuôi cấy có tế bào MDCK, ủ 60 phút tại nhiệt độ 33oC, thêm 1,5ml môi trường nuôi cấy, quan sát sự huỷ hoại tế bào (CPE) qua kính hiển vi lộn ngược trong vòng 1-2 tuần.
- Xác định típ và phân típ của chủng vi rút bằng phản ứng ức chế ngưng kết hồng cầu (HAI) có sử dụng các kháng huyết thanh chuẩn của tổ chức y tế thế giới.
![]()
- Phương pháp RT-PCR với các cặp mồi đặc hiệu được sử dụng thêm để xác định típ và phân típ của chủng vi rút cúm A
Bệnh phẩm dịch họng thu thập từ bệnh nhân
RT-PCR với các mồi đặc hiệu
Dương tính
Âm tính
Nuôi cấy trên tế bào MDCK
CPE âm tính
Giá trị HA ≤ 8
Giá trị HA ≥ 8
CPE dương tính
Cấy chuyển 3 lần, nếu CPE âm tính, bệnh phẩm âm tính
Định týp bằng phản ứng HAI
Kiểm tra lại bằng RT-PCR
Sơ đồ 2.1. Quá trình phân lập vi-rút cúm
2.3.2.2. Xác định mức độ kháng thuốc của vi rút cúm với oseltamivir Nguyên lý
Kỹ thuật xác định mức độ nhạy cảm với oseltamivir bao gồm 2 bước: xác định mức độ hoạt động của neuraminidase và xác định độ nhạy cảm của vi rút cúm với oseltamivir bằng phản ứng ức chế neuraminidase (NA). Kỹ thuật này dựa trên
nguyên lý hoạt động của NA. Dưới tác dụng của NA, axit sialic phân tách với nhóm đường, giải phóng vi rút cúm khỏi bề mặt tế bào cảm nhiễm. Do vậy, ức chế sự phân tách này sẽ cản trở quá trình giải phóng vi rút cúm, ngăn chặn sự phát tán của vi rút trong cơ thể. MUNANA [2’ 2’-(4-Methylumbelliferyl)-α-D-N- acetylneuraminic acid sodium salt hydrate] là chất nền huỳnh quang được sử dụng trong thử nghiệm xác định mức độ nhạy cảm với oseltamivir và mức độ hoạt động của neuraminidase của vi rút cúm. Trong phản ứng này, MUNANA sẽ bị phân tách bởi NA, giải phóng phân tử phát huỳnh quang 4-Methylumbelliferyl (4-MU) và được đọc bởi máy đọc tín hiệu huỳnh quang.
Xác định mức độ hoạt động của neuraminidase
Đây là bước xác định mức độ hoạt động của neuraminidase mà qua đó có thể xác định được mức phát quang chuẩn, từ đó có thể dựa vào để xác định độ pha loãng của vi rút trong phản ứng ức chế neuraminidase tiếp theo.
Chất nền MUNANA được đưa vào dung dịch chứa vi rút đã được pha loãng bậc hai bằng dung dịch đệm. Ủ hỗn hợp tại 37oC trong 60 phút, thêm chất dừng phản ứng, đọc bằng máy đọc tín hiệu huỳnh quang.
Kỹ thuật được thực hiện 3 lần trong cùng một thời điểm để hạn chế sai số.
Phản ứng ức chế neuraminidase
Độ nhạy cảm của vi rút cúm với oseltamivir được xác định bởi giá trị IC50 của vi rút. Giá trị thể hiện nồng độ oseltamivir mà tại đó ức chế được 50% vi rút cúm.
Oseltamivir được pha loãng theo các nồng độ từ 40000nM đến 0.04nM rồi cho vào dung dịch vi rút đã pha loãng dựa trên các giá trị thu được từ phản ứng xác định mức độ hoạt động neuraminidase nói trên, ủ 37oC/30 phút trong tủ ấm. Sau đó cho MUNANA vào hỗn dịch, ủ 37oC/60 phút trong tủ ấm. Đọc tín hiệu huỳnh quang trên máy VICTOR X2 trong vòng 20 phút sau khi dừng phản ứng (Sơ đồ 2.2).
Thí nghiệm được thực hiện 3 lần tại cùng một thời điểm để hạn chế sai số. Với các chủng A/H5N1 thí nghiệm sẽ được thực hiện tại phòng thí nghiệm an toàn sinh học (ATSH) cấp 3. Các chủng cúm A/H1N1, A/H1Npdm09 được thực hiện tại phòng thí nghiệm ATSH cấp 2.
Chủng cúm A phân típ H1N1, H1N1pdm09, H3N2 và H5N1
Xác định hoạt động của neuraminidase
Ủ 37oC/60 phút Dừng phản ứng
+ 50µl vi rút được pha loãng bậc hai bằng dung dịch đệm
+ 50µl dung dịch MUNANA
Đọc kêt quả tại bước sóng 355/460nm
Xác định độ pha loãng
của từng vi rút
Đọc kêt quả tại bước
sóng 355/460nm
Ủ 37oC/45 phút
+ 50µl dung dịch MUNANA
Ủ 37oC/60 phút Dừng phản ứng
+ 25µl vi rút đã được pha loãng bằng dung dịch đệm
+ 25µl oseltamivir pha loãng theo nồng độ 0- 40.000nM
Xác định giá trị IC50 bằng phần mềm JASPR