*Những thay đổi nhỏ trên phân đoạn gen mã hóa NA
Cũng giống protein HA, protein NA cũng có những thay đổi nhỏ xảy ra trong quá trình hoạt động. Các nghiên cứu đã chỉ ra sự thay đổi của axit amin xảy ra trên bề mặt của protein NA, nơi có các điểm gắn với axit sialic (vị trí 222, 329 và 344 trên gen N2) [92, 118]. Tương tự kháng nguyên bề mặt HA, kháng nguyên NA cũng có khả năng tạo kháng thể có tính bảo vệ. Các đột biến, thay đổi trên protein NA (đặc biệt tại khu vực bảo tồn) ảnh hưởng đến tính kháng nguyên của NA trong quá trình đáp ứng miễn dịch, vi rút cúm thay đổi để "tránh né" ảnh hưởng của kháng thể kháng NA, tạo nên một dòng kháng thể mới khác biệt so với dòng kháng thể thu được trước đây khi chưa xuất hiện đột biến [92]. Tuy nhiên, chỉ miễn dịch thu được khi tác dụng với phần bảo tồn của NA mới mang tính bảo vệ.
*Những thay đổi nhỏ trên gen M
Tìm hiểu về tiến hóa của gen M cho thấy M1 có sự thay đổi axit amin ở mức 26,4% và M2 có sự thay đổi 48,5% axit amin. Sự khác biệt này là do gen M2 chịu áp lực chọn lọc của kháng thể bảo vệ cao hơn M1. Tuy nhiên, sự thay đổi nhiều trên gen M2 chỉ quan sát thấy trên các vi rút cúm người và cúm lợn, hầu như không xảy ra với các chủng cúm gia cầm. Quan sát gen M1, hầu hết các thay đổi trên gen đều không dẫn đến thay đổi axit amin, ngoài ra, so sánh tần suất đột biến theo năm trên M1 và M2 và các gen còn lại của vi rút cho thấy tần suất này thấp hơn tần suất đột biến của gen còn lại, do vậy có thể coi gen M là gen có tính bảo tồn cao [29].
Những thay đổi lớn trên gen liên quan đến sự thay đổi về mặt kháng nguyên
Có thể bạn quan tâm!
-
 Tính kháng thuốc oseltamivir của virut cúm A lưu hành tại miền Bắc Việt Nam, 2001 – 2012 - 1
Tính kháng thuốc oseltamivir của virut cúm A lưu hành tại miền Bắc Việt Nam, 2001 – 2012 - 1 -
 Tính kháng thuốc oseltamivir của virut cúm A lưu hành tại miền Bắc Việt Nam, 2001 – 2012 - 2
Tính kháng thuốc oseltamivir của virut cúm A lưu hành tại miền Bắc Việt Nam, 2001 – 2012 - 2 -
 Thay Đổi Nhỏ Và Thay Đổi Lớn Trong Hệ Gen Của Vi Rút Cúm A
Thay Đổi Nhỏ Và Thay Đổi Lớn Trong Hệ Gen Của Vi Rút Cúm A -
 Tình Hình Kháng Thuốc Của Vi Rút Cúm A Với Thuốc Kháng Vi Rút
Tình Hình Kháng Thuốc Của Vi Rút Cúm A Với Thuốc Kháng Vi Rút -
 Kỹ Thuật Xác Định Mức Độ Kháng Oseltamivir Dựa Trên Hoạt Động Của Neuraminidase
Kỹ Thuật Xác Định Mức Độ Kháng Oseltamivir Dựa Trên Hoạt Động Của Neuraminidase -
 Xác Định Mức Độ Kháng Thuốc Của Vi Rút Cúm Với Oseltamivir Nguyên Lý
Xác Định Mức Độ Kháng Thuốc Của Vi Rút Cúm Với Oseltamivir Nguyên Lý
Xem toàn bộ 147 trang tài liệu này.
Những nghiên cứu trong phòng thí nghiệm so sánh các vi rút phân lập được từ những vụ dịch những năm 1918, 1947-1956, 1957-1967, 1968 cho thấy những vụ dịch này cùng có một nguyên nhân là cúm A phân típ H1N1 nhưng có sự biến đổi lớn về mặt di truyền học và đặc tính kháng nguyên (không có hoặc có kết quả phản ứng chéo với hiệu giá không cao khi thực hiện phản ứng ngăn ngưng kết hồng cầu giữa vi rút mới xuất hiện và các kháng thể tồn lưu tạo ra bởi các phân típ vi rút cũ).
Như vậy, tuy cùng mang tên một phân típ vi rút (H1N1) nhưng bản chất vi rút đã có sự thay đổi hoàn toàn, vì vậy các đáp ứng miễn dịch đặc hiệu sẽ không cho kết quả đáp ứng chéo bảo vệ giữa các phân típ vi rút cùng tên đã biết.
Hậu quả của sự xuất hiện vi rút mới mà không có kháng thể tồn lưu có khả năng chống lại trong quần thể, sẽ là nguyên nhân một đại dịch lan rộng trên toàn thế giới (đại dịch cúm 1918, 1977, 2009 với vi rút cúm A phân típ H1N1) [51, 70, 97, 98]. Việc xuất hiện các biến đổi lớn dẫn đến sự thay đổi hoàn toàn đặc tính kháng nguyên trên cả hai phân đoạn gen mã hóa HA và NA của vi rút cúm được giải thích bằng giả thuyết của sự trao đổi và tích hợp giữa các phân típ vi rút khác nhau.
1.1.4. Sự trao đổi và tích hợp trong hệ gen của vi rút cúm A
Các nhà khoa học đã chỉ ra rằng, với hệ gen phân đoạn như vậy, sự tái sắp xếp của vật liệu di truyền giữa các chủng vi rút cúm có khả năng xảy ra khi có sự đồng nhiễm hai hay nhiều vi rút cúm A phân típ khác nhau trên một vật chủ. Kết quả là sự tạo ra một loại vi rút mới có hệ gen là sự trộn và sắp xếp lại các phân đoạn gen của các vi rút cúm đồng nhiễm. Trên thực tế, khi phân tích gia hệ chủng vi rút cúm A/H1N1 lưu hành từ năm 1918 đến nay thấy rằng vi rút đã trải qua nhiều lần trao đổi và tích hợp gen của từng phân đoạn gen. Phân đoạn gen mã hóa PB1, NA và M xuất hiện từ đầu những 1940 vẫn lưu hành trong các vi rút của năm 1947, đặc biệt phân đoạn gen mã hóa HA của vi rút gây dịch năm 1947 hoàn toàn khác so với HA của các chủng vi rút lưu hành năm 1943-1945 [12, 30, 33]. Năm 2009, chủng H1N1 gây đại dịch có sự trao đổi và tích hợp giữa vi rút cúm người, cúm gia cầm và cúm lợn, trong đó các phân đoạn gen mã hóa HA, NP, NS được tích hợp từ chủng cúm lợn, NA, M từ chủng vi rút cúm lợn Á Âu, đặc biệt PA và PB2 là 2 gen có mức trao đổi tích hợp cấp ba (2 gen này là sự trao đổi của cả 3 chủng vi rút cúm từ người, gia cầm và lợn) [5, 27]. Chủng vi rút cúm này mang bộ gen có sự trao đổi vào tích hợp với bộ gen có nguồn gốc từ vi rút gây bệnh cho người nên chủng vi rút mới hoàn toàn có khả năng nhân lên tại các tế bào biểu mô đường hô hấp ở người và dễ dàng lan truyền trong quân thể người với phạm vi lớn. Tuy nhiên, các protein bề mặt của
vi rút mới khác biệt hoàn toàn với các chủng vi rút cúm gây bệnh cho người lưu hành trước đó và vật chủ không được bảo vệ bởi các kháng thể tồn lưu. Vi rút cúm mới xuất hiện H7N9 cũng mang hệ gen có sự trao đổi và tích hợp cao, trong đó phân đoạn gen mã hóa HA tương tự gen H7 của gia cầm, phân đoạn gen mã hóa NA tương tự N9 của vi rút A/H11N9, các gen còn lại tương tự vi rút A/H9N2 [63]. Ngoài ra, qua sự trao đổi và tích hợp này, vi rút cúm mới có thể mang gen kháng thuốc từ chủng vi rút cúm khác, điển hình là gen M mang đột biến kháng amantadine của vi rút H1N1pdm09 và phân đoạn gen mã hóa NA mang đột biến kháng oseltamivir của vi rút H7N9 [30, 63]. Như vậy, chủng vi rút mới sẽ có thể là căn nguyên của đại dịch lan rộng toàn cầu, đe doạ sự an toàn của các quốc gia và sức khoẻ của người dân trên toàn thế giới [33, 34].
1.1.5. Khả năng gây bệnh của vi rút cúm
Cúm là một bệnh nhiễm trùng đường hô hấp cấp tính do vi rút cúm gây ra. Đường lây truyền chủ yếu của vi rút cúm có thể qua giọt nước bọt nhỏ mang vi rút tung ra khi người bệnh tiếp xúc trực tiếp với người lành. Thời gian ủ bệnh trung bình là 2 ngày, thường kéo dài từ 1 đến 4 ngày [43], sau đó bệnh nhân biểu hiện các triệu chứng như: sốt, mệt mỏi, đau mỏi cơ chủ yếu vùng lưng và các triệu chứng chảy mũi, chảy nước mắt…. Bệnh nhân có thể hết sốt sau 5 đến 7 ngày kèm theo mệt mỏi và ho, sau khoảng 10 ngày thì hồi phục nếu không có biến chứng bội nhiễm [4].
Từ đầu thế kỷ XX đến nay, thế giới ghi nhận 4 đại dịch cúm, khởi đầu tại Tây Ban Nha năm 1918-1919 do vi rút cúm A/H1N1 gây nên là một trong những dịch cúm gây tỉ lệ tử vong cao, ước tính có khoảng 40 triệu người đã chết do nhiễm cúm [43]. Dịch cúm châu Á năm 1957-1958 có nguồn gốc từ Singapore do vi rút cúm A/H2N2 gây nên với khoảng 69.800 trường hợp tử vong. Dịch cúm xảy ra năm 1968-1969 tại Hồng Kông do vi rút cúm A/H3N2 gây nên [84]. Dịch cúm A/H1N1pdm09 xảy ra năm 2009 khởi đầu tại Mexico, sau đó nhanh chóng lan sang Hoa Kỳ, Canada, châu Âu và châu Á. Cuối tháng 5 năm 2009, Việt Nam ghi nhận
ca mắc cúm A/H1N1 đại dịch đầu tiên. Số ca mắc bệnh tăng nhanh, đến tháng 12 năm 2009 đã có hơn mười nghìn mẫu bệnh phẩm nghi nhiễm cúm A/H1N1pdm09 được gửi đến PTN cúm, viện Vệ sinh Dịch tễ Trung ương [2]. Dịch cúm gia cầm đầu tiên xuất hiện tại Hồng Kong 1997-2002 gây ra bởi vi rút cúm A phân típ H5N1. Vi rút lây từ gia cầm sang người, tử vong 6/18 trường hợp mắc [95]. Năm 2003, dịch cúm gia cầm đã xuất hiện tại Việt Nam, tính đến nay đã có 125 trường hợp được khẳng định nhiễm cúm A/H5N1, có 62 trường hợp tử vong [115]. Tháng 3 năm 2013, tổ chức Y tế Thế (TCYTTG) giới nhận được thông báo các trường hợp nhiễm cúm A/H7N9 đầu tiên tại Trung Quốc, vi rút được xác định lây từ gia cầm sang người với tổng số người nhiễm là 133 và số tử vong là 34 [116].
Dựa vào các số liệu giám sát tại phòng thí nghiệm từ năm 2001 và chương trình giám sát cúm quốc gia tại Việt Nam (viện Vệ sinh Dịch tễ Trung ương phối hợp với US-CDC từ năm 2006), bệnh cúm ở Việt Nam xuất hiện quanh năm, có hai đỉnh rõ rệt vào mùa đông xuân với sự lưu hành của vi rút cúm B (tháng 2 – tháng 3) và mùa hạ với sự lưu hành của các chủng thuộc phân típ cúm A (tháng 7 – tháng 8) [5].
1.1.6. Tiến hóa của vi rút cúm A
Sự tiến hóa của vi rút cúm được ghi nhận đầu tiên là sự tiến hóa về di truyền học với những thay đổi nhỏ, thay đổi lớn trên gen. Những thay đổi nhỏ xảy ra thường xuyên có thể không tạo sự thay đổi về kháng nguyên nhưng tạo nên sự đa dạng trong kiểu gen của các chủng vi rút cúm. Những thay đổi lớn gây ảnh hưởng đến tính kháng nguyên, tuy xảy ra với tần suất thấp, nhưng là sự thay đổi quan trọng trong tiến hóa của vi rút cúm. Điểm đặc trưng trong tiến hóa của vi rút cúm là sự trao đổi và tích hợp các phân đoạn gen để tạo ra phân típ vi rút cúm mới. Hiệu ứng của sự tiến hóa này là sự thay đổi đặc tính kháng nguyên, sự thay đổi vật chủ, sự tăng độc lực, tăng khả năng lây truyền, kháng thuốc….
Sự tiến hóa của vi rút cúm A được khẳng định là sự tiến hóa thích nghi, chỉ xảy ra rải rác trong quần thể vi rút cúm, dưới ảnh hưởng của một số hiện tượng như:
cùng đồng nhiễm trên một vật chủ, hoặc xuất hiện của một biến thể vi rút từ nơi khác [83]. Hai phân đoạn gen mã hóa cho glycoprotein bề mặt HA và NA chịu áp lực lớn từ khả năng trung hòa của kháng thể sinh ra trong quá trình nhiễm bệnh. Các phân đoạn gen còn lại tuy không chịu áp lực chọn lọc từ đáp ứng miễn dịch nhưng lại được cho rằng chúng đã phải trải qua quá trình chọn lọc để thích nghi với từng loài vật chủ trong đó điển hình là phân đoạn gen mã hóa PB2 [57].
Tác động của con người lên sự tiến hóa của vi rút cúm A chưa được đánh giá một cách rõ ràng nhưng những hoạt động như sử dụng gia cầm, tiêm văc xin hay sử dụng thuốc kháng vi rút cũng có khả năng ảnh hưởng đến sự tiến hóa. Ngoài ra, với việc sử dụng thuốc kháng vi rút, hiện tượng kháng thuốc đã xuất hiện, như vậy, vi rút đã bắt đầu thay đổi để thích nghi với môi trường và những thay đổi này sẽ là những bước tiến hóa tiếp theo của vi rút cúm.
1.2. Phòng và điều trị vi rút cúm A
1.2.1. Văc xin phòng cúm
Văc xin phòng bệnh cúm bắt đầu được áp dụng từ năm 1945 với mục tiêu giảm tỉ lệ mắc cúm, giảm gánh nặng bệnh tật do vi rút cúm gây nên. Các loại văc xin đưa vào sử dụng được sản xuất trên trứng gà có phôi với kháng nguyên gồm hai chủng A (một chủng A/H3N2 và một chủng A/H1N1pdm09) và một chủng cúm B, được lựa chọn từ hơn 100 trung tâm cúm quốc gia từ hơn 80 quốc gia trên thế giới. Sự lựa chọn các chủng vi rút được TCYTTG thực hiện vào tháng Hai hàng năm với các nước ở Bắc Bán cầu, tháng Chín hàng năm với các nước ở Nam Bán cầu [117]. Để đạt được hiệu quả trong phòng bệnh, văc xin phải được tiêm chủng trong cộng đồng hàng năm, do khả năng biến đổi nhanh của vi rút trên phân đoạn gen mã hóa HA và NA. Tuy nhiên, tại Việt Nam, văc xin phòng cúm chưa được sử dụng rộng rãi trong toàn bộ quần thể dân cư, do đó hiệu quả phòng bệnh còn hạn chế.
Các loại văc xin
Văc xin bất hoạt
Loại văc xin này được sản xuất từ các chủng vi rút nuôi trong túi niệu của trứng gà có phôi sau đó bị bất hoạt bởi formandehyde hoặc β-propiolacton rồi tinh sạch bằng siêu ly tâm. Loại văc xin này bao gồm văc xin toàn phần và văc xin bán phần. Văc xin toàn phần an toàn và có khả năng dung nạp tốt với hiệu lực bảo vệ ở người lớn và trẻ em là 60-90%. Văc xin bán phần chỉ gồm hai thành phần là protein HA và NA, các thành phần khác của vi rút đã được loại bỏ. Loại văc xin này gây ít phản ứng phụ tuy nhiên có ý kiến cho rằng văc xin kém hiệu quả trong trường hợp có sự lưu hành của chủng vi rút mới [50].
Văc xin sống giảm độc
Văc xin này được áp dụng nhằm mục đích tăng cường đáp ứng miễn dịch dịch thể và miễn dịch tại chỗ (tại đường hô hấp) của cơ thể đối với vi rút cúm. Khác với văc xin bất hoạt, thành phần của văc xin sống giảm độc là các chủng vi rút được thích ứng ở điều kiện nhiệt độ thấp hơn nhiệt độ cơ thể (25oC) để khi được đưa vào qua đường mũi với nhiệt độ cơ thể các vi rút sẽ bị bất hoạt nhằm kích thích sinh
kháng thể ngay tại đường hô hấp trên và đường hô hấp dưới đồng thời cũng tăng cường đáp ứng miễn dịch tế bào. Loại văc xin này đã được đưa vào sử dụng tại Mỹ vào năm 2003 và những năm trước đây tại Liên Xô cũ với độ an toàn khá cao [50].
Các loại văc xin thế hệ mới
Việc sản xuất văc xin có thành phần là các vi rút cúm được nuôi cấy trên tế bào MDCK (Madin-Darby Canine Kidney) hoặc tế bào Vero có khả năng thay thế văc xin sản xuất trên trứng gà có phôi đang được các nhà sản xuất văc xin quan tâm không chỉ vì khả năng tăng năng suất mà còn bởi tác dụng phụ của loại văc xin này được hi vọng là thấp hơn loại văc xin đang sử dụng hiện tại.
Văc xin được sản xuất dựa trên ứng dụng công nghệ gen (văc xin sử dụng công nghệ di truyền ngược, văc xin DNA, văc xin protein) cũng đang được nghiên cứu với hi vọng được áp dụng rộng rãi trong tương lai.
Văc xin được sản xuất dựa trên sự thay đổi về cấu trúc gen của vi rút làm giảm khả năng nhân lên (gen M2 và NS2 bị loại bỏ) và mất khả năng tổng hợp chất ức chế interferon của tế bào (loại bỏ gen NS1) có khả năng gây đáp ứng miễn dịch, không theo quy trình sản xuất văc xin hiện tại [50].
1.2.2. Thuốc điều trị vi rút cúm A
Các thuốc kháng vi rút dòng ức chế sự xâm nhập vào tế bào cảm nhiễm
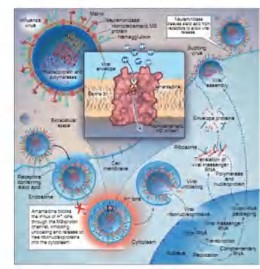
Amantadine và rimantadine là các dẫn chất của adamantane, được sử dụng từ những năm 60 của thế kỷ trước (Hình 1.6). Cơ chế tác dụng của các chất này là ức chế kênh trao đổi ion M2 xuyên màng của vi rút cúm A, ion H+ không thể đi vào bên trong vi rút, pH trong vi rút không thay đổi, hạn chế quá trình hòa màng của vi rút với tế bào chủ , ngăn cản quá trình vi rút "cởi áo" để xâm nhập vào bên trong tế
bào chủ (Hình 1.6). Amatadine có hiệu quả điều trị chống lại tất cả các phân típ cúm A gây bệnh cho người trước đây (H1N1, H2N2, H3N2) nhưng không chống lại được vi rút cúm B do protein M2 chỉ có ở vi rút cúm A [31]. Hiện tượng kháng thuốc thường xảy ra với các chủng cúm A/H3N2 do xuất hiện các điểm đột biến trên gen M (phần M2) dẫn đến thay đổi các axit amin tại năm vị trí 26, 27, 30, 31 và 34, làm thay đổi vị trí tương tác của amantadine với M2. Trong đó, vị trí 31 thay đổi từ Serin (Ser-S) sang Arginine (Asn-N) là vị trí thường gặp ở các chủng vi rút trong các nghiên cứu trên thế giới [9, 42, 89].
Hình 1.6. Cấu trúc và cơ chế tác dụng của amantadine và rimantadine (Nguồn: http://umanitoba.ca và Drugs discovery approaches – Wiley 2007)
Các thuốc kháng vi rút dòng ức chế neuraminidase
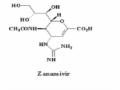
Oseltamivir và zanamivir là hai chất ức chế chọn lọc trên enzyme bề mặt neuraminidase của vi rút cúm (Hình 1.7). Neuraminidase phân cắt axit sialic trên bề mặt tế bào chủ khỏi glycoprotein HA của hạt vi rút mới nảy chồi tại cầu nối đặc hiệu α 2,3Gal-sialic hoặc α2,6 Gal-sialic. Do vậy, neuraminidase giúp giải phóng hạt vi rút, tạo điều kiện cho hạt vi rút mới có khả năng xâm nhập vào tế bào biểu mô khác, tăng cường sự phát tán của vi rút. Ức chế quá trình này, vi rút chỉ có khả năng nhiễm và nhân lên trong tế bào nhiễm nhưng không thể phát tán xâm nhập các tế bào lành khác, ngăn chặn khả năng gây bệnh của vi rút (Hình 1.8).
Neuraminidase là enzyme trên bề mặt vi rút có tính chất khá bảo tồn ở các chủng vi rút cúm, các nhà khoa học dự đoán khả năng xảy ra sự kháng thuốc của vi rút đối với oseltamivir thấp hơn amantadine [21]. Tuy nhiên, gần đây đã có những nghiên cứu trong nước và trên thế giới chỉ ra sự xuất hiện của những chủng vi rút kháng lại oseltamivir chủ yếu trên phân típ A/H1N1 và đặc biệt một chủng vi rút cúm gia cầm