Việc lựa chọn enzyme thích hợp để thiết kế mồi và phân tích sản phẩm PCR không dễ, đặc biệt với các đột biến trên protein neuraminidase (NA) khi bản chất của protein này cũng là một enzyme, vì vậy hiện tượng cắt tại các vị trí không mong muốn (dương tình giả) , hoặc không tạo sản phẩm PCR tương thích... là các vấn đề hay gặp, ảnh hưởng tới độ tin cậy của phương pháp, cần sử dụng kỹ thuật giải trình tự gen để xác định lại kết quả.
Kỹ thuật giải trình tự đoạn gen ngắn thực hiện với từng nucleotide xác định (pyro- sequencing)
Pyrosequencing là kỹ thuật giải trình tự gen thế hệ mới, được ứng dụng lần đầu tiên năm 1996 tại Thụy Điển, đến năm 2001 phương pháp bắt đầu được áp dụng trên thế giới. Pyrosequencing đáp ứng được yêu cầu muốn xác định trình tự gen cho một đoạn DNA nhỏ và có thể thực hiện với số lượng mẫu lớn trong thời gian ngắn. Mục tiêu chính của phương pháp là xác định các điểm đột biến, ngoài ra có thể sử dụng phương pháp này trong định típ vi sinh vật và được coi là một phương pháp xét nghiệm khẳng định kết quả [88]
*Ưu điểm
Kỹ thuật này mang ưu điểm có thể rút ngắn thời gian giải trình tự khi so sánh với giải trình tự thông thường, có thể áp dụng cho nhiều loại mẫu khác nhau như bệnh phẩm lâm sàng, vi rút đã nuôi cấy và có thể thực hiện với số lượng bệnh phẩm lâm sàng lớn, phù hợp với tính chất giám sát học [25, 26]. Ngoài ra, phương pháp này còn được ứng dụng trong việc định loại vi sinh vật (tuy không thông dụng) và xác định cá thể mang gen dị hợp, hỗ trợ cho quá trình chẩn đoán trong phòng thí nghiệm [10, 88]
*Nhược điểm
Có thể bạn quan tâm!
-
 Thay Đổi Nhỏ Và Thay Đổi Lớn Trong Hệ Gen Của Vi Rút Cúm A
Thay Đổi Nhỏ Và Thay Đổi Lớn Trong Hệ Gen Của Vi Rút Cúm A -
 Sự Trao Đổi Và Tích Hợp Trong Hệ Gen Của Vi Rút Cúm A
Sự Trao Đổi Và Tích Hợp Trong Hệ Gen Của Vi Rút Cúm A -
 Tình Hình Kháng Thuốc Của Vi Rút Cúm A Với Thuốc Kháng Vi Rút
Tình Hình Kháng Thuốc Của Vi Rút Cúm A Với Thuốc Kháng Vi Rút -
 Xác Định Mức Độ Kháng Thuốc Của Vi Rút Cúm Với Oseltamivir Nguyên Lý
Xác Định Mức Độ Kháng Thuốc Của Vi Rút Cúm Với Oseltamivir Nguyên Lý -
 Giải Trình Tự Gen Sử Dụng Phương Pháp Thông Thường (Sanger) Nguyên Lý
Giải Trình Tự Gen Sử Dụng Phương Pháp Thông Thường (Sanger) Nguyên Lý -
 Xác Định Giá Trị Ic50 Ngưỡng Của Các Phân Típ Vi Rút Cúm A
Xác Định Giá Trị Ic50 Ngưỡng Của Các Phân Típ Vi Rút Cúm A
Xem toàn bộ 147 trang tài liệu này.
Pyrosequencing có nhược điểm là chỉ thực hiện trên đoạn DNA ngắn và phát hiện được các đột biến được chỉ định, nên phạm vi ứng dụng còn hạn chế và chỉ tập

trung vào các nghiên cứu, giám sát cụ thể [25, 88]. Việc phát hiện đột biến liên quan đến kháng oseltamivir bằng phương pháp pyrosequencing chỉ cho phép nhận diện sơ bộ khả năng kháng thuốc của vi rút, các xét nghiệm tiếp theo để khẳng định khả năng, mức độ kháng thuốc cần được bổ sung.
Kỹ thuật realtime RT-PCR
Nhằm mục đích có thể phát hiện nhanh vi rút mang gen đột biến trên số lượng bệnh phẩm lớn, kỹ thuật realtime RT-PCR được phát triển và áp dụng. Kỹ thuật này được đưa vào thử nghiệm lần đầu tiên năm 2008 [16] với ứng dụng ban đầu là tìm điểm đột biến H275Y trên phân đoạn gen mã hóa NA của vi rút cúm A/H1N1. Từ năm 2012, tổ chức Y tế Thế giới khuyến cáo có thể sử dụng kỹ thuật realtime RT-PCR để xác định ban đầu bệnh phẩm nhiễm cúm nghi ngờ có mang gen kháng thuốc.
*Ưu điểm
Kỹ thuật này có thể áp dụng cho bệnh phẩm lâm sàng, có thể thực hiện với số lượng bệnh phẩm lớn, cho kết quả sàng lọc sớm trong vòng 3 giờ [16, 35]. Hơn nữa, realtime RT-PCR có giá thành thấp hơn so với giải trình tự gen cổ điển và pyrosequencing, do đó có thể sử dụng như một biện pháp sàng lọc bệnh phẩm mang vi rút kháng thuốc góp phần phát hiện sớm những trường hợp kháng thuốc trong cộng đồng.
*Nhược điểm
Với kỹ thuật này, đột biến liên quan đến kháng thuốc chỉ được xác định tại một điểm nhất định (H275Y) trên phân đoạn gen mã hóa NA trong đó với kỹ thuật giải trình tự gen cổ điển có thể phát hiện đột biến trên toàn bộ đoạn gen.
1.4.3. Kỹ thuật xác định mức độ kháng oseltamivir dựa trên hoạt động của neuraminidase
Đây là quá trình cần thiết để xác định mức độ kháng oseltamivir của vi rút cúm đươc thực hiện dựa trên nguyên lý hoạt động của neuraminidase chứng minh cho việc phát hiện đột biến liên quan đến kháng thuốc trên gen là chính xác. Kỹ thuật bao gồm hai bước chính: xác định hoạt động của neuraminidase và xác định mức độ kháng thuốc oseltamivir hoặc zanamivir.
Xác định hoạt động của neuraminidase
Mục đích của việc xác định hoạt động của neuraminidase là đánh giá hoạt động của enzyme trong quá trình nhân lên của vi rút và chuẩn hóa nồng độ vi rút trước khi thực hiện việc xác định mức độ kháng thuốc của vi rút.
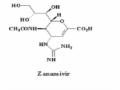
Xác định mức độ kháng oseltamivir/zanamivir
*Dựa trên hoạt động của neuraminidase với chất phát quang có nguồn gốc hóa học
Việc nhận định mức độ kháng thuốc oseltamivir/zanamivir của vi rút cúm dựa vào sự phát quang của chất có nguồn gốc hóa học (chemiluminesence). Kết quả thu được từ kỹ thuật này được đánh giá có đủ độ tin cậy và được sử dụng tại nhiều phòng thí nghiệm (PTN) chuẩn thức trên thế giới như PTN tại trung tâm kiểm soát bệnh dịch Hoa Kỳ (US-CDC), PTN tại Viện các bệnh truyền nhiễm quốc gia Nhật Bản (NIID) [73, 104]. Các bộ kit xác định mức độ kháng thuốc có chất phát quang có nguồn gốc quang học được Tổ chức Y tế Thế giới khuyến cáo sử dụng là NA- Star và NA-XTD hãng Applied Biosystem, Mỹ [111].
Ưu điểm
Đây là kỹ thuật xác định mức độ kháng thuốc có độ nhạy cao, có thể sử dụng với các vi rút có nồng độ thấp, cùng một lúc có thể thử nghiệm với nhiều loại thuốc khác nhau và là kỹ thuật hỗ trợ khẳng định sự kháng thuốc của vi rút cúm.
Nhược điểm
Do có độ nhạy cao nên kỹ thuật không nhận định được rõ ràng kết quả nếu mẫu thử nghiệm là vi rút không đột biến hoàn toàn . Hơn nữa, để sử dụng hiệu quả cần phương tiện hỗ trợ đặc biệt (bộ phận chứa phiến 96 giếng, bộ phận chia dung dịch dừng phản ứng tự động gắn liền với máy) cho máy đọc kết quả do chất phát sáng có nguồn gốc hóa học này dễ bị phân hủy khi gặp ánh sáng và giá thành tương đối cao so với kỹ thuật xác định mức độ kháng oseltamivir dựa trên hoạt động của neuraminidase với chất phát huỳnh quang.
*Dựa trên hoạt động của neuraminidase với chất phát quang là huỳnh quang
Đây là kỹ thuật xác định độ nhạy cảm của neuraminidase với thuốc ức chế hoạt động của enzyme (oseltamivir, zanamivir...) có sử dụng chất huỳnh quang trong thành phần của phản ứng. Kết quả của thử nghiệm xác định được nồng độ thuốc ức chế 50% hoạt động của vi rút. Kỹ thuật này được sử dụng rộng rãi trong các PTN do khả năng ứng dụng linh hoạt trong sử dụng hóa chất sinh phẩm và được tổ chức y tế thế giới khuyến cáo sử dụng xác định mức độ kháng thuốc của các chủng vi rút [111].
Ưu điểm
Ưu điểm của kỹ thuật là thời gian tiến hành nhanh, kết quả có thể phân định được rõ ràng chủng nhạy cảm và chủng kháng thuốc [14]. Ngoài ra, không giống kỹ thuật NAI dựa vào sự phát quang của chất có nguồn gốc hóa học đề cập ở trên, kỹ thuật này cho phép sử dụng sinh phẩm là bộ kit thương mại, NA Fluor kit, Applied Biosystem hoặc các hóa chất sinh phẩm có sẵn tại phòng thí nghiệm sử dụng chất phát quang MUNANA của hãng Sigma.
Nhược điểm
Độ nhạy của kỹ thuật không được đánh giá cao như kỹ thuật xác định mức độ
kháng oseltamivir/zanamivir dựa trên hoạt động của neuraminidase với chất phát
quang có nguồn gốc hóa học [111]. Do đó, để khẳng định lại những chủng vi rút nghi ngờ về khả năng kháng thuốc, cần sử dụng kỹ thuật NAI sử dụng chất phát quang có nguồn gốc hóa học.
1.4.4. Giám sát sự kháng thuốc vi rút cúm
Quá trình giám sát kháng thuốc của vi rút cúm đã được thực hiện tại các nước phát triển ở châu Âu và châu Mỹ. Các trường hợp nghi ngờ có liên quan đến kháng thuốc đều được kiểm tra kỹ lưỡng và ghi nhận. Hiện nay, tại Việt Nam phòng thí nghiệm cúm đang tiến hành triển khai giám sát sự kháng thuốc của vi rút cúm dựa trên giám sát sự thay đổi trên phân đoạn gen mã hóa NA của vi rút với sự giúp đỡ của TCYTTG. Giám sát được sự kháng thuốc của vi rút cúm góp phần tăng cường năng lực đáp ứng với sự xuất hiện của đại dịch cúm trong tương lai, chủ động trong quá trình phòng và điều trị bệnh cúm trong đó việc sử dụng thuốc đóng vai trò quan trọng.
Xây dựng quy trình giám sát sự kháng thuốc của vi rút cúm
Tại Việt Nam, ba trong số các kỹ thuật xét nghiệm trình bày ở phần trên đã được thực hiện tại phòng thí nghiệm cúm viện Vệ sinh Dịch tễ trung ương là giải trình tự gen, realtime RT-PCR và xác định mức độ kháng thuốc bằng chất màu huỳnh quang. Hiện tại, các phương pháp đều đã được xây dựng quy trình chuẩn (SOP) nhằm tạo tiền đề cho việc thực hiện xét nghiệm giám sát thường xuyên sự kháng thuốc của vi rút cúm tại phòng thí nghiệm.
Chiến lược thực hiện giám sát sự kháng thuốc của vi rút cúm tại phòng thí nghiệm
Giám sát vi rút cúm kháng thuốc tại Việt Nam được bắt đầu từ những năm 2005, tuy nhiên cũng chỉ dừng lại ở những trường hợp đơn lẻ của vi rút cúm A/H1N1, A/H5N1. Những kết quả tìm hiểu sự kháng thuốc của vi rút cúm thu được từ đại dịch cúm A/H1N1pdm09 là tiền đề để phát triển chương trình giám sát kháng thuốc trong tương lai.
Giám sát sự kháng thuốc của vi rút bao gồm sự giám sát sự thay đổi, đột biến liên quan đến kháng thuốc, trên gen của vi rút và sự thay đổi trên kiểu hình tương ứng với kiểu gen. Tại Viện các bệnh truyền nhiễm (NIID)-Nhật Bản, khoảng 5-10% chủng vi rút được lựa chọn ngẫu nhiên để xét nghiệm xác định mức độ kháng thuốc của vi rút [69] bằng phương pháp ức chế neuraminidase. Sự thay đổi trên kiểu gen có thể được giám sát qua phương pháp giải trình tự gen cổ điển (Sanger sequence) trên các vi rút đã được xác định mức độ kháng thuốc. Các trường hợp nghi ngờ có biểu hiện kháng thuốc nhưng chưa xác định được mức độ kháng thuốc có thể áp dụng phương pháp giải trình tự pyrosequencing thực hiện trên bệnh phẩm lâm sàng [25, 36, 104]. Quy trình giám sát vi rút cúm kháng thuốc được tổ chức giám sát sự kháng thuốc của vi rút cúm (ISIRV) khuyến cáo thực hiện bao gồm quá trình xác định biểu hiện kháng thuốc của các chủng vi rút thông qua kỹ thuật NAI với cơ chất huỳnh quang, sau đó các chủng có biểu hiện kháng thuốc sẽ được xác định vị trí đột biến liên quan đến kháng thuốc trên gen NA bằng các phương pháp như giải trình tự gen thông thường hoặc realtime RT-PCR. Quy trình này hiện nay đang được áp dụng tại các phòng thí nghiệm tham chiếu của TCYTTG tại CDC-Altanta, Melbourne và NIID-Nhật Bản.
Những kết quả có thể thu được khi thực hiện giám sát sự kháng thuốc của vi rút cúm
Sự kháng thuốc của vi rút nếu được phát hiện sớm tại các bệnh viện sẽ tạo điều kiện cho bác sĩ lâm sàng thay đổi phác đồ điều trị phù hợp, rút ngắn thời gian nằm viện của bệnh nhân. Hơn nữa, việc phát hiện sớm rất có ý nghĩa trong công tác phòng chống dịch khi các trường hợp kháng thuốc được xác định trong thời điểm bùng phát dịch, đặc biệt với các trường hợp là nhóm ca bệnh có liên quan đến kháng thuốc, từ đó có thể áp dụng các biện pháp can thiệp phòng chống vi rút mang gen kháng thuốc lan truyền trong quần thể.
Mỗi vi rút mang gen kháng thuốc có biểu hiện về mức kháng thuốc khác nhau, mức kháng thuốc tăng cao đặc biệt ở vi rút mang đồng thời cả hai loại đột biến liên
quan đến kháng thuốc [38, 74], do vậy, giám sát kháng thuốc để tăng cường khả năng phát hiện và theo dõi được tình trạng kháng thuốc của vi rút và sự tương tác của vi rút với môi trường.
Xu hướng lưu hành vi rút cúm tại Việt Nam khác với các nước ở vùng khí hậu hàn đới, nơi có mùa cúm rõ ràng, khi có hai đỉnh dịch cúm B vào tháng 2-3 và cúm A vào tháng 7-8 [1] . Nghiên cứu về đặc điểm kháng nguyên của vi rút cúm cho thấy dường như vi rút cúm lưu hành tại Việt Nam có đặc điểm gần giống với các chủng vi rút cúm lưu hành tại Nam bán cầu [106]. Do đó với các chủng mang đột biến kháng thuốc sẽ được giám sát sự tiến hóa trong quá trình tiến hóa chung của vi rút cúm, từ đó có thể xác định được kiểu gen và kiểu hình đặc thù của vi rút cúm lưu hành tại Việt Nam.
CHƯƠNG II - ĐỐI TƯỢNG, VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng nghiên cứu
Các chủng cúm A bao gồm các phân típ A/H1N1, A/H1N1pdm09, A/H3N2 và A/H5N1 phân lập được tại PTN Cúm, viện Vệ sinh Dịch tễ Trung ương từ năm 2001 đến 2012 từ các nguồn sau:
- Giám sát phòng thí nghiệm 2001 – 2005: Vi rút phân lập từ các bệnh nhân có hội chứng cúm theo giám sát của phòng thí nghiệm (sốt trên 38oC, ho và/hoặc đau họng)
- Chương trình giám sát cúm quốc gia 2006 – 2012: Vi rút phân lập từ các bệnh nhân có hội chứng cúm trong chương trình giám sát cúm Quốc gia phối hợp với US-CDC với tiêu chuẩn: sốt trên 38oC, ho và hoặc đau họng và không có chẩn đoán nào khác.
- Giám sát viêm phổi nặng 2003 – 2012 (vi rút A/H5N1): Vi rút phân lập từ các bệnh nhân viêm phổi nặng khi có đầy đủ triệu chứng của hội chứng cúm kèm theo khó thở, có chỉ định áp dụng hỗ trợ hô hấp, hình ảnh X-quang phổi có tổn thương đặc hiệu cho viêm phổi do vi rút và không hướng đến căn nguyên nào khác ngoải vi rút.
Các chủng cúm A được thu thập tại các tỉnh phía Bắc gồm Lạng Sơn, Hòa Bình, Hà Nội, Hà Nam, Nam Định, Bắc Ninh, Ninh Bình, Hưng Yên, Thái Bình và Thanh Hóa.
2.2. Phương pháp nghiên cứu
Toàn bộ các vi rút cúm mùa A/H1N1, A/H1N1pdm09, A/H3N2 và A/H5N1 sau khi phân lập được xác định mức độ kháng thuốc bằng phương pháp ức chế neuraminidase, các vi rút có biểu hiện giảm độ nhạy cảm với oseltamivir sẽ được giải trình tự phân đoạn gen mã hóa NA để xác định điểm đột biến liên quan đến