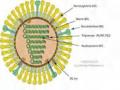
A/H5N1 có nguồn gốc từ Việt Nam đã có biểu hiện kháng thuốc [8, 11, 26, 31]. Trong thời gian diễn ra đại dịch cúm A/H1N1pdm09, đã ghi nhận các trường hợp kháng oseltamivir [30]. Hiện tượng kháng thuốc xảy ra có liên quan đến sự thay đổi axit amin tại vùng tiếp xúc của neuraminidase và thuốc điều trị (oseltamivir) , cụ thể là các vị trí E119V, R292K, H275Y và R152K trên phân đoạn gen mã hóa NA [11, 13, 26, 36, 55, 58, 59]. Sự đột biến tại các vị trí này làm giảm hiệu quả tương tác giữa thuốc và neuraminidase. Các nghiên cứu trong phòng thí nghiệm gần đây cho thấy zanamivir dường như vẫn có tác dụng với các chủng đã kháng với oseltamivir [19]. Các số liệu cho thấy đột biến tại hai điểm trên phân đoạn gen mã hóa NA liên quan đến kháng oseltamivir (H275Y và I223R trên phân đoạn gen mã hóa NA của chủng vi rút A/H1N1pdm09) làm cho mức độ kháng thuốc của vi rút tăng gấp 1000 lần so với chủng vi rút nhạy cảm [40]. Các phương pháp xác định nồng độ oseltamivir bị kháng bởi vi rút đã và đang được tiến hành với mục đích xác định chính xác mức độ kháng của vi rút với thuốc [40, 41].
![]()
![]()
Hình 1.7. Cấu trúc của oseltamivir và zanamivir (Nguồn: http://umanitoba.ca )
Có thể bạn quan tâm!
-
 Tính kháng thuốc oseltamivir của virut cúm A lưu hành tại miền Bắc Việt Nam, 2001 – 2012 - 2
Tính kháng thuốc oseltamivir của virut cúm A lưu hành tại miền Bắc Việt Nam, 2001 – 2012 - 2 -
 Thay Đổi Nhỏ Và Thay Đổi Lớn Trong Hệ Gen Của Vi Rút Cúm A
Thay Đổi Nhỏ Và Thay Đổi Lớn Trong Hệ Gen Của Vi Rút Cúm A -
 Sự Trao Đổi Và Tích Hợp Trong Hệ Gen Của Vi Rút Cúm A
Sự Trao Đổi Và Tích Hợp Trong Hệ Gen Của Vi Rút Cúm A -
 Kỹ Thuật Xác Định Mức Độ Kháng Oseltamivir Dựa Trên Hoạt Động Của Neuraminidase
Kỹ Thuật Xác Định Mức Độ Kháng Oseltamivir Dựa Trên Hoạt Động Của Neuraminidase -
 Xác Định Mức Độ Kháng Thuốc Của Vi Rút Cúm Với Oseltamivir Nguyên Lý
Xác Định Mức Độ Kháng Thuốc Của Vi Rút Cúm Với Oseltamivir Nguyên Lý -
 Giải Trình Tự Gen Sử Dụng Phương Pháp Thông Thường (Sanger) Nguyên Lý
Giải Trình Tự Gen Sử Dụng Phương Pháp Thông Thường (Sanger) Nguyên Lý
Xem toàn bộ 147 trang tài liệu này.
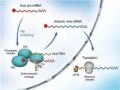
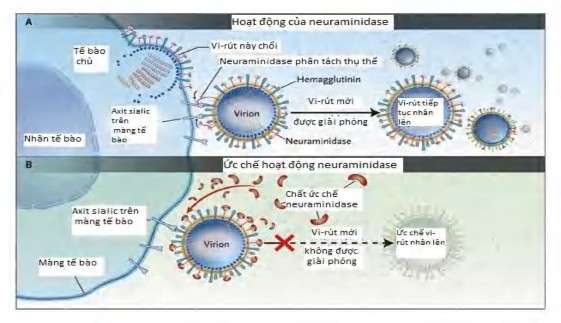
Hình 1.8. Cơ chế hoạt động của neuraminidase và chất ức chế neuraminidase trong quá trình giải phóng vi rút ra khỏi tế bào
Nguồn: Drug Discovery Approaches – Wiley 2007
1.2.3. Các thuốc kháng vi rút mới
Thuốc ức chế sự xâm nhập của vi rút vào tế bào
Arbidol là thuốc kháng vi rút được điều chế và sử dụng đầu tiên tại Nga từ năm 1993 và sau đó tại Trung Quốc năm 2006 [18], có khả năng ức chế sự xâm nhập của vi rút vào tế bào cảm nhiễm với khả năng phá vỡ môi trường pH thấp làm cho vi rút cúm không thể hòa màng khi xâm nhập vào tế bào và mất khả năng cởi áo giải phóng các thành phần của vi rút khi đã ở bên trong tế bào.
Thuốc ức chế thụ thể trên bề mặt tế bào – DAS181 – là một loại protein tái tổ hợp bao gồm phần có tác dụng xúc tác của sialidase và phần protein gắn chặt trên bề mặt màng tế bào biểu mô đường hô hấp. Axit sialic trên bề mặt tế bào chủ, thụ thể đặc hiệu của protein HA của vi rút cúm, sẽ bị phá hủy khi cho tế bào tiếp xúc với sialidase, một loại enzyme ngoại bào có tác dụng tách axit sialic ra khỏi liên kết
với các glycoprotein và glycolipid. Bên cạnh đó, phần protein gắn chặt trên bề mặt màng tế bào tồn tại trên khắp bề mặt tế bào biểu mô đường hô hấp có khả năng làm tăng hiệu quả tác dụng của sialidase khi đặt thêm một phân tử bên cạnh axit sialic.
Các thuốc ức chế neuraminidase
Hai loại thuốc kháng vi rút mới hoạt động theo cơ chế ức chế neuraminidase đang trong quá trình thử nghiệm giai đoạn III tại Mỹ nhưng đã được cấp phép sử dụng tại Nhật và Hàn Quốc là Peramivir và Laninamivir vào các năm 2006 và 2010. Peramivir có cấu tạo tương tự axit sialic, có khả năng ức chế đặc hiệu neuraminidase, được sử dụng dạng tiêm. Laninamivir có cấu trúc tương tự như zanamivir nhưng khả năng bám gắn của laninamivir với NA được đánh giá cao, có thời gian bán thải dài (khoảng 3 ngày), được coi là sự lựa chọn tốt đối với những bệnh nhân nhiễm cúm có biến chứng nặng hoặc suy giảm miễn dịch.
Các thuốc ức chế sự sao chép và nhân lên của vi rút trong tế bào
Thuốc ức chế sự tái tạo vi rút của vi rút cúm - T-705 còn được biết dưới tên faviparavir, là một phân tử nonpeptide nhỏ có khả năng kháng vi rút cúm dựa trên cơ chế ức chế sự tái tạo hạt vi rút, có tác dụng chống lại cả ba phân típ cúm A, B và
C. Faviparavir tác dụng ức chế lên quá trình tổng hợp RNA của vi rút nhưng không ức chế quá trình tổng hợp DNA và RNA của tế bào chủ. T-705 đã được chứng minh có tác dụng chống lại vi rút cúm gia cầm có độc lực cao A/H5N1 và đang trong quá trình thử nghiệm giai đoạn I. Tuy nhiên, cơ chế hoạt động của T-705 chưa được chứng minh một cách rõ ràng [48].
Ribarivin và viramidine là 2 hoạt chất kháng vi rút phổ rộng. Ribarivin được sử dụng điều trị viêm gan C phối hợp với interferon từ nhiều năm có cơ chế tác dụng trực tiếp lên quá trình sao chéo và nhân lên bộ gen của vi rút. Viramidine là dạng tiền hoạt động của ribavirin, có cơ chế hoạt động tương tự ribavirin nhưng ít tác dụng phụ hơn. Ribavirin được thử nghiệm điều trị nhiễm cúm nhưng kết quả điều trị kém hơn amantadine và các thuốc ức chế neuraminidase. Viramidine đã được thử
nghiệm với vi rút cúm A/H5N1 và cho kết quả khả quan nhưng mới chỉ dừng ở giai
đoạn thử nghiệm [100].
1.3. Tình hình kháng thuốc của vi rút cúm A với thuốc kháng vi rút
Hiện nay, các phương pháp áp dụng chủ yếu trong điều trị và phòng chống nhiễm vi rút cúm là tiêm văc xin và sử dụng thuốc đặc hiệu kháng vi rút. Văc xin phòng chống nhiễm vi rút cúm A/H5N1 hiện tại được phát triển tại một số nước, tuy nhiên vẫn chưa lưu hành trên thị trường. Văc xin cúm đang phổ biến hiện tại là văc xin cúm theo mùa và chỉ phát huy tác dụng khi được tiêm trước vụ dịch cúm và chủng vi rút cúm lưu hành trong vụ dịch tương tự chủng vi rút trong thành phần văc xin. Sau khi tiêm văc xin cúm, đáp ứng miễn dịch còn phụ thuộc rất nhiều vào cơ địa của từng cá thể và loại văc xin được sử dụng. Thuốc kháng vi rút cúm đặc hiệu đang lưu hành (amantadine, oseltamivir...) được sử dụng trong điều trị và dự phòng nhiễm vi rút, đặc biệt là vi rút A/H5N1. Tuy vậy, một trong những tương tác của thuốc với vi rút là hiện tượng đột biến xuất hiện trong vật liệu di truyền của vi rút và hệ quả là sự kháng thuốc của vi rút ở thế hệ sau [56, 58, 67].
1.3.1. Tình hình kháng thuốc của vi rút cúm với thuốc amantadine
Amantadine và rimantadine là các dẫn chất của adamantane, được sử dụng từ những năm 60 của thế kỷ trước. Amatadine có hiệu quả điều trị chống lại tất cả các phân típ cúm A gây bệnh cho người trước đây (H1N1, H2N2, H3N2) nhưng không chống lại được vi rút cúm B do protein M2 chỉ có ở vi rút cúm A [21]. Sau 7 năm đưa vào sử dụng (1995-2002), tác dụng của adamantane trong điều trị và phòng bệnh được ghi nhận nhưng có hiệu quả không cao bởi quá trình kháng thuốc đã xuất hiện và lan truyền nhanh trong quần thể. Tỉ lệ kháng thuốc amantidine là 2% năm 2002, tăng lên 12% năm 2004 và 100% ở các chủng A/H3N2 năm 2005. Theo kết quả của các nghiên cứu về tỉ lệ kháng amantadine của vi rút cúm A cho thấy 100% các vi rút cúm A/H3N2 và A/H1N1pdm09 kháng amantadine. Tuy nhiên, một nghiên cứu tại Nhật năm 2008 đã xác định chủng cúm A/H3N2 có khả năng trở nên
nhạy với amantadine. Sự quay trở lại này là kết quả của quá trình trao đổi và tích hợp bộ gen giữa các chủng vi rút cúm lưu hành vào mùa cúm 2002-2003, 2004- 2005 và 2005-2006 [12].
Các nghiên cứu về vi rút cúm A/H5N1 kháng amantadine cho thấy chủng H5N1 lưu hành tại các nước Đông Nam Á như Việt Nam, Thái Lan, Cambodia mang đột biến kháng thuốc chủ yếu tại vị trí S31N, đặc biệt các chủng lưu hành tại Việt Nam năm 2004 mang 2 đột biến tại vị trí 31 và 27 (V27A) trong khi các chủng lưu hành tại Trung Quốc và Indonesia lại vẫn duy trì sự nhạy cảm với thuốc amantadine [9, 15].
1.3.2. Tình hình kháng thuốc của vi rút cúm với thuốc oseltamivir
Oseltamivir và zanamivir là hai chất ức chế chọn lọc trên enzyme bề mặt, neuraminidase, của vi rút cúm được đưa vào sử dụng từ năm 1999, enzyme này có tính chất khá bảo tồn ở các chủng vi rút cúm, do vậy khả năng xảy ra sự kháng thuốc của vi rút được các nhà khoa học tiên lượng là thấp hơn amantadine [21]. Tuy nhiên, gần đây các nghiên cứu trong nước và trên thế giới chỉ ra rằng những chủng vi rút kháng lại oseltamivir chủ yếu trên phân típ A/H1N1 lưu hành trước năm 2009. Tỉ lệ kháng oseltamivir của phân típ này chỉ ở mức dưới 1% [46, 59] vào những năm 2005-2006, các chủng kháng với oseltamivir đã bắt đầu xuất hiện năm 2007, sau đó tăng nhanh 43-60% năm 2008 và lan rộng trên toàn thế giới năm 2009 với tỉ lệ kháng lên đến 95% (Nhật, Mỹ, Châu Âu) [64, 110]. Chủng vi rút cúm gia cầm A/H5N1 cũng đã có biểu hiện kháng oseltamivir, trong đó có 2 trường hợp xuất hiện kháng thuốc trong quá trình điều trị tại bệnh viện [67] và một trường hợp mang chủng kháng thuốc không qua điều trị, ba chủng này có nguồn gốc từ Việt Nam [8, 11, 26, 31]. Trong thời gian diễn ra đại dịch cúm A/H1N1pdm09, đã ghi nhận các trường hợp kháng oseltamivir đơn lẻ và theo nhóm tại Việt Nam, Úc và Nauy [35, 39, 58]. Bệnh nhân nhiễm chủng vi rút A/H1N1pdm09 kháng thuốc ngoài các trường hợp có liên quan đến điều trị còn bao gồm những trường hợp có bệnh mạn tính, suy giảm hệ miễn dịch và không liên quan đến điều trị thuốc [37].
Ngoài ra, vi rút cúm mới xuất hiện trên người A/H7N9 tại Trung Quốc được thông báo mang đã mang sẵn phân đoạn gen mã hóa NA có điểm đột biến R292K gây kháng oseltamivir [63], gây khó khăn cho công tác phòng và điều trị.
1.4. Kỹ thuật áp dụng trong quá trình xác định tính kháng thuốc của vi rút cúm A
1.4.1. Nguyên nhân và cơ chế của hiện tượng kháng thuốc
Thuốc amatadine: Amantadine được đưa vào sử dụng từ những năm 1960 với mục đích phòng và điều trị cúm A. Theo khảo sát từ năm 1994, hiện tượng kháng amantadine đã xuất hiện [50]. Tìm hiểu nguồn gốc của sự kháng thuốc, phân đoạn gen mã hóa M đã được phân tích trình tự nucleotide để xác định sự thay đổi có liên quan đến kháng thuốc. Theo các nghiên cứu, hiện tượng kháng amantadine thường xảy ra với các chủng cúm A/H3N2 có xuất hiện các điểm đột biến trên phân đoạn gen mã hóa M (phần M2) dẫn đến thay đổi các axit amin tại các vị trí gắn kết. Năm vị trí axit amin liên quan đến việc kháng amatadine là 26, 27, 30, 31 và 34, trong đó, vị trí 31, thay đổi từ Serin (Ser-S) sang Arginine (Asn-N), là vị trí thường gặp [9, 42, 89]. Các đột biến này làm vị trí tiếp xúc với thuốc được "nới rộng", không còn tương ứng với kích thước của thuốc, amantadine không gắn được vào đúng vị trí trên protein M2 [82]. Do đó, vi rút không bị ức chế, vẫn tiếp tục quá trình hòa màng, "cởi áo", đưa các RNP và tế bào cảm nhiễm của vật chủ. Ngoài ra, sự kháng thuốc có thể xảy ra không liên quan đến hiện tượng đột biến mà do sự trao đổi và tích hợp bộ gen (trường hợp vi rút H1N1pdm09 khi xuất hiện kháng 100% với amantadine).
Thuốc oseltamivir: Nguồn gốc của hiện tượng kháng oseltamivir là do có sự thay đổi axit amin tại vùng tiếp xúc của neuraminidase với thuốc, cụ thể là các vị trí I117V, H275Y, N294S trên N1 và E119V, R152K, R292K, N294S trên phân đoạn gen mã hóa N2 [24, 101, 104]. Sự đột biến tại các vị trí này gây giảm hiệu quả tương tác giữa thuốc và neuraminidase dẫn đến sự giảm độ nhạy hoặc kháng của vi
rút với thuốc. Tuy nhiên, theo dõi sự kháng thuốc của vi rút với zanamivir, dường như zanamivir vẫn có hiệu quả trên các chủng vi rút đã kháng với oseltamivir và đây có thể do sự khác nhau về cấu trúc không gian của hai loại thuốc này [79]. Tương tự như trường hợp vi rút H1N1pdm09 kháng amantadine, phân đoạn gen mã hóa NA của vi rút cúm mới xuất hiện trên người A/H7N9 cũng đã mang đột biến tại vị trí R292K liên quan đến kháng oseltamivir thông qua quá trình trao đổi và tích hợp đoạn gen [62].
Như vậy, sự kháng thuốc của vi rút cúm A qua thời gian tập trung vào các nguyên nhân sau: đột biến tại các vị trí liên quan đến sự bám gắn của thuốc trên phân đoạn gen mã hóa NA và M; áp lực duy trì nòi giống của vi rút mà biểu hiện chính là sự trao đổi và tích hợp bộ gen, do đó vi rút hoàn toàn có khả năng mang gen kháng thuốc từ khi mới xuất hiện; sự thích nghi với nhiều loại vật chủ của vi rút cúm A tạo điều kiện thuận lợi cho sự kháng thuốc xuất hiện (vi rút cúm B có tỉ lệ kháng thuốc thấp hợp vi rút cúm A).
1.4.2. Các kỹ thuật được áp dụng trong giám sát sự kháng thuốc thông qua sự thay đổi vật liệu di truyền của vi rút cúm
Kỹ thuật giải trình tự gen thông thường (phương pháp Sanger)
Việc xác định chủng vi rút có mang gen kháng thuốc sử dụng phương pháp giải trình tự gen thông thường đã được thực hiện từ những năm 90, qua đó có thể theo dõi được sự xuất hiện hiện tượng kháng thuốc của vi rút cúm [93]. Điển hình là sự xuất hiện của hiện tượng kháng amantadine của vi rút A/H3N2, hiện tượng kháng oseltamivir của vi rút A/H1N1 và là phương pháp chủ yếu được lựa chọn để xác định chủng vi rút cúm A kháng amantadine.
*Ưu điểm
Ưu điểm của kỹ thuật là khả năng ứng dụng rộng rãi, có thể giải trình tự nucleotide cho toàn bộ gen đích hoặc từng phần gen có mang vị trí đột biến liên
quan đến kháng thuốc. Sử dụng kỹ thuật giải trình tự gen này cũng có thể xác định được hiện tượng kháng thuốc không hoàn toàn, hoặc nhiều đột biến liên quan đến kháng thuốc. Chủng vi rút mang nhiều đột biến tại các vị trí khác nhau trên gen đích cùng có tác dụng gây kháng thuốc có thể phát hiện được nhờ khả năng giải trình tự đoạn nucleotide dài. Ngoài ra, các đột biến khác không liên quan đến kháng thuốc nhưng có liên quan đến sự tiến hóa, thay đổi đặc tính kháng nguyên của vi rút cũng được xác định [93].
*Nhược điểm
Kỹ thuật phải thực hiện trên các gen đích khuếch đại từ các chủng vi rút cúm phân lập, thời gian thực hiện dài và chi phí để thực hiện còn cao.
Kỹ thuật đa hình độ dài đoạn giới hạn (RFLP - Restriction Fragment Length Polymorphism)
Đa hình độ dài đoạn giới hạn là kỹ thuật thường được sử dụng phối hợp cùng kỹ thuật PCR [33]. Sử dụng enzyme giới hạn phân tích đoạn gen của vi rút cúm có thể xác định được chủng vi rút có mang đột biến liên quan đến kháng thuốc sau khi thu được sản phẩm PCR. Để thực hiện kỹ thuật này, phản ứng PCR được thực hiện với đoạn mồi đặc hiệu (mồi ngược) được thiết kế mang vị trí cắt của enzyme giới hạn xác định (ví dụ BspHI..) [78]. Sản phẩm PCR thu được sẽ được xử lý bằng enzyme giới hạn tương ứng với mồi thiết kế. Enzyme giới hạn BspHI [33] hoặc BclI [78] sẽ cắt sản phẩm PCR tại với vị trí xác định có trình tự tương ứng với vi rút không mang đột biến kháng thuốc (vi rút nhạy cảm với thuốc), trong trường hợp vi rút mang gen kháng thuốc, sản phẩm PCR sẽ không được cắt bởi enzyme giới hạn.
*Ưu điểm
Kỹ thuật này có thể thực hiện được với số lượng mẫu lớn, giá thành thấp và có thể thực hiện trên bệnh phẩm lâm sàng và vi rút phân lập.
*Nhược điểm