- TOC xác định trên thiết bị Shimadzu TOC – VCPH analyser, Nhật Bản tại Viện Công nghệ Môi trường – Viện Hàn lâm Khoa học và Công nghệ Việt Nam.
- Hàm lượng H2O2 xác định bằng máy quang phổ BECKMAN COULTER DU 730 Life science UV/Vis spectrophotometer đo tại bước sóng 352 nm. Viện Công nghệ Môi trường – Viện Hàn lâm Khoa học và Công nghệ Việt Nam.
- Hàm lượng glyphosate xác định bằng phương pháp phân tích trắc quang, sử dụng thiết bị quang phổ khả kiến Genesys 10S Vis (Mỹ) đo tại bước sóng 570 nm. Viện Công nghệ Môi trường – Viện Hàn lâm Khoa học và Công nghệ Việt Nam và phân tích xác định glyphosate bằng thiết bị Hệ thống LCMS/MS tại Viện Hóa công nghiệp Việt Nam.
- Glycine được phân tích bằng thiết bị Hệ thống LCMS/MS tại Viện Hóa công nghiệp.
- Hóa chất BVTV Clo hữu cơ và hóa chất BVTV photpho hữu cơ được xác định bằng thiết bị máy GC – MS hãng Perkin Elmer Clarus 600 tại Viện Hóa công nghiệp Việt Nam.
CHƯƠNG 3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Nghiên cứu xử lý glyphosate bằng quá trình Fenton điện hóa
3.1.1. Ảnh hưởng của mật độ dòng điện và thời gian điện phân đến khả năng phân hủy glyphosate
Trong quá trình EF, mật độ dòng điện và thời gian điện phân là hai trong số những yếu tố ảnh hưởng rất lớn đến hiệu quả xử lý. Trong quá trình xử lý glyphosate bằng EF, mật độ dòng điện và thời gian điện phân sẽ ảnh hưởng đến lượng chất H2O2 tạo thành theo phản ứng 1.20 từ đó ảnh hưởng đến lượng gốc (•OH) được tạo ra trong phản ứng Fenton.
Để nghiên cứu ảnh hưởng của thời gian điện phân và mật độ dòng điện bằng quá trình EF. Mật độ dòng đặt giữa 2 điện cực được điều chỉnh với các giá trị khác nhau: 1,667 mA/cm2; 3,333 mA/cm2; 5 mA/cm2; 6,667 mA/cm2; 8,333 mA/cm2; 16,667 mA/cm2. Các điều kiện nồng độ dung dịch glyphosate 0,1 mM; pH ban đầu của dung dịch đưa về giá trị bằng 3, nồng độ Fe2+ ban đầu đưa vào dung dịch là 0,1 mM (nồng độ glyphosate: 16,9 mg/L); d = 1 cm. Để xác định hiệu quả khoáng hóa (vô cơ hóa, phân hủy glyphosate thành H2O, CO2 và axit H3PO4), tiến hành phân tích giá trị TOC tại các thời gian: 0, 15, 30, 45, 60 phút điện phân.
Từ kết quả Hình 3.1 mật độ dòng ảnh hưởng và thời gian điện phân có ảnh hưởng đến hiệu quả khoáng hóa glyphosate, khi thời gian càng lớn, giá trị TOC – hàm lượng cacbon hữu cơ của dung dịch càng nhỏ, nghĩa là tỷ lệ khoáng hóa glyphosate càng cao. Tính toán hiệu suất khoáng hóa tại từng thời điểm và ở từng mật độ dòng khác nhau, biểu diễn trên đồ thị Hình 3.1 có thấy rõ sự ảnh hưởng này. Tại chế độ mật độ dòng: 1,667 mA/cm2, sau 15 phút điện phân, hiệu suất khoáng hóa chỉ đạt 46,69%, nhưng sau 60 phút điện phân, hiệu suất khoáng hóa đã tăng lên 63,54%. Cũng sau 60 phút điện phân, ở chế độ mật độ dòng: 5 mA/cm2 thì hiệu suất khoáng hóa đạt 72,10%, còn ở chế độ mật độ dòng: 8,333 mA/cm2 thì hiệu suất khoáng hóa tăng lên 84,53%. Khi thời gian điện phân tăng lên thì khả năng tạo ra các gốc hydroxyl (•OH) tự do tăng, điều này giải thích hiệu quả xử lý TOC cũng tăng theo thời gian.
Từ các kết quả trên có thể được giải thích như sau: theo định luật Faraday, chất bị điện phân trên các điện cực tỷ lệ thuận với cường độ dòng điện và thời gian điện phân theo công thức (3.1), vì vậy lượng H2O2 tạo thành tỷ lệ thuận với mật độ dòng điện và thời gian điện phân. Kết quả là khi thời gian xảy ra phản ứng điện phân tăng thì gốc •OH tạo ra cũng tăng lên. Mặt khác, khi tăng mật độ dòng điện và thời gian
điện phân, tốc độ tái sinh chất xúc tác Fe2+ theo phản ứng (1.21) cũng tăng, nhờ đó theo phản ứng 1.1 thì gốc •OH cũng tạo ra nhiều hơn. Theo định luật Faraday, lượng chất tạo thành ảnh hưởng trực tiếp bởi ba yếu tố: mật độ dòng (cường độ dòng điện), vật liệu điện cực và thời gian: gốc hydroxyl (•OH) sẽ tấn công các phân tử glyphosate, bẻ mạch cacbon tạo thành phân tử hữu cơ có phân tử lượng nhỏ hơn, CO2, H2O. Do đó lượng glyphosate bị phân hủy tăng, hay nói cách khác mức độ khoáng hóa glyphosate tỷ lệ với cường độ dòng điện.
C = f(𝑀.𝐼.𝑡 ) (3.1)
𝑛.𝐹.𝑉
Trong đó: C - Nồng độ, g/L;
M - Khối lượng nguyên tử của chất bị điện phân, g/mol; I - Cường độ dòng điện, A;
T - Thời gian điện phân, phút;
F - Hằng số Faraday, 96500 C/mol;
V - Thể tích của dung dịch điện phân, L.
J = 1,667 mA/cm2 J = 3,333 mA/cm2 J = 5 mA/cm2
J = 6,667 mA/cm2 J = 8,333 mA/cm2 J = 16,667 mA/cm2
100
80
Hiệu suất xử lý TOC (%)
60
40
20
0
0 10 20 30 40 50 60
Thời gian (phút)
Hình 3.1. Ảnh hưởng của mật độ dòng và thời gian điện phân trong quá trình EF Năm 2007, nhóm nghiên cứu của Zhang xử lý nước chứa 4-nitrophenol bằng
quỏ trỡnh EF với điều kiện cường độ dũng điện từ 0,5A ữ 2A đó cụng bố mật độ dũng điện cao hơn dẫn đến sự tỏi sinh Fe2+ nhanh hơn và qua đó làm tăng hiệu quả của
chuỗi phản ứng Fenton. Tuy nhiờn trong bỏo cỏo cụng bố này Zhang thỡ hiệu quả xử lý COD giảm khi cường độ dũng tăng: 1A ữ 2A. Trong cụng bố này hiệu suất xử lý COD trong thời gian là 120 phỳt đạt 70%.
Năm 2016, Hou và cộng sự nghiên cứu xử lý nước thải khí hóa than bằng quá trình EF kết hợp quá trình sinh học đã báo cáo hiệu suất khoáng hóa TOC tăng 20,9% khi mật độ dòng điện tăng từ 10 mA/cm2 ữ 24 mA/cm2 [51].
Theo dõi sự biến thiên nồng độ H2O2 được sinh ra khi điện phân dung dịch với mật độ đòng diện khác nhau, không có sự tham gia của xúc tác Fe2+. Sau thời gian phản ứng xảy ra, mật độ dòng điện càng lớn, nồng độ H2O2 được sinh ra càng lớn, cụ thể sau 60 phút điện phân, nồng độ H2O2 được sinh ra ở mật độ dòng điện 1,667 mA/cm2 là 4,16 mg/L trong khi nếu mật độ dòng điện là 8,333 mA/cm2, nồng độ H2O2 được tạo ra là 5,44 mg/L. Mặt khác, khi điện phân với cùng một mật độ dòng điện, lượng H2O2 được tạo ra càng lớn khi thời gian phản ứng càng dài. Chẳng hạn khi điện phân áp dụng ở mật độ dòng: 1,667 mA/cm2 cho kết qua sau 15 phút sinh ra 2,75 mg/L H2O2 và sau 45 phút nồng độ H2O2 được tạo ra là 4,07 mg/L. Như vậy lượng H2O2 tạo ra càng lớn khi thời gian và mật độ dòng càng lớn. Kết quả này đã chứng tỏ rằng, lượng gốc tự do hydroxyl (•OH) được tạo ra càng nhiều qua đó khả năng khoáng hóa glyphosate càng cao.
J = 1,667 mA/cm2 J = 3,333 mA/cm2 J = 5 mA/cm2
J = 6,667 mA/cm2 J = 8,333 mA/cm2
6
5
Nồng độ H2O2(mg/L)
4
3
2
1
0
0 10 20 30 40 50 60
Thời gian (phút)
Hình 3.2. Ảnh hưởng của mật độ dòng và thời gian điện phân đến lượng H2O2 tạo thành
Năm 2006, nhóm nghiên cứu của Deng khi xử lý nước rỉ rác đã chỉ ra H2O2 đóng một vai trò quan trọng trong hiệu suất của phản ứng EF, vì nó ảnh hưởng trực tiếp đến số lượng gốc hydroxyl (•OH) được tạo thành. Gốc •OH có vai trò rất lớn để phân hủy các hợp chất hữu cơ bền vững tạo ra các sản phẩm ngắn mạch hơn đồng thời việc tăng hàm lượng H2O2 thường cải thiện hiệu suất tổng thể do sự gia tăng gốc •OH (phản ứng 1.1) [131].
Năm 2016, Gỹmỹş và cộng sự đỏnh giỏ cỏc kết quả xử lý phenol bằng quỏ trỡnh EF và Fenton thông thường [55]. Thí nghiệm thực hiện với [H2O2] = 0 ữ 1000 mg/L, mật độ dũng điện: 1 mA/cm2 tại pH = 3. Kết quả phân hủy phenol là 18,96%; 72,62%; 93,32%; 97,62% và 97,76% ở thời gian 5 phút khi nồng độ H2O2 là 0, 250, 500, 750 và 1000 mg/L. Với điều kiện H2O2 như trên thì hiệu quả xử lý COD lần lượt là 9,38%; 59,38%; 87,50%; 90,63% và 93,75%. Điều này chứng tỏ sự tăng nồng độ H2O2 làm tăng hiệu suất của quá trình.
Mặc dù vậy, khi nồng độ H2O2 cao có thể gốc hydroxyl tự do tham gia phản ứng (theo phản ứng 1.14 và 1.17) hoặc tái kết hợp (•OH) (phản ứng 1.16) dẫn đến hiệu quả xử lý giảm.
Bên cạnh đó, lượng H2O2 dư làm giảm đáng kể hiệu quả tổng thể trong những trường hợp áp dụng công nghệ Fenton đóng vai trò là quá trình tiền xử lý đối với các quá trình sinh học vì vậy nồng độ H2O2 thích hợp cần được xác định để tối đa hóa hiệu suất trong hệ thống EF đồng thời giảm thiểu các nhược điểm trên.
Cũng trên Hình 3.1 cho thấy: đối với tất cả mật độ dòng được thử nghiệm, trong khoảng 45 phút đầu tiên, khi thời gian phản ứng tăng thì khả năng khoáng hóa tăng khá nhanh. Khi thời gian phản ứng trên 45 phút, khả năng khoáng hóa vẫn tăng khi tăng, nhưng tốc độ tăng giảm, có nghĩa thời gian điện phân dài không có nhiều hiệu quả trong việc tăng hiệu suất khoáng hóa. Theo Hình 3.2, lượng H2O2 được sinh ra tăng nhanh ở 45 phút điện phân đầu tiên, sau đó tốc độ tăng cũng chậm lại. Như giải thích ở trên, nồng độ H2O2 liên quan trực tiếp đến lượng gốc (•OH) được sinh ra và gián tiếp ảnh hưởng đến hiệu suất khoáng hóa glyphosate, vì vậy việc hiệu suất khoáng hóa glyphosate tăng tại 45 phút đầu tiên, sau đó chậm lại là phù hợp. Việc nồng độ H2O2 tăng chậm khi thời gian điện phân vượt quá 45 phút có thể là do sau 45 phút, nồng độ oxy trong dung dịch đã bị giảm đi nhiều mặc dù vẫn được bổ sung bởi quá trình sục khí liên tục. Mặt khác, sau 45 phút điện phân nồng độ H+ trong dung dịch đã giảm theo
phản ứng (1.20), H2O2 bị phân hủy một phần, dẫn đến việc H2O2 không tăng nhiều dù vẫn được sinh ra theo phản ứng (1.20).
Tốc độ suy thoái chất ô nhiễm tăng cao ở mật độ dòng cao hơn dẫn đến giảm thời gian phản ứng, tuy nhiên lợi ích tiết kiệm thời gian có thể trở nên không đáng kể nếu mật độ dòng điện áp dụng quá cao dẫn đến tiêu tốn nhiều năng lượng. Hiệu suất dòng điện có thể giảm khi mật độ dòng điện áp dụng quá cao (do tổn thất điện năng chuyển thành nhiệt năng), đồng thời mật độ dòng điện cao hơn cũng xảy ra các phản ứng phụ (phản ứng 3.2) qua đó làm ảnh hưởng đến hiệu quả xử lý.
2•OH→O2 + 2H+ + 2e- (3.2)
Qua phân tích ở trên có thể thấy rằng để có hiệu suất khoáng hóa glyphosate tăng khi thời gian phản ứng tăng tuy nhiên không nên vượt quá 45 phút. Trong báo cáo của Dirany và cộng sự năm 2010 thời gian phản ứng khi oxy hóa thuốc kháng sinh sulfamethoxazole (SMX) trong điều kiện pH = 3, [Fe2+] = 0,2 mM, điện cực sử dụng BDD/vải cacbon bằng quá trình EF là 60 phút [133].
Năm 2009, nhóm nghiên cứu của Ting báo cáo quá trình phân hủy chất màu 2, 6– dimethylaniline bằng quá trình EF tại điều kiện pH = 2, nồng độ 2, 6–dimethylaniline là 1mM; nồng độ Fe2+ = 1mM; nồng độ H2O2 = 20mM; nồng độ NaClO4 = 50mM. Trong nghiờn cứu, mật độ dũng từ 3,5 ữ 10,6 A/m2 cho thấy mật độ dòng tăng thì hiệu quả xử lý tăng. Kết quả hiệu suất TOC đạt 60% trong thời gian thực hiện là 120 phút [134].
Tương tự báo cáo kết quả của Oturan và cộng sự khi nghiên cứu động học và quá trình khoáng hóa thuốc trừ sâu diuron, monuron và fenuron bằng quá trình EF vào năm 2010. Nghiên cứu áp dụng điều kiện pH =3; nồng độ Fe2+ = 0,2mM, nhiệt độ phũng và I = 60mA ữ 300mA, khi cường độ dũng tăng thỡ hiệu quả xử lý tăng. Tuy vậy, khụng lựa chọn cường độ dũng điện quỏ cao để thực hiện quỏ trỡnh xử lý. Cụ thể tại điều kiện cường độ dũng điện I = 10 mA; pH = 3; [Fe2+] = 0,2mM; [diuron]
= 0,17 mM; [monuron] = 0,25 mM; [fenuron] = 0,20 mM và thực hiện trong thời gian 3h thì hiệu suất COD lần lượt là 92%; 92,6% và 93,7% [135].
Thực tế cho thấy khi đặt mật độ dòng quá lớn, từ 16,667 mA/cm2 trở lên thì điện cực vải cacbon rất nhanh bị hỏng (rách điện cực) (Hình 3.3). Do đó mật độ dòng không nên vượt quá 16,667 mA/cm2.

Hình 3.3. Điện cực bị hỏng
Kết quả báo cáo nghiên cứu của nhóm Skoumal khi phân hủy thuốc ibuprofen trong môi trường axit sử dụng điện cực Pt và kim cương pha tạp Bo công bố hiệu quả xử lý tăng khi mật độ dòng điện tăng từ 6,6 mA/cm2 đến 33,3 mA/cm2. Tuy nhiên hiệu quả giảm khi mật độ dòng điện tăng từ 33,3 mA/cm2 ữ 100 mA/cm2, với các điều kiện dòng điện khác nhau. Tuy vậy điểm chung cho thấy kết quả mật độ dòng quá lớn có thể làm giảm hiệu suất xử lý. Trong luận án khi mật độ dòng tăng từ 8,333 mA/cm2
ữ 16,667 mA/cm2 thì hiệu suất xử lý giảm từ 84,53% về 68,78% [136]. Một số nghiên cứu khác cũng cho thấy những kết quả như sau:
Năm 2011, nhóm nghiên cứu của Borras và cộng sự chỉ ra trong quá trình khoáng hóa desmetryne (C8H15N5S) trong mụi trường axit cú pH từ 2 ữ 3, hiệu quả TOC được cải thiện 42% khi dũng điện ỏp dụng tăng từ 100mA lờn 300mA, nhưng chỉ cải thiện 10% sau khi dũng điện tăng lờn 450 mA [137]. Khi cường độ dũng tăng từ 100 mA ữ 450 mA hiệu suất khoỏng húa giảm từ 13,7% ữ 7,1%.
Năm 2017, Shin và cộng sự khi nghiên cứu xử lý nước thải thực phẩm công bố tốc độ động học của EF đạt cực đại khi mật độ dòng là 28,5 mA/cm2 và không cải thiện về hiệu suất xử lý do phản ứng có thể xảy ra giữa các chất ô nhiễm và gốc •OH làm giảm lượng chất oxy hóa khi mật độ dòng tăng [138].
Qua việc so sánh đánh giá các quá trình nghiên cứu xử lý các đối tượng của các nhà khoa học và đặc biệt luận án sử dụng đối tượng riêng là hóa chất diệt cỏ glyphosate cho thấy mật độ dòng điện ảnh hưởng hiệu quả xử lý do đó để tìm được điều kiện tốt nhất, luận án tiếp tục đánh giá khả năng tiêu thụ năng lượng để đưa ra kết luận về điều kiện mật độ dòng thích hợp.
Mật độ dòng cao hơn cũng đòi hỏi tiêu thụ nhiều năng lượng hơn. Do đó, cần phải điều chỉnh mật độ dòng điện áp dụng phù hợp để có sự cân bằng giữa hiệu quả xử lý mong muốn và chi phí năng lượng.
Trong luận án khi sử dụng quá trình EF để xử lý glyphosate thực hiện trong thời gian ngắn hơn là 60 phút và hiệu quả xử lý TOC đạt 84,53%. Điều này có thể làm giảm chi phí điện năng trong quá trình xử lý. Kết quả tính toán chi phí điện năng được thể hiện trong Bảng 3.1.
Để đánh giá sự tiêu thụ năng lượng bằng quá trình EF, sử dụng công thức tính năng suất tiêu thụ sau:
W v. t .I
1000.V
(3.3)
Trong đó: W – Năng lượng tiêu thụ, KWh/m3;
ν - Hiệu điện thế đặt vào các điện cực, vol; t – Thời gian điện phân, giờ;
I – Cường độ dòng đặt vào các điện cực;
V – Thể tích mẫu nước thải mang điện phân, m3.
Bảng 3.1. Hiệu suất xử lý glyphosate và năng lượng tiêu thụ bằng quá trình EF
Mật độ dòng (mA/cm2) | Hiệu điện thế (V) | Năng lượng tiêu thụ (KWh/m3) | Hiệu suất xử lý TOC (%) | |
0,1 | 1,667 | 3,1 | 1,55 | 63,54 |
0,2 | 3,333 | 3,4 | 3,4 | 66,85 |
0,3 | 5 | 4,2 | 6,3 | 72,10 |
0,4 | 6,667 | 5,1 | 10,2 | 77,35 |
0,5 | 8,333 | 5,6 | 14 | 84,53 |
1,0 | 16,667 | 9,1 | 45,5 | 68,78 |
Có thể bạn quan tâm!
-
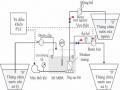
 Hệ Ef Trong Phòng Thí Nghiệm Theo Đó, Hệ Ef Bao Gồm:
Hệ Ef Trong Phòng Thí Nghiệm Theo Đó, Hệ Ef Bao Gồm: -
 Giá Trị Ph Của Quá Trình Ef Trong Các Nghiên Cứu Khác Nhau
Giá Trị Ph Của Quá Trình Ef Trong Các Nghiên Cứu Khác Nhau -
 Bảng Pha Chất Nuôi Bùn Hoạt Tính
Bảng Pha Chất Nuôi Bùn Hoạt Tính -
 Ảnh Hưởng Của Khoảng Cách Điện Cực Đến Khả Năng Xử Lý Glyphosate
Ảnh Hưởng Của Khoảng Cách Điện Cực Đến Khả Năng Xử Lý Glyphosate -
 Ảnh Hưởng Của Nồng Độ Glyphosate Ban Đầu Đến Khả Năng Xử Lý Của Quá Trình Fenton Điện Hóa
Ảnh Hưởng Của Nồng Độ Glyphosate Ban Đầu Đến Khả Năng Xử Lý Của Quá Trình Fenton Điện Hóa -
 Phổ Chuẩn Glyphosate Trên Thư Viện Phổ Của Máy Lcms/ms
Phổ Chuẩn Glyphosate Trên Thư Viện Phổ Của Máy Lcms/ms
Xem toàn bộ 229 trang tài liệu này.
Kết quả Bảng 3.1 năng lượng tiêu thụ điện tăng khi mật độ dòng tăng. Ở mật độ dòng J = 1,667 mA/cm2 (I = 0,1A) thì tiêu thụ năng lượng là 1,55 KWh/m3. Khi mật độ dòng là 16,667 mA/cm2 (I = 1A) thì năng lượng tiêu thụ điện là 45,5 KWh/m3. Tại điều kiện mật độ dòng J = 8,333 mA/cm2 (I = 0,5A) thì năng lượng điện tiêu thụ là 14 KWh/m3.
Từ kết quả Bảng 3.1. cho thấy, tại mật độ dòng: 8,333 mA/cm2 thì năng lượng điện tiêu thụ phù hợp và khả năng khoáng hóa trên 80%.