hoạt tính xúc tác quang của vật liệu tổ hơp. Hình ảnh nhỏ trên góc của hình 3.34B thể hiện kết quả đo nhiễu xạ điện tử vùng lựa chọn (SAED) của hỗn hợp oxit Fe-Ti, nó thể hiện các vòng đa tinh thể của các pha TiO2 và Fe2O3.
Để đánh giá ảnh hưởng của graphen đến khả năng tái tổ hợp của các electron và lỗ trống quang sinh ta tiến hành đo phổ hấp thụ huỳnh quang (PL) của mẫu vật liệu TFG20 và so sánh với phổ của vật liệu tổ hợp 2 oxit TFG0. Kết quả đo được thể hiện trên hình 3.35.
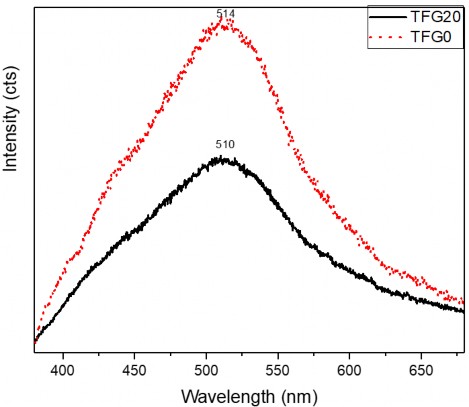
Hình 3.35. Phổ PL của vật liệu TFG20 và TFG0
Trên hình 3.35 có thể thấy rằng, pic hấp thụ huỳnh quang của vật liệu TFG0 có sự chuyển dịch từ bước sóng 510 nm sang 514 nm. Cường độ của pic hấp thụ huỳnh quang của vật liệu có GNP (TFG20) cũng giảm nhiều so với mẫu vật liệu khi không có sự tham gia của graphen (TFG0). Điều này là do khả năng tái tổ hợp của electron và lỗ trống quang sinh trong vật liệu TFG20 đã được giảm xuống. Kết quả này đã chứng minh graphen đã làm tăng khả năng lan truyền các các thành phần mang điện có mặt trong vật liệu tổ hợp TFG20,
khiến cho chúng khó kết hợp với nhau hơn và do đó khả năng tái tổ hợp đã giảm, hoạt tính xúc tác quang của vật liệu được tăng lên.
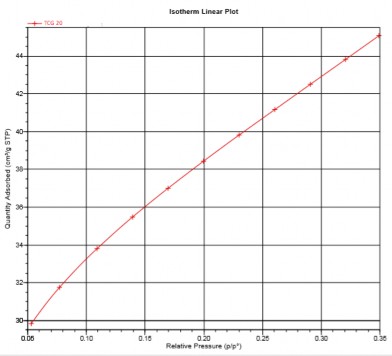
Diện tích bề mặt của vật liệu tổ hợp TiO2- Fe2O3/GNP được tính toán qua dữ liệu đường cong đẳng nhiệt hấp phụ N2 của vật liệu (hình 3.36). Diện tích bề mặt riêng BET tính toán của vật liệu tổng hợp là 133,4 m2/g, kết quả này phù hợp để vật liệu có khả năng ứng dụng làm xúc tác quang. Khi so sánh với diện tích bề mặt riêng BET của TiO2- Fe2O3 (80 m2/g) và GNP (119,9 m2/g), có thể thấy khi có mặt GNP, diện tích bề mặt vật liệu tăng lên, kết quả này phù hợp với kết quả nghiên cứu đã tiến hành ở tiểu mục a, mục 3.1.4.1 về ảnh hưởng GNP đến kích thước hạt của vật liệu tổ hợp.
Có thể bạn quan tâm!
-
 Nghiên Cứu Quá Trình Chế Tạo Vật Liệu Tổ Hợp Tio2- Fe2O3/gnp
Nghiên Cứu Quá Trình Chế Tạo Vật Liệu Tổ Hợp Tio2- Fe2O3/gnp -
 Giản Đồ Xrd Của Các Mẫu Tfg20 Thủy Nhiệt Ở Các Nhiệt Độ Khác Nhau
Giản Đồ Xrd Của Các Mẫu Tfg20 Thủy Nhiệt Ở Các Nhiệt Độ Khác Nhau -
 Khảo Sát Một Số Đặc Trưng Của Vật Liệu Tổ Hợp Tio2- Fe2O3/gnp
Khảo Sát Một Số Đặc Trưng Của Vật Liệu Tổ Hợp Tio2- Fe2O3/gnp -
 Quá Trình Chuyển Hóa Cr(Vi)) Của Vật Liệu Xúc Tác
Quá Trình Chuyển Hóa Cr(Vi)) Của Vật Liệu Xúc Tác -
 Nghiên Cứu Quá Trình Xử Lý Mẫu Nước Thải Thực Tế
Nghiên Cứu Quá Trình Xử Lý Mẫu Nước Thải Thực Tế -
 Nghiên cứu tổng hợp vật liệu TiO2- Fe2O3/GNP từ quặng ilmenit và graphit định hướng chuyển hóa Cr(VI) trong nước thải công nghiệp quốc phòng - 19
Nghiên cứu tổng hợp vật liệu TiO2- Fe2O3/GNP từ quặng ilmenit và graphit định hướng chuyển hóa Cr(VI) trong nước thải công nghiệp quốc phòng - 19
Xem toàn bộ 173 trang tài liệu này.
Hình 3.36. Đường cong đẳng nhiệt hấp phụ của mẫu TFG 20-8h
Độ bền nhiệt và sự thay đổi cấu trúc của vật liệu tổng hợp được nghiên cứu thông qua giản đồ TGA. Hình 3.37 thể hiện giản đồ TGA của mẫu TFG20- 8h từ đường cong DTA quan sát có 4 pic thu nhiệt tương đối mạnh ở 244,46oC, 369,88oC, 684,40oC, 805,44oC. Đường cong TGA cho thấy có ba giai đoạn mẫu giảm trọng lượng, quá trình giảm trọng lượng đầu tiên bắt đầu từ 100oC với độ
giảm 7,153% và kết thúc ở 300oC đây là do quá trình bay hơi của nước và mất nước nội phân tử; giai đoạn giảm trọng lượng thứ 2 tiếp tục diễn ra ở nhiệt độ 300 oC, với khối lượng giảm là 3,8%, quá trình mất khối lượng này có thể là do quá trình phân hủy của các liên kết -COOH, -CHO, C-O-SO3 …trên bề mặt graphen; giai đoạn thứ 3 là bắt đầu từ 570oC và kết thúc ở nhiệt độ khoảng 820oC, quá trình mất khối lượng này có thể là do quá trình cháy của graphen.
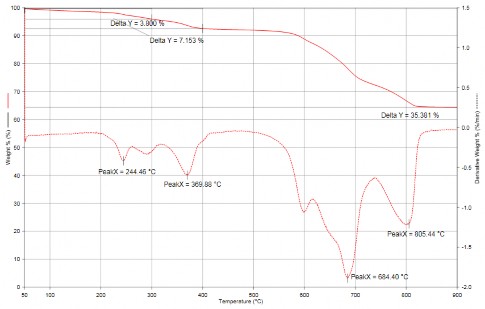
Hình 3.37. Giản đồ TGA của mẫu TFG 20-8h
3.2. Nghiên cứu quá trình chuyển hóa Cr(VI) của vật liệu tổ hợp TiO2- Fe2O3/GNP
3.2.1. Nghiên cứu ảnh hưởng đến quá trình chuyển hóa Cr(VI) của vật liệu tổ hợp TiO2- Fe2O3/GNP
Để đánh giá ảnh hưởng của các yếu tố khác nhau đến quá trình xử lý kim loại nặng của vật liệu tổ hợp TiO2- Fe2O3/GNP, mẫu vật liệu TFG20 với hàm lượng GNP là 20 mg được lựa chọn cho các quá trình đánh giá này. Một số yếu tố ảnh hưởng đến khả năng chuyển hóa Cr(VI) như hàm lượng GNP, đặc trưng hình thái học, kích thước, độ tinh thể của vật liệu tổ hợp đã được đề cập trong nội dung phần 3.1.3. Các điều kiện khảo sát trong phần này bao gồm độ pH của dung dịch phản ứng, nồng độ Cr(VI) ban đầu, hàm lượng xúc tác TFG20 sử
dụng, cường độ chiếu sáng, bước sóng ánh sáng, ảnh hưởng của tác nhân nhận lỗ trống...
3.2.1.1. Ảnh hưởng của pH dung dịch
Ảnh hưởng của pH đến quá trình xử lý Cr(VI) được đánh giá bằng quá trình thực nghiệm với các mẫu có hàm lượng đầu Cr(VI) là 10 ppm, hàm lượng xúc tác sử dụng 1 g/L, thời gian xử lý là 90 phút, có độ pH khác nhau, thay đổi trong dải từ 2 đến 10. Đồ thị xác định ảnh hưởng của pH được được thể hiện trong hình 3.38, khu vực “bóng tối” chính là khoảng thời gian để đạt cân bằng hấp phụ-giải hấp, khu vực “chiếu sáng” là khoảng thời gian diễn ra quá trình quang khử.
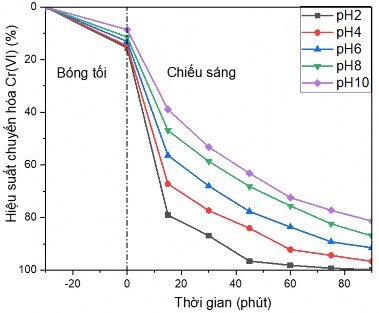
Hình 3.38. Đồ thị ảnh hưởng của pH đến khả năng xử lý Cr(VI)
Khu vực “bóng tối” trên đồ thị 3.38 cho thấy trong dải pH từ 2 đến 10 vật liệu TFG20 đều có khả năng hấp phụ ion Cr(VI), hiệu suất cao nhất khi pH môi trường là 2, hiệu suất hấp phụ giảm dần khi pH môi trường tăng lên.
Khu vực “chiếu sáng” trên đồ thị 3.38 cho thấy hiệu quả xúc tác quang chuyển hóa của vật liệu vật liệu tổ hợp TiO2- Fe2O3/GNP.
Hiệu ứng quang xúc tác cao nhất đạt được đối với mẫu chuyển hóa trong môi trường pH2. Khi pH của môi trường tăng lên hoạt tính quang xúc tác khử
2-
Cr(VI) của vật liệu giảm dần. Điều này được giải thích là do mối tương quan tỷ lệ giữa các anion HCrO4- và Cr2O72-. Sự có mặt của ion Cr2O7 trong dung dịch ở pH thấp có thể khử dễ dàng được chỉ ra là do thế khử tiêu chuẩn cao như trong phương trình phản ứng sau:
Cr2O72- + 6e + 14 H+ = 2 Cr3+ + 7 H2O (E0 = + 1,33 V ) (3.7)
-
2-
2- -
Quá trình tăng khả năng khử Cr(VI) trong pH thấp là do sự gia tăng số lượng các phần tử TiOH và kết quả tạo ra nhiều electron quang sinh hơn. Sự suy giảm hiệu quả quang khử khi pH cao hơn 5 có thể là do sự hình thành anion CrO42- và ion TiO- trên bề mặt của TiOH và dẫn đến sự kết tủa Cr(OH)3, lớp kết tủa này tạo thành sẽ ngăn cản sự tiếp xúc của vật liệu với nguồn sáng và do đó làm giảm hiệu quả quang khử Cr (VI). Mặt khác khi pH tiếp tục tăng lên hiệu ứng quang khử càng giảm là do ở pH cao xu hướng tạo thành anion CrO42- càng tăng mà anion này có khả năng khử yếu hơn nhiều so với HCrO4 và Cr2O7 do thế khử chuẩn của nó thấp, thể hiện ở phản ứng dưới đây.
CrO4 + H2O + 3 e →Cr(OH)3 + 5OH (E0 = +0,13 V) [112] (3.8)
3.2.1.2. Ảnh hưởng của nồng độ dung dịch ban đầu
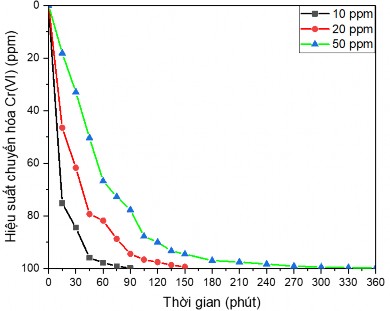
Hình 3.39. Biểu đồ ảnh hưởng của nồng độ Cr(VI) ban đầu đến hiệu suất chuyển hóa
Trên hình 3.39 là đồ thị so sánh ảnh hưởng của nồng độ đầu đến khả năng chuyển hóa Cr(VI), các giá trị nồng độ lựa chọn khảo sát bao gồm 10ppm, 20 ppm và 50 ppm. Mốc “0” về nồng độ và thời gian tại đó mà các mẫu đã đặt căn bằng hấp phụ và giải hấp.
Qua đồ thị có thể thấy sau thời gian 90 phút, mẫu ở nồng độ 10 ppm có hiệu suất chuyển hóa đạt 99,8%, trong khi thời gian để đạt hiệu suất chuyển hóa 99,4% đối với mẫu 20 ppm là 150 phút và đạt 99,7% với mẫu 50 ppm là 360 phút.
Hằng số tốc độ của quá trình quang xúc tác xử lý Cr (VI) trong môi trường nước với nồng độ loãng được xác định qua phương trình Langmuir– Hinshelwood bậc nhất theo đồ thị mối quan hệ giữa hàm ln(Ct/C0) với thời gian.
kt= -ln(Ct/C0)
Trong đó Ct là hàm lượng Cr (VI) tại thời điểm t và C0 là hàm lượng của các ion trên tại thời điểm bắt đầu quá trình xúc tác quang (ở đây chính là thời điểm sau khi đạt hấp phụ cực đại.
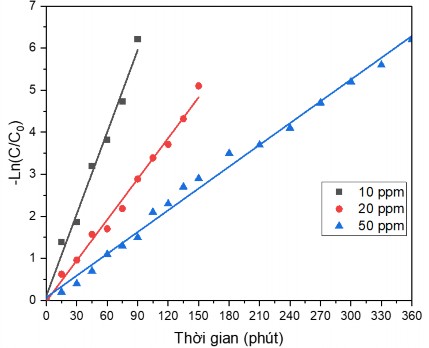
Hình 3.40. Ảnh hưởng của nồng độ đầu đến mối quan hệ - Ln(C/C0) và thời gian
Để xác định được hàm lượng xử lý tối ưu, tiến hành xác định phương trình động học và hằng số tốc độ phản ứng. Kết quả xác định hằng số tốc độ phản ứng được thể hiện trên hình 3.40. Hằng số tốc độ phản ứng tương ứng với nồng độ đầu 10 ppm; 20 ppm và 50 ppm lần lượt là 0,0649 (phút-1); 0,0323 (phút-1) và 0,0173 (phút-1). Như vậy, nồng độ đầu tối ưu cho quá trình xử lý Cr(VI) là 10 ppm.
3.2.1.3. Ảnh hưởng của hàm lượng tác nhân nhận lỗ trống
Ảnh hưởng của hàm lượng tác nhân nhận lỗ trống đến khả năng quang khử Cr(VI) được thể hiện trên đồ thị ở hình 3.41.
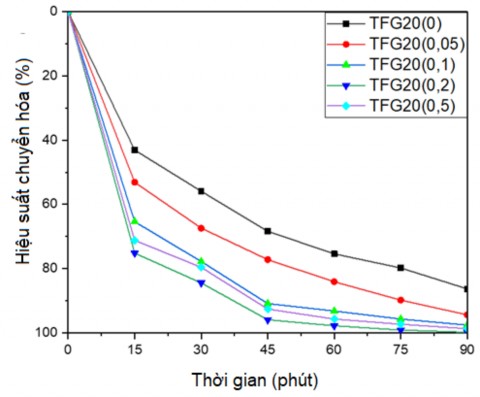
Hình 3.41. Đồ thị ảnh hưởng của tác nhân nhận lỗ trống đến khả năng quang xúc tác chuyển hóa Cr(VI)
Như trên đồ thị, có thể thấy rằng hiệu quả xử lý Cr(VI) tăng lên khi hàm lượng etanol tăng lên. Theo các tài liệu đã chỉ ra, etanol đóng vai trò chất tiêu thụ lỗ trống giúp tiêu hao các lỗ trống quang sinh được tạo thành trên bề mặt của vật liệu xúc tác. Khi chưa có mặt etanol hiệu ứng quang khử thấp do sự
cạnh tranh của các lỗ trống quang sinh và ion Cr(VI) để tiếp xúc với các electron quang sinh. Do sự dư thừa các lỗ trống quang sinh mà sự tái tổ hợp của các lỗ trống này với các electron quang sinh diễn ra nhanh hơn và vì thế hiệu quả quang xúc tác của vật liệu quang xúc tác cũng giảm theo. Khi có mặt etanol, etanol là chất hữu cơ nó sẽ phản ứng với các lỗ trống quang sinh để tạo thành các sản phẩm phân hủy như CO2 và H2O, do đó sẽ tiêu thụ bớt các lỗ trống quang sinh ngăn cản sự tái tổ hợp và sự cạnh tranh giữa lỗ trống quang sinh và các ion Cr(VI) với các electron quang sinh cũng giảm đi vì vậy hiệu quả quang xúc tác cũng được nâng cao.
Lượng etanol tối ưu sử dụng sẽ phụ thuộc vào lượng electron quang sinh được tạo ra, mà đối với lượng xúc tác sử dụng 0,1g/L vật liệu xúc tác tổ hợp TiO2- Fe2O3/GNP là 0,2 mL (1%). Qua đồ thị ta có thể thấy khi tăng dần hàm lượng etanol từ 0,05 mL lên 0,2 mL, hiệu quả quang khử tăng mạnh, phần trăm Cr(VI) được khử cũng tăng rõ rệt. Khi tăng hàm lượng etanol từ 0,2 lên 0,5 mL, sự tăng phần trăm Cr(VI) bị khử cũng tăng lên nhưng sự gia tăng này không thay đổi đáng kể. Vì vậy ta lựa chọn lượng chất tiêu thụ lỗ trống tối ưu trong trường hợp này là 0,2 mL etanol.
3.2.1.4. Ảnh hưởng của hàm lượng xúc tác quang
Ảnh hưởng của hàm lượng xúc tác quang được thể hiện trên hình 3.42. Kết quả chỉ ra rằng khi lượng xúc tác tăng từ 0,5 đến 1 g/L, hiệu quả xử lý Cr(VI) tăng lên rõ rệt.
Đối với mẫu sử dụng lượng xúc tác là 0,5 g/L, sau 90 phút xử lý, hiệu quả chỉ đạt 79,8%. Đối với mẫu sử dụng lượng xúc tác là 0,75g/L, cùng thời gian đó hiệu suất xử lý đạt 89,8%. Mẫu sử dụng 1g/L xúc tác TFG, hiệu quả đạt tới 99,8%. Điều này được giải thích là do khi tăng lượng xúc tác lên sẽ làm tăng số lượng photon trên bề mặt xúc tác và do đó nó sẽ làm tăng số lượng tâm hoạt tính trên bề mặt chất xúc tác, mặt khác nó còn làm tăng lượng ion Cr(VI) được hấp phụ trên bề mặt. Và vì vậy, hiệu suất xử lý tăng lên một cách rõ rệt.