Kết quả thực nghiệm ngoài đồng ruộng cho thấy, sinh trưởng và phát triển của chanh dây vi ghép với cành ghép là đốt thân chứa chồi nách và chanh dây vi ghép với cành ghép là chồi đỉnh không có sự khác biệt. Tuy nhiên trong nghiên cứu này, chanh dây vi ghép với cành ghép là đốt thân chứa chồi nách được lựa chọn sử dụng cho mục đích nhân giống chanh dây vi ghép sạch virus.
Từ kết quả ghi nhận được ở nội dung 2, quy trình nhân giống cây chanh dây vi ghép sạch virus thông qua kỹ thuật nuôi cấy mô phân sinh đỉnh, nuôi cấy TCL và vi ghép được đề xuất ở hình 3.47 như sau:
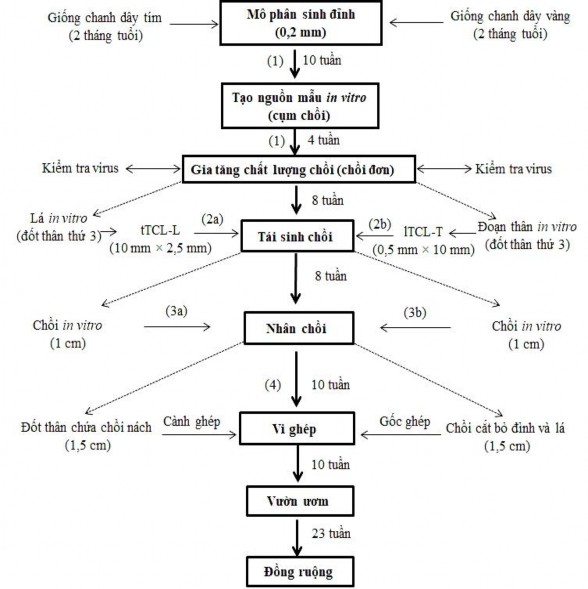
Hình 3.47. Sơ đồ quy trình nhân giống chanh dây vi ghép sạch virus thông qua kỹ thuật nuôi cấy mô phân sinh đỉnh, nuôi cấy TCL và vi ghép.
Mô tả quy trình:
(1) Tạo nguồn mẫu chồi in vitro từ nuôi cấy mô phân sinh đỉnh: mô phân sinh đỉnh (0,2 mm) được tách từ đỉnh sinh trưởng của giống chanh dây tím và vàng (2 tháng tuổi) ngoài đồng ruộng, không khử trùng bề mặt và được nuôi cấy trên môi trường MS bổ sung 1,0 mg/L BA, 30 g/L sucrose và 8 g/L agar trong 10 tuần để tạo chồi. Sau đó, chồi này được cấy chuyền sang môi trường MS bổ sung 1,0 mg/L BA sau 4 tuần để gia tăng chất lượng chồi và tiến hành kiểm tra virus.
(2a, 2b) Tái sinh chồi: mẫu tTCL-L (giống chanh dây tím) và mẫu lTCL-T (giống chanh dây vàng) từ đốt thân thứ 3 của chồi in vitro sạch virus ở 2 giống chanh dây được nuôi cấy trên môi trường tái sinh chồi (giống phần 2a, 2b đã mô tả ở quy trình trên hình 3.33) sau 8 tuần.
(3a, 3b) Nhân nhanh chồi: chồi in vitro (kích thước 1 cm) sạch virus của giống chanh dây tím và vàng thu nhận ở trên được nuôi cấy trên môi trường nhân nhanh chồi (giống phần 3a, 3b đã mô tả ở quy trình trên hình 3.33) sau 8 tuần để tạo số lượng lớn chồi sạch virus, đồng nhất và làm vật liệu cho kỹ thuật vi ghép.
(4) Vi ghép: cành ghép là đốt thân chứa chồi nách (kích thước 1,5 cm) của giống chanh dây tím ghép vào gốc ghép là chồi đã cắt bỏ đỉnh và lá (kích thước 1,5 cm) của giống chanh dây vàng và được cố định bởi ống nhựa PVC vô trùng (đường kính 2 mm, dài 5 mm). Những mẫu vi ghép này được nuôi cấy trên môi trường MSM bổ sung 2,5 mg/L IBA, 30 g/L sucrose và 8 g/L agar sau 10 tuần để tạo cây vi ghép hoàn chỉnh. Những cây vi ghép này sẽ được trồng thích nghi ở vườn ươm (10 tuần) và trồng thử nghiệm ngoài đồng ruộng sau 23 tuần.
Có thể bạn quan tâm!
-
 Ảnh Hưởng Của Ánh Sáng Led Lên Chất Lượng Cây Con In Vitro
Ảnh Hưởng Của Ánh Sáng Led Lên Chất Lượng Cây Con In Vitro -
 Sơ Đồ Quy Trình Nhân Giống Chanh Dây Tím Và Vàng Thông Qua Kỹ Thuật Nuôi Cấy Tcl.
Sơ Đồ Quy Trình Nhân Giống Chanh Dây Tím Và Vàng Thông Qua Kỹ Thuật Nuôi Cấy Tcl. -
 Kết Quả Điện Di Trên Gel Agarose Của Các Mẫu Giống Chanh Dây Tím Và Vàng Đối Với Potyvirus.
Kết Quả Điện Di Trên Gel Agarose Của Các Mẫu Giống Chanh Dây Tím Và Vàng Đối Với Potyvirus. -
 Nghiên cứu nhân giống cây chanh dây Passiflora edulis bằng kỹ thuật nuôi cấy lớp mỏng tế bào và thử nghiệm tạo cây vi ghép - 20
Nghiên cứu nhân giống cây chanh dây Passiflora edulis bằng kỹ thuật nuôi cấy lớp mỏng tế bào và thử nghiệm tạo cây vi ghép - 20 -
 Nghiên cứu nhân giống cây chanh dây Passiflora edulis bằng kỹ thuật nuôi cấy lớp mỏng tế bào và thử nghiệm tạo cây vi ghép - 21
Nghiên cứu nhân giống cây chanh dây Passiflora edulis bằng kỹ thuật nuôi cấy lớp mỏng tế bào và thử nghiệm tạo cây vi ghép - 21 -
 Kết Quả Phân Tích Thống Kê Khả Năng Khử Trùng Các Nguồn Mẫu Của Chanh Dây Tím Sau 4 Nuôi Cấy
Kết Quả Phân Tích Thống Kê Khả Năng Khử Trùng Các Nguồn Mẫu Của Chanh Dây Tím Sau 4 Nuôi Cấy
Xem toàn bộ 242 trang tài liệu này.
KẾT LUẬN VÀ KIẾN NGHỊ
KẾT LUẬN
Từ những kết quả thu được, một số kết luận được rút ra như sau:
Kết luận 1: Vi nhân giống chanh dây tím và vàng từ đốt thân chứa chồi nách đã được thực hiện thành công bằng kỹ thuật nuôi cấy TCL
Khử trùng mẫu bằng AgNPs (200 mg/L) trong thời gian 15 phút thích hợp cho tạo nguồn mẫu in vitro từ đốt thân chứa chồi nách.
Mẫu tTCL-L (giống chanh dây tím) và mẫu lTCL-T (giống chanh dây vàng) thu được ở đốt thân thứ 3 cho hiệu quả tái sinh cao nhất trên môi trường MS bổ sung 1,0 mg/L BA (giống chanh dây tím) hoặc 1,5 mg/L BA, 1,0 mg/L NAA (giống chanh dây vàng), 2,0 mg/L AgNPs, 30 g/L sucrose, 8 g/L agar dưới ánh sáng huỳnh quang (16 giờ/ngày).
Chồi được nhân nhanh hiệu quả trên môi trường MSM bổ sung 0,5 mg/L BA (giống chanh dây tím) hoặc 1,0 mg/L BA (giống chanh dây vàng), 1,5 mg/L Kin, 30 g/L sucrose, 8 g/L agar trong bình nuôi cấy thoáng khí.
Hình thành rễ của chồi in vitro thích hợp trên môi trường MSM bổ sung 2,5 mg/L IBA, 30 g/L sucrose, 8 g/L agar dưới ánh sáng LED với tỷ lệ 70R:30B.
Cây con thích nghi và sinh trưởng tốt sau 10 tuần ở điều kiện vườn ươm.
Kết luận 2: Cây chanh dây lai sinh dưỡng giữa giống chanh dây tím và vàng bằng kỹ thuật vi ghép.
Chồi in vitro sạch virus (CMV, ToRSV và Potyvirus) của 2 giống chanh dây có nguồn gốc từ nuôi cấy mô phân sinh đỉnh và được tái sinh hiệu quả bằng kỹ thuật nuôi cấy TCL.
Cây chanh dây vi ghép được ghép từ cành ghép là đốt thân chứa chồi nách có kích thước 1,5 cm của giống chanh dây tím với gốc ghép là chồi cắt bỏ đỉnh, lá với kích thước 1,5 cm của giống chanh dây vàng và được nuôi cấy trên môi trường MSM bổ sung 2,5 mg/L IBA, 30 g/L sucrose và 8 g/L agar để tạo cây vi ghép.
Cây chanh dây vi ghép thích nghi, sinh trưởng và phát triển tốt khi trồng thử nghiệm ở giai đoạn vườn ươm và đồng ruộng.
KIẾN NGHỊ
Trong khuôn khổ giới hạn về kinh phí và thời gian nghiên cứu, nên luận án chỉ thực hiện ở các nội dung như đã trình bày. Do vậy, để nghiên cứu sâu, hoàn chỉnh và có khả năng ứng dụng cao hơn, một số kiến nghị được đề xuất như sau:
Kiểm tra nhiều hơn các loại virus gây bệnh trên cây chanh dây hiện nay đối với những mẫu chanh dây có nguồn gốc từ nuôi cấy mô phân sinh đỉnh.
Tiếp tục nghiên cứu các yếu tố ảnh hưởng đến tỷ lệ thành công của cây chanh dây vi ghép như nồng độ đường, chất điều hòa sinh trưởng thực vật bổ sung vào môi trường nuôi cấy; điều kiện chiếu sáng; kích thước của cành ghép; tiền xử lý cành ghép...
Triển khai, nhân rộng quy trình nhân giống chanh dây vi ghép sạch bệnh với số lượng lớn được tạo ra bằng kỹ thuật nuôi cấy mô phân sinh đỉnh kết hợp với nuôi cấy TCL và vi ghép. Tiến hành so sánh năng suất của giống chanh dây vi ghép với giống trồng đại trà hiện nay.
DANH MỤC CÁC CÔNG TRÌNH
1. Trần Hiếu, Hoàng Thanh Tùng, Cao Đăng Nguyên, Dương Tấn Nhựt (2018), Tạo nguồn mẫu in vitro cho giống chanh dây tím (Passiflora edulisSims.) và vàng (Passiflora edulis f. flavicarpa), Tạp chí Khoa học Đại học Huế: Khoa học Tự nhiên, 127(1C), tr. 71-84.
2. Tran Hieu, Do Thi Thuy Tam, Nguyen Thi Nhat Linh, Hoang Thanh Tung,
Huynh Gia Bao, Cao Dang Nguyen, Duong Tan Nhut (2018), Stimulation of shoot regeneration through leaf thin cell layer culture of Passiflora edulis Sims., Tạp chí Công nghệ Sinh học, 16(4), tr. 669-677.
3. Trần Hiếu, Hoàng Thanh Tùng, Cao Đăng Nguyên, Dương Tấn Nhựt
(2019), Cải thiện khả năng ra rễ in vitro và nâng cao tỷ lệ sống sót ngoài vườn ươm của cây chanh dây tím (Passiflora edulis Sims.) có nguồn gốc từ nuôi cấy lớp mỏng tế bào, Tạp chí Khoa học Công nghệ, Trường Đại học Khoa học, ĐH Huế, 15(2), tr. 97-110.
4. Trần Hiếu, Hoàng Thanh Tùng, Cao Đăng Nguyên, Dương Tấn Nhựt
(2019), Hiệu quả tái sinh chồi và vi nhân giống cây chanh dây tím (Passiflora edulis Sims.) thông qua nuôi cấy lớp mỏng tế bào đoạn thân cắt theo chiều dọc, Tạp chí Công nghệ Sinh học, 17(4), tr. 699-708.
5. Tran Hieu, Truong Hoai Phong, Hoang Dac Khai, Hoang Thanh Tung, Do
Manh Cuong, Vu Quoc Luan, Cao Dang Nguyen, Nguyen Ba Nam, Duong Tan Nhut (2021), An improved micropropagation of Passiflora edulis Sims. based on thin cell layer technology, Scientia Horticulturae (Submitted).
6. Tran Hieu, Truong Hoai Phong, Hoang Dac Khai, Nguyen Thi Nhu Mai, Do Manh Cuong, Vu Quoc Luan, Hoang Thanh Tung, Nguyen Ba Nam, Duong Tan Nhut (2021), Efficient production of in vitro vigorous passion fruit rootstock (Passiflora edulis f. Flavicarpa) for micrografting, Plant Cell, Tissue and Organ Culture (Submitted).
TÀI LIỆU THAM KHẢO
Tài liệu Tiếng Việt
1. Vũ Thị Hiền, Vũ Quốc Luận, Nguyễn Phúc Huy, Nguyễn Bá Nam, Nguyễn Thị Kim Loan, Nguyễn Thanh Sang, Vũ Thị Thủy, Nguyễn Hồng Hoàng, Thái Xuân Du, Dương Tấn Nhựt (2015), Sử dụng kỹ thuật nuôi cấy lớp mỏng tế bào trong nghiên cứu quá trình phát sinh hình thái của cây sâm Ngọc Linh (Panax vietnamensis Ha et Grushv.) in vitro, Tạp chí Khoa học và Phát triển, 3(4), tr. 657-664.
2. Lê Văn Tường Huân, Phạm Quang Vũ (2010), Nhân giống vô tính in vitro cây chanh dây (Passiflora edulis Sims.) sử dụng Đoạn thân mang chồi nách, Tạp chí Công nghệ Sinh học, 8(3), tr. 379-385.
3. Trịnh Thị Hương (2017), Nghiên cứu chuyển gen tạo rễ tơ sâm Ngọc Linh (Panax vietnamensis Ha et Grushv.) làm vật liệu cho nuôi cấy sinh khối, Luận án tiến sĩ sinh học, Viện Công nghệ Sinh học, Hà Nội.
4. Trần Công Khanh (1981), Thực tập hình thái giải phẫu thực vật, NXB. Đại học và trung học chuyên nghiệp, Hà Nội.
5. Dương Công Kiên (2003), Nuôi cấy mô thực vật, NXB. Đại học Quốc gia Thành phố Hồ Chí Minh.
6. Nguyễn Thị Nhật Linh (2018), Nuôi cấy rễ thứ cấp sâm Ngọc Linh (Panax vietnamensis Ha et Grushv.) và khảo sát ảnh hưởng của một số elicitor lên sự tích lũy saponin, Luận án tiến sĩ, Trường Đại học Khoa học, Đại học Huế.
7. Nguyễn Đức Lượng, Lê Thị Thủy Tiên (2006), Công nghệ tế bào, NXB. Đại học Quốc gia Thành phố Hồ Chí Minh.
8. Hà Thị Mỹ Ngân, Trần Đào Hồng Trinh, Đ Mạnh Cường, Hoàng Thanh T ng, Nguyễn Thị Nhật Linh, Vũ Thị Hiền, Vũ Quốc Luận, B i Văn Lệ, Dương Tấn Nhựt (2018), Hạn chế hiện tượng thủy tinh th và gia tăng tỉ lệ sống của cây con hoa Đồng tiền (gerbera jamesonii) nuôi cấy in vitro trong môi trường có bổ sung nano bạc, Tạp chí Công nghệ Sinh học, 16(3), tr. 1-9.
9. Dương Tấn Nhựt (2006), Hệ thống nuôi cấy lớp mỏng tế bào trong nghiên cứu tái sinh, nhân giống và chuyển gene thực vật, NXB. Nông nghiệp Thành phố Hồ Chí Minh.
10. Dương Tấn Nhựt (2010), Một số phương pháp, hệ thống mới trong nghiên cứu công nghệ sinh học thực vật, NXB. Nông Nghiệp Thành phố Hồ Chí Minh.
11. Dương Tấn Nhựt (2011), Công nghệ sinh học thực vật: Nghiên cứu cơ bản và ứng dụng, NXB. Nông nghiệp Thành phố Hồ Chí Minh.
12. Dương Tấn Nhựt, Dương Bảo Trinh, Đ Mạnh Cường, Hoàng Thanh Tùng, Nguyễn Phúc Huy, Vũ Thị Hiền, Vũ Quốc Luận, Lê Thị Thu Hiền, Nguyễn Hoài Châu (2018), Khảo sát nano bạc làm chất khử trùng mẫu mới trong nhân giống vô tính cây african violet (Saintpaulia ionantha H. Wendl.), Tạp chí Công nghệ Sinh học, 16(1), tr. 87-97.
13. Dương Tấn Nhựt, Hồ Thanh Tâm, Nguyễn Thị Thanh Hiền, Lê Kim Cương,Vũ Quốc Luận, Nguyễn Bá Nam, Nguyễn Phúc Huy, Vũ Thị Hiền, Trịnh Thị Hương, Nguyễn Hồng Hoàng, Nguyễn Xuân Tuấn, Nguyễn Thanh Sang, Nguyễn Việt Cường, Đ Mạnh Cường, Nguyễn Hoài Châu, Ngô Quốc Bưu (2014), Khảo sát ảnh hưởng của nano bạc lên sự sinh trưởng và phát tri n của cây Cúc, Dâu tây, Đồng tiền nuôi cấy in vitro, Tạp chí Công nghệ Sinh học, 12(1), tr. 103-111.
14. Nguyễn Thanh Sang, Nguyễn Bá Nam, Hoàng Thanh Tùng, Nguyễn Phúc Huy, Nguyễn Thị Kim Loan, Nguyễn Ngọc Thảo, Vũ Đức Trung, Nguyễn Văn An, Trần Thị Minh Loan, Nguyễn Văn Kết, Dương Tấn Nhựt (2014), Sinh trưởng, phát tri n và hàm lượng chlorophyll trong chồi cây Cúc (Chrysanthemum morifolium Ramat. cv. “Jimba”) nuôi cấy in vitro dưới ánh sáng LED, Tạp chí Công nghệ Sinh học, 12(2), tr. 339-347.
15. B i Trang Việt (2000), Sinh lý Thực vật đại cương, phần II: Phát triển, NXB. Đại học Quốc gia Thành phố Hồ Chi Minh.
Tài liệu Tiếng Anh
16. Aazami M.A., Bagher M.H. (2010), In vitro micrografting of some Iranian grapevine cultivars, Romanian Biotechnological Letters, 15(5), pp. 5576-5580.
17. Abdi G. (2012), Evaluation the potential of Nano silver for removal of bacterial contaminants in valerian (Valeriana officinalis L.) tissue culture, Journal of Biological & Environmental Sciences, 6(17), pp. 199-205.
18. Abdi G., Salehi H., Khosh-Khui M. (2008), Nano silver: a novel nano material for removal of bacterial contaminants in valerian (Valeriana officinalis L.) tissue culture, Acta Physiologiae Plantarum, 30(5), pp. 709-714.
19. Aghdaei M., Salehi H., Sarmast M.K. (2012), Effects of silvernanoparticles on Tecomella undulata (Roxb.) Seem. Micropropagation, Advances in Horticultural Science, 26(1), pp. 21-24.
20. Ahn I.O., Le B.V., Gendy C., Tran Thanh Van K. (1996), Direct somatic embryogenesis through thin cell layer culture in Panax ginseng, Plant Cell, Tissue and Organ Culture, 45(3), pp. 237-243.
21. Alvarenga I.C.A., Pacheco F.V., Silva S.T., Bertolucci S.K.V., Pinto J.E.B.P. (2015), In vitro culture of Achillea millefolium L.: quality and intensity of light on growth and production of volatiles, Plant Cell, Tissue and Organ culture, 122(2), pp. 299-308.
22. Amiri M.E. (2007), Special microgrfting technique for cherry (Prunus avium
L.), Acta Horticulturae, 764(764), pp. 151-154.
23. Anand S.P., Jayakumar E., Jeyachandran R., Nandagobalan V., Doss A. (2012), Direct organogenesis of Passiflora foetida L. through nodal explants, Plant Tissue Culture and Biotechnology, 22(1), pp. 87-91.
24. Antoniazzi C.A., De Faria R.B., De Carvalhoa P.P., Mikovski A.I., De Carvalho I.F., De Matos E.M., Reis A.C., Viccini L.F., Pintod D.L.P., Rochae D.I., Otoni W.C., Da Silva M.L. (2018), In vitro regeneration of triploid plants from mature endosperm culture of commercial passion fruit (Passiflora edulis Sims.), Scientia Horticulturae, 238(1), pp. 408-415.
25. Appezzato-da-Glória B., Vieira M.L.C., Dornelas M.C. (1999), Anatomical studies of in vitro morphogenesis in leaf explants of passion fruit, Pesquisa Agropecuária Brasileira, 34(11), pp. 2007-2013.