điện ổn định được gọi là đường cong: dòng - thế dừng, cho phép xác định tốc độ của phản ứng khử các chất oxy hoá trên điện cực nghiên cứu.
* Trong môi trường axit
Các hình 3.10 đến 3.13 biểu diễn đường cong dòng - thế dừng được đo trong các dung dịch có pH khác nhau có và không sục khí oxy, trên các điện cực Ppy có và không có oxit phức hợp.
Trong môi trường axit, nồng độ H+ tương đối lớn, do đó, tại điện thế catôt đủ lớn, thông thường bên cạnh phản ứng khử oxy còn có phản ứng khử ion H+ tạo thành khí H2.
Trong môi trường pH2 (hình 3.10), nhìn chung dòng điện catôt khi có sục khí oxy luôn lớn hơn nhiều so với dòng điện catôt khi không sục khí oxy. Từ đó có thể suy ra khi sục khí oxy, quá trình diễn ra chủ yếu trên catôt là quá trình khử oxy hoà tan. Điều đó hoàn toàn hợp lý vì khi không sục khí oxy, trong dung dịch chỉ có ion H+ và một lượng oxy hoà tan rất nhỏ, tương ứng
với dòng catôt phản hồi thu được rất nhỏ (lớn nhất là
0,25
mA/cm2).
Khi không sục khí oxy, sự khác biệt về khả năng xúc tác cho quá trình khử của màng Ppy chứa và không chứa oxit là không đáng kể (các đường cong rất gần nhau).
Trong trường hợp có sục khí oxy, hàm lượng oxy tăng, kéo theo dòng catôt tăng mạnh bắt đầu từ điện thế +0,2 V/SCE, tương ứng với phản ứng khử oxy hoà tan trong dung dịch, điều này được xác nhận bằng sự có mặt của H2O2 nhờ sự nhận biết định tính bằng thuốc thử KI + hồ tinh bột có mặt xúc tác Na2MoO4 theo phương trình sau:
H2O2 + 2KI I2 + 2KOH (3.10)
I2 + hồ tinh bột dung dịch màu xanh đen (3.11)
Ngoài ra, khi có sục khí oxy, mật độ dòng catôt của màng Ppy chứa oxit luôn lớn hơn dòng catôt của màng Ppy không chứa oxit. Kết quả này
chứng tỏ rằng, màng composit Ppy(Cu1,5Mn1,5O4)/Ppy có khả năng xúc tác cho quá trình khử oxy hòa tan tốt hơn màng Ppy không chứa oxit phức hợp Cu1,5Mn1,5O4.
Kết quả khảo sát mật độ dòng catôt tại các điện thế áp đặt cho thấy, trong khoảng điện thế áp đặt từ -0,4 V/SCE đến -0,5 V/SCE, dòng catôt hầu như không tăng. Điều này có thể giải thích như sau: trong dung dịch có chứa H+ và oxy hoà tan, trong khoảng điện thế áp đặt này có thể xảy ra các phản ứng (1.44) và (3.12):
H2O2 | E0 = + 0,682 V/SHE (+ 0,441 V/SCE) | (1.44) | ||
2H+ + 2e | H2 | E0 = 0 V/SHE (- 0,241 V/SCE ) | (3.12) |
Có thể bạn quan tâm!
-
 Sơ Đồ Phân Tán Chất Xúc Tác Điện Hóa Trong Màng Polyme Dẫn Cấu Trúc Xốp Và Diện Tích Bề Mặt Lớn Của Nhiều Loại Polyme Dẫn Đã Tạo
Sơ Đồ Phân Tán Chất Xúc Tác Điện Hóa Trong Màng Polyme Dẫn Cấu Trúc Xốp Và Diện Tích Bề Mặt Lớn Của Nhiều Loại Polyme Dẫn Đã Tạo -
 Hiện Tượng Các Tia X Nhiễu Xạ Trên Các Mặt Tinh Thể Chất Rắn Phương Pháp Nhiễu Xạ Tia X Là Phương Pháp Phân Tích Không Phá Hủy
Hiện Tượng Các Tia X Nhiễu Xạ Trên Các Mặt Tinh Thể Chất Rắn Phương Pháp Nhiễu Xạ Tia X Là Phương Pháp Phân Tích Không Phá Hủy -
 Bảng So Sánh Chỉ Số Mặt Phẳng Mạng Tinh Thể (Hkl) Của Oxit Phức Hợp Của Cu Và Mn, Oxit Spinel Và Cuo
Bảng So Sánh Chỉ Số Mặt Phẳng Mạng Tinh Thể (Hkl) Của Oxit Phức Hợp Của Cu Và Mn, Oxit Spinel Và Cuo -
 Các Đường Cong Phân Cực Catôt Trên Điện Cực Cacbon.
Các Đường Cong Phân Cực Catôt Trên Điện Cực Cacbon. -
 Ảnh Hưởng Của Vật Liệu Catôt Đến Sự Biến Thiên Hiệu Suất Suy Giảm Cod Và Hiệu Suất Dòng Theo Thời Gian Khoáng Hóa Metyl Đỏ 0,35 Mm
Ảnh Hưởng Của Vật Liệu Catôt Đến Sự Biến Thiên Hiệu Suất Suy Giảm Cod Và Hiệu Suất Dòng Theo Thời Gian Khoáng Hóa Metyl Đỏ 0,35 Mm -
 Ảnh Hưởng Của Mật Độ Dòng Áp Đặt Đến Sự Biến Thiên Hiệu Suất Suy Giảm Cod Và Hiệu Suất Dòng Khoáng Hóa Metyl Đỏ Theo Điện Lượng Q
Ảnh Hưởng Của Mật Độ Dòng Áp Đặt Đến Sự Biến Thiên Hiệu Suất Suy Giảm Cod Và Hiệu Suất Dòng Khoáng Hóa Metyl Đỏ Theo Điện Lượng Q
Xem toàn bộ 165 trang tài liệu này.
Nếu chỉ so sánh E0 mà chưa xét đến quá thế và nồng độ các chất tham gia phản ứng, quá trình khử oxy hòa tan tạo H2O2 dễ dàng hơn quá trình khử H+ tạo H2. Do đó, ở khoảng điện thế từ -0,4 đến -0,5 V/SCE, quá trình khử H+
tạo H2 xảy ra mạnh. Lúc này nồng độ H+ đã giảm do bị mất đi trong quá trình
khử oxy hoà tan, ngoài ra khí H2 sinh ra bám vào bề mặt điện cực làm giảm diện tích tiếp xúc của bề mặt điện cực với dung dịch nên sự khử nói chung bị suy giảm dẫn đến dòng catôt tổng cộng không tăng mặc dù điện thế áp đặt được đưa về phía âm hơn. Kết quả này hoàn toàn phù hợp với công bố của H. Nguyen Cong và các cộng sự năm 2005 [115].
Kết quả khảo sát quá trình khử catôt trên các điện cực khác nhau Ppy và Ppy(Cu1,5Mn1,5O4)/Ppy trong các dung dịch có pH3,4,6 (hình 3.11, 3.12 và 3.13) cũng cho kết quả tương tự trường hợp dung dịch có pH2. Dòng catôt phản hồi thu được khi sục khí oxy lớn hơn rất nhiều so với trường hợp không sục khí oxy. Trong môi trường axit tại các giá trị pH của dung dịch khảo sát, điện cực phủ màng Ppy chứa oxit phức hợp luôn có khả năng xúc tác cho các quá trình khử oxy trên catôt tốt hơn so với điện cực chỉ phủ màng Ppy.
Các kết quả thu được chứng tỏ màng Ppy(Cu1,5Mn1,5O4)/Ppy có khả năng xúc tác cao hơn so với màng Ppy đối với quá trình khử oxy hòa tan tạo H2O2,
đặc biệt trong dung dịch pH3. Kết quả khảo sát mở ra triển vọng chế tạo điện cực composit Ppy(Cu1,5Mn1,5O4)/Ppy ứng dụng trong xử lý hợp chất hữu cơ gây ô nhiễm bằng hiệu ứng Fenton điện hóa.
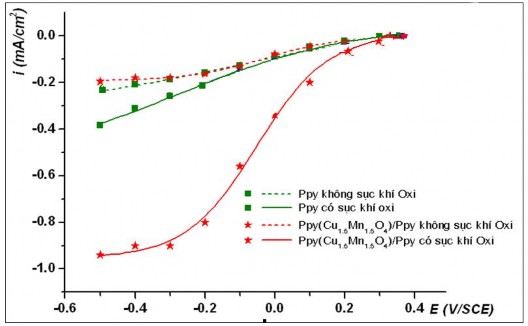
Hình 3.10. Sự biến đổi mật độ dòng catôt tại các điện thế áp đặt trong dung dịch Na2SO4 0,05 M, tại pH2
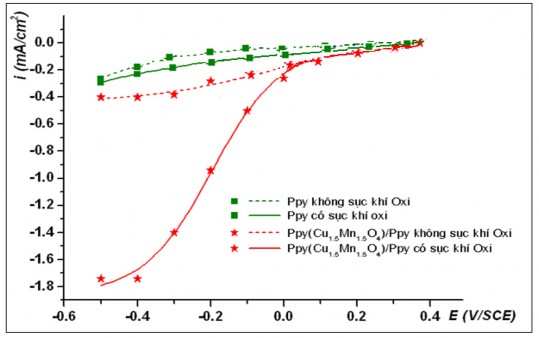
Hình 3.11. Sự biến đổi mật độ dòng catôt tại các điện thế áp đặt trong dung dịch Na2SO4 0,05 M, tại pH3
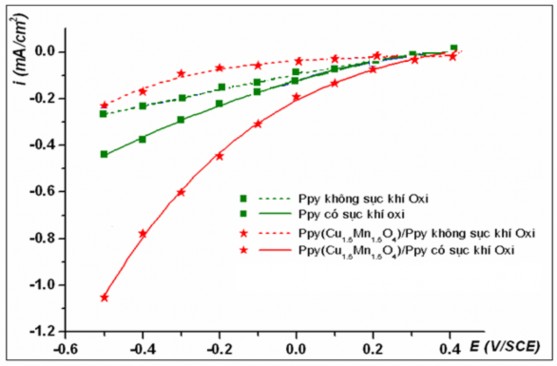
Hình 3.12. Sự biến đổi mật độ dòng catôt tại các điện thế áp đặt trong dung dịch Na2SO4 0,05 M, tại pH4
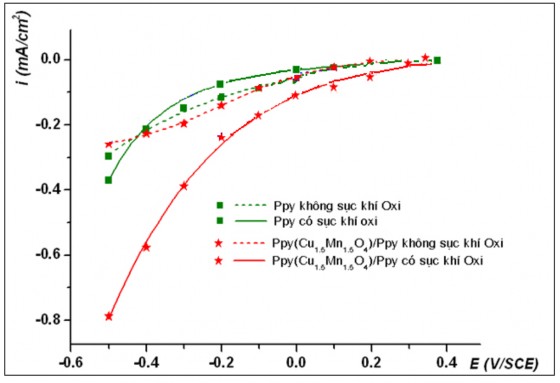
Hình 3.13. Sự biến đổi mật độ dòng catôt tại các điện thế áp đặt trong dung dịch Na2SO4 0,05 M, tại pH6
* Trong môi trường kiềm
Kết quả khảo sát quá trình khử catôt trên hai điện cực Ppy và Ppy(Cu1,5Mn1,5O4)/Ppy trong dung dịch có pH8 được biểu diễn trên hình 3.14.
Trong môi trường kiềm yếu, nồng độ H+ rất nhỏ nên dòng catôt phản hồi thu được chủ yếu là dòng khử oxy hoà tan.
Kết quả thu được tương tự như kết quả thu được trong môi trường axit. Khi sục khí oxy, dòng catôt âm hơn so với khi không sục khí oxy, chứng tỏ quá trình xảy ra trên catôt chủ yếu là quá trình khử oxy hoà tan.
Ngoài ra, trong môi trường kiềm, quá trình khử oxy hoà tan trên điện cực phủ màng Ppy(Cu1,5Mn1,5O4)/Ppy cũng tốt hơn so với màng không có oxit. Điều này chứng tỏ các oxit phức hợp có cấu trúc spinel cũng có khả năng xúc tác điện hoá tốt cho phản ứng khử oxy hoà tan tạo H2O2 trong môi trường kiềm, tuy nhiên dòng catôt thu được trong môi trường kiềm thấp hơn rất nhiều so với dòng catôt thu được trong môi trường axit.
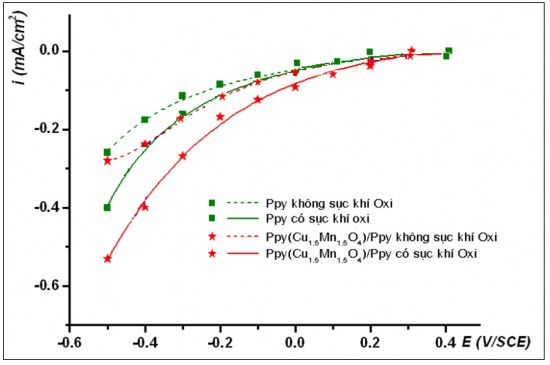
Hình 3.14. Sự biến đổi mật độ dòng catôt tại các điện thế áp đặt trong dung dịch Na2SO4 0,05 M, tại pH8
b/ Khả năng xúc tác của điện cực C/Ppy(Cu1.5Mn1.5O4)/Ppy tại -0,5 V/SCE
Kết quả thực nghiệm cho thấy: điện cực có phủ màng Ppy chứa oxit phức hợp Cu1.5Mn1.5O4 có khả năng xúc tác tốt hơn màng Ppy không chứa oxit. Khi áp điện thế càng âm (đến -0,5V/SCE) thì dòng catôt tổng thu được càng lớn. Điều đó hoàn toàn hợp lý bởi vì, điện thế catôt càng âm thì các quá trình trên catôt xảy ra càng nhiều và càng mạnh.
Tại điện thế áp đặt E = -0,5 V/SCE, tiến hành so sánh các giá trị mật độ dòng catôt phản hồi trên điện cực phủ màng Ppy(Cu1.5Mn1.5O4)/Ppy trong hai trường hợp không và có sục oxy với tốc độ 1 l/phút ở các giá trị pH khác nhau, kết quả được biểu diễn trên hình 3.15.
Do trong dung dịch có môi trường axit, ngoài oxy hoà tan được sục vào còn có một lượng đáng kể ion H+, do đó dòng catôt thể hiện trong đồ thị trên đều là dòng tổng hợp của nhiều quá trình. Để so sánh khả năng xúc tác cho quá trình khử oxy hoà tan trên 2 loại điện cực, cần hiệu chỉnh lại đồ thị này.
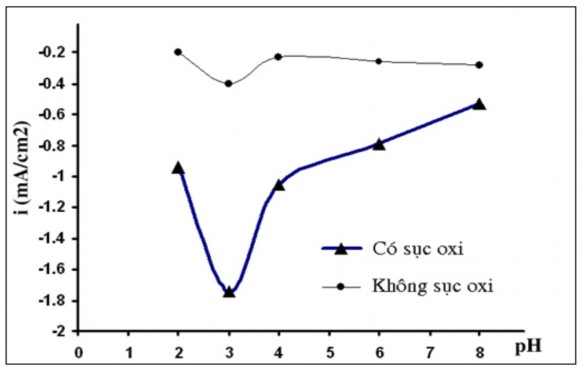
Hình 3.15. Sự biển đổi mật độ dòng catôt Ppy(Cu1.5Mn1.5O4)/Ppy theo pH ở điện thế -0,5 V/SCE
Trong trường hợp không sục khí oxy, một cách gần đúng có thể coi lượng oxy không khí hoà tan trong dung dịch là rất nhỏ. Khi đó dòng catôt thu được có thể coi chủ yếu là các quá trình phụ khác (ví dụ quá trình khử ion H+ tạo H2). Khi tiến hành sục oxy, tại một điện thế áp đặt nhất định, các quá trình phụ cơ bản vẫn diễn ra. Tuy nhiên, do lượng oxy hoà tan tăng lên rất nhiều nên dòng catôt thu được cũng chuyển mạnh về phía âm hơn (giá trị tuyệt đối tăng). Có thể coi gần đúng, hiệu số của dòng catôt thu được khi sục oxy và dòng catôt khi không sục oxy là dòng catôt của quá trình khử oxy hoà tan như được biểu diễn trên hình 3.16.
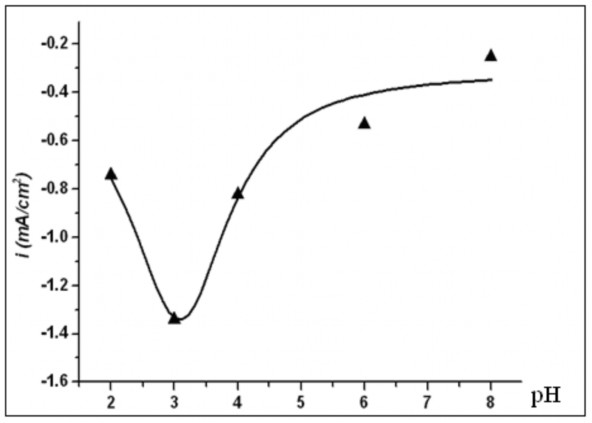
Hình 3.16. Sự biến đổi mật độ dòng catôt Ppy(Cu1.5Mn1.5O4)/Ppy theo pH đối với quá trình khử oxy hoà tan tại -0,5 V/SCE
Từ đồ thị hình 3.16 cho thấy, điện cực phủ màng Ppy(Cu1.5Mn1.5O4)/Ppy có khả năng xúc tác cho quá trình khử oxy hoà tan tốt nhất ở khoảng pH3. Trong khoảng pH này, điện cực Ppy(Cu1.5Mn1.5O4)/Ppy có thể được sử dụng để tạo H2O2 nhằm ứng dụng trong hiệu ứng Fenton điện hoá xử lý môi
trường ô nhiễm. Kết quả này phù hợp với các công bố gần đây của một số tác giả về ảnh hưởng của pH đến quá trình khử oxy trên catôt tạo H2O2 [7,8]. Với kết quả này, dung dịch pH3 được sử dụng cho các khảo sát tiếp theo.
3.2.3. Kết luận về tổng hợp và đặc tính của màng Ppy và Ppy(oxit)/Ppy:
+ Tổng hợp thành công màng Ppy và Ppy(Cu1,5Mn1,5O4)/Ppy bằng phương pháp điện hóa. Màng Ppy và Ppy(Cu1,5Mn1,5O4)/Ppy thu được phẳng, mịn, tương đối đồng đều.
+ Kết quả thực nghiệm cho thấy, điện cực catôt C/Ppy và C/Ppy(Cu1,5Mn1,5O4)/Ppy có khả năng xúc tác điện hóa đối với quá trình khử oxy hòa tan tạo H2O2 tốt nhất trong dung dịch pH3. Trong đó, điện cực C/Ppy(Cu1,5Mn1,5O4)/Ppy có khả năng xúc tác tốt hơn so với điện cực C/Ppy.
3.3. Đặc tính điện hóa của điện cực anôt platin và điện cực catôt cacbon trong dung dịch nền Na2SO4, pH3
Trước khi nghiên cứu khoáng hoá các hợp chất azo bằng phương pháp điện hoá trong dung dịch Na2SO4 pH3, các đặc tính điện hoá của điện cực anôt platin và điện cực catôt nền cacbon đã được khảo sát lần lượt trong 3 dung dịch:
+ Na2SO4 0,05 M, pH3;
+ Na2SO4 0,05 M, pH3, chứa metyl đỏ 0,35 mM;
+ Na2SO4 0,05 M, pH3 chứa metyl đỏ 0,35 mM và FeSO4 1 mM.
3.3.1. Các phản ứng trên anôt platin
Hình 3.17 biểu diễn đường cong phân cực anôt trong 3 dung dịch tại pH3 có và không sục oxy, với tốc độ quét thế 5 mV/s.
Quan sát các đường cong cho thấy, trong dung dịch Na2SO4 0,05 M, tại thời điểm đầu quét thế anôt, dòng thu được xấp xỉ bằng không chứng tỏ không có phản ứng oxy hoá nào xảy ra. Khi điện thế anôt tăng đến 1,1 1,2