Quan sát đồ thị hình 3.30 cho thấy, với cùng một giá trị điện lượng chuyển qua bình là 0,25 A.h/l, ở mật độ dòng 1 mA/cm2 cho hiệu suất phân hủy đạt giá trị cao hơn (88 %) so với trường hợp áp đặt các mật độ dòng khác.
Kết quả thu được có thể giải thích là, khi mật độ dòng áp đặt đủ lớn sẽ thuận lợi cho quá trình khử oxy hoà tan tạo H2O2 trên điện cực catôt (phản ứng 3.6), làm tăng hiệu suất của quá trình xử lý metyl đỏ bằng hiệu ứng Fenton điện hoá, khi mật độ dòng áp đặt cao hơn sẽ xảy ra quá trình oxy hoá nước giải phóng oxy trên điện cực anôt (phản ứng 1.46) làm tiêu tốn điện lượng của quá trình khoáng hóa, đồng thời trên catôt xảy ra phản ứng khử ion H+ giải phóng khí hydro (phản ứng 3.12) làm giảm tốc độ của phản ứng tạo H2O2 (phản ứng 1.44). Vì vậy tốc độ hình thành gốc hydroxyl (phản ứng 1.6) giảm, do đó làm giảm hiệu suất phân huỷ metyl đỏ trong quá trình khoáng hóa.
Ảnh hưởng của mật độ dòng áp đặt đến sự biến thiên hiệu suất suy giảm COD và hiệu suất dòng điện trong quá trình khoáng hóa metyl đỏ trong dung dịch Na2SO4 0,05 M, Fe2+ 1mM, pH3, sử dụng catôt C/Ppy(Cu1,5Mn1,5O4)/Ppy được biểu diễn trên hình 3.31. Tại các giá trị điện lượng Q như nhau, hiệu suất suy giảm COD ở mật độ dòng áp đặt 1 mA/cm2 lớn hơn khá nhiều so với các trường hợp mật độ dòng áp đặt khác.
Ở giá trị điện lượng Q = 1,00 A.h/l, trong trường hợp áp đặt mật độ dòng 1 mA/cm2, hiệu suất suy giảm COD đạt 76 %. Trong khi đó, ở các mật độ dòng áp đặt 0,5; 5 và 10 mA/cm2, hiệu suất suy giảm COD đạt các giá trị tương ứng là 44 %; 68 % và 56 %.
Bên cạnh đó, ở mật độ dòng 1 mA/cm2 hiệu suất dòng khoáng hóa ở mọi thời điểm đều đạt giá trị cao nhất so với trường hợp áp đặt các mật độ dòng khác.
Quan sát bằng mắt thường (hình 3.32) cho thấy, sự suy giảm màu sắc của dung dịch metyl đỏ thay đổi rõ rệt từ hồng đậm sang hồng nhạt theo thời gian khoáng hóa, sau 5 giờ khoáng hóa ở mật độ dòng 1 mA/cm2, dung dịch
gần như mất màu hoàn toàn. Màu sắc của dung dịch thay đổi rất nhanh trong khoảng thời gian ngắn của quá trình khoáng hóa là do nồng độ của hợp chất metyl đỏ đã suy giảm gần như hoàn toàn tạo thành các hợp chất trung gian trước khi bị khoáng hóa hoàn toàn tạo thành CO2, H2O và các chất khoáng.
1 mA/cm2
5 mA/cm2
10 mA/cm2
0,5 mA/cm2
80 350
280
60
%COD
210
40 H%
140
20
70
0 0
0,00 0,25 0,50 0,75 1,00
Q (A.h/l)
Hình 3.31. Ảnh hưởng của mật độ dòng áp đặt đến sự biến thiên hiệu suất suy giảm COD và hiệu suất dòng khoáng hóa metyl đỏ theo điện lượng Q

Sau 1 giờ xử lý | Sau 2 giờ xử lý | Sau 5 giờ xử lý | |
Hình 3.32. Sự thay đổi màu sắc của dung dịch metyl đỏ theo thời gian khoáng hóa bằng hiệu ứng Fenton điện hóa với mật độ dòng áp đặt 1 mA/cm2 |
Có thể bạn quan tâm!
-
 Kết Luận Về Tổng Hợp Và Đặc Tính Của Màng Ppy Và Ppy(Oxit)/ppy:
Kết Luận Về Tổng Hợp Và Đặc Tính Của Màng Ppy Và Ppy(Oxit)/ppy: -
 Các Đường Cong Phân Cực Catôt Trên Điện Cực Cacbon.
Các Đường Cong Phân Cực Catôt Trên Điện Cực Cacbon. -
 Ảnh Hưởng Của Vật Liệu Catôt Đến Sự Biến Thiên Hiệu Suất Suy Giảm Cod Và Hiệu Suất Dòng Theo Thời Gian Khoáng Hóa Metyl Đỏ 0,35 Mm
Ảnh Hưởng Của Vật Liệu Catôt Đến Sự Biến Thiên Hiệu Suất Suy Giảm Cod Và Hiệu Suất Dòng Theo Thời Gian Khoáng Hóa Metyl Đỏ 0,35 Mm -
 Ảnh Hưởng Của Vật Liệu Catôt Đến Sự Biến Thiên Hiệu Suất Suy Giảm Cod Và Hiệu Suất Dòng Theo Thời Gian Khoáng Hóa Công Gô Đỏ 0,25 Mm
Ảnh Hưởng Của Vật Liệu Catôt Đến Sự Biến Thiên Hiệu Suất Suy Giảm Cod Và Hiệu Suất Dòng Theo Thời Gian Khoáng Hóa Công Gô Đỏ 0,25 Mm -
 Phổ Uv-Vis Của Metyl Da Cam Theo Thời Gian Khoáng Hóa Bằng Hiệu Ứng Fenton Điện Hóa Tại Mật Độ Dòng 1 Ma/cm 2
Phổ Uv-Vis Của Metyl Da Cam Theo Thời Gian Khoáng Hóa Bằng Hiệu Ứng Fenton Điện Hóa Tại Mật Độ Dòng 1 Ma/cm 2 -
 Xử Lý Nước Thải Dệt Nhuộm Làng Nghề Ương Nội
Xử Lý Nước Thải Dệt Nhuộm Làng Nghề Ương Nội
Xem toàn bộ 165 trang tài liệu này.
3.4.3.4. Ảnh hưởng của tốc độ sục oxy
Hàm lượng oxy trong dung dịch cũng là một yếu tố quan trọng quyết định tốc độ tạo H2O2 trên catôt, do đó ảnh hưởng trực tiếp đến quá trình Fenton điện hóa. Do lượng oxy trong dung dịch bị giới hạn bởi hàm lượng oxy bão hòa nên tốc độ sục khí được lựa chọn sao cho oxy vừa đủ bão hòa trong dung dịch.
Ảnh hưởng của tốc độ sục oxy đến sự biến thiên hiệu suất suy giảm COD và hiệu suất dòng điện theo thời gian khoáng hóa metyl đỏ 0,35 mM trong dung dịch Na2SO4 0,05 M, pH3, Fe2+ 1 mM, tại mật độ dòng áp đặt 1 mA/cm2 sử dụng catôt C/Ppy(Cu1,5Mn1,5O4)/Ppy được biểu diễn trên hình
3.33. Với tốc độ sục oxy 1 l/phút, hiệu suất suy giảm COD và hiệu suất dòng tại mọi thời điểm khoáng hóa đều đạt giá trị cao hơn so với khi sục khí oxy với tốc độ 0,5 l/phút. Cụ thể, sau 20 giờ khoáng hóa với tốc độ sục oxy
1 l/phút, hiệu suất suy giảm COD đạt giá trị khoảng 76 %, tương ứng với hiệu suất dòng đạt khoảng 64 %. Cùng thời điểm đó, với tốc độ sục khí oxy nhỏ (0,5 l/phút), hiệu suất suy giảm COD đạt 56 %, hiệu suất dòng khoáng hóa đạt 45 %.
Kết quả này có thể giải thích như sau: Trong khoảng tốc độ sục khí từ 0,5 2 l/phút, ở giai đoạn đầu của quá trình khoáng hóa, khi nồng độ oxy hoà tan ở sát bề mặt điện cực catôt tương đối lớn (đạt bão hoà), tốc độ sục khí oxy ít ảnh hưởng đến tốc độ phản ứng và hiệu suất của phản ứng Fenton. Theo thời gian, hàm lượng oxy sát bề mặt điện cực giảm, tốc độ sục khí 0,5 l/phút không đủ cung cấp oxy bão hoà tại vùng catôt, do đó tốc độ và hiệu suất phản ứng khử oxy hòa tan tạo H2O2 thấp nhất.
Khi tốc độ sục oxy lớn hơn hoặc bằng 1 l/phút, tốc độ và hiệu suất phản ứng khử oxy tạo H2O2 tăng lên và hầu như không thay đổi. Điều này khẳng định, tốc độ sục khí oxy 1 l/phút là tốc độ tối ưu cho lượng oxy trong dung dịch sát bề mặt điện cực catôt đạt nồng độ bão hòa.
0,5 l/phút
1,5 l/phút
1 l/phút
2 l/phút
80 350
280
60
%COD
210
40 H%
140
20
70
0 0
0 5 10 15 20
Thêi gian (giê)
Hình 3.33. Ảnh hưởng của tốc độ sục oxy đến sự biến thiên hiệu suất suy giảm COD và hiệu suất dòng theo thời gian khoáng hóa metyl đỏ 0,35 mM
3.4.4. Kết luận về quá trình khoáng hóa metyl đỏ:
+ Các kết quả thu được cho thấy, metyl đỏ vừa bị oxy hóa trực tiếp trên anôt Pt vừa bị oxy hóa gián tiếp bằng hiệu ứng Fenton điện hóa.
+ Điều kiện tối ưu cho quá trình khoáng hóa metyl đỏ 0,35 mM bằng phương pháp Fenton điện hóa là: dung dịch Na2SO4 0,05 M, pH3, Fe2+ 1 mM, tại 1 mA/cm2, điện cực catôt C/Ppy(Cu1,5Mn1,5O4)/Ppy, tốc độ sục oxy 1 l/phút.
+ Kết quả phân tích phổ UV-Vis: Tại điều kiện tối ưu trong quá trình khảo sát, hiệu suất phân hủy metyl đỏ 0,35 mM đạt 88 % sau 5 giờ khoáng hóa.
+ Kết quả xác định COD: Hiệu suất suy giảm COD đạt 76 % sau 20 giờ khoáng hóa.
3.5. Quá trình khoáng hóa công gô đỏ
3.5.1. Ảnh hưởng của vật liệu điện cực catôt
3.5.1.1. Kết quả phân tích UV-Vis
* Xây dựng đường chuẩn nồng độ - cường độ hấp thụ UV -Vis của công gô đỏ
Đường chuẩn cường độ hấp thụ UV-Vis - nồng độ của dung dịch công gô đỏ được xây dựng từ một dãy dung dịch chuẩn gồm 11 mẫu với nồng độ khác nhau, sử dụng dung môi pha loãng là dung dịch Na2SO4 0,05 M, pH3.
Phổ UV-Vis của công gô đỏ trong dung dịch Na2SO4 0,05 M, pH3, ở các nồng độ khác nhau được biểu diễn trên hình 3.34. Trong khoảng bước sóng 200 – 800 nm, cấu trúc của công gô đỏ được đặc trưng bởi một dải phổ trong vùng nhìn thấy với cực đại hấp thụ ở bước sóng 560 nm, tương ứng với cấu trúc – N = N – và một dải phổ khác trong vùng tử ngoại ở bước sóng khoảng 340 nm, tương ứng với cấu trúc của vòng benzen trong phân tử công gô đỏ.
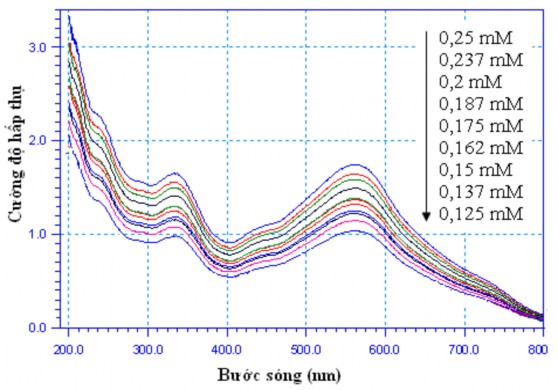
Hình 3.34. Phổ UV-Vis của công gô đỏ ở các nồng độ khác nhau
Đường chuẩn sự phụ thuộc của cường độ hấp thụ cực đại tại bước sóng 560 nm vào nồng độ công gô đỏ được biểu diễn trên hình 3.35. Sự phụ thuộc của cường độ hấp thụ vào nồng độ công gô đỏ gần như tuyến tính, tương ứng với phương trình đường thẳng y = 7,3658x - 0,1032 được xác định theo phương pháp bình phương tối thiểu với độ chính xác cao R2 = 0,9975. Phương trình đường thẳng này được sử dụng để xác định nồng độ công gô đỏ trong quá trình khoáng hóa.
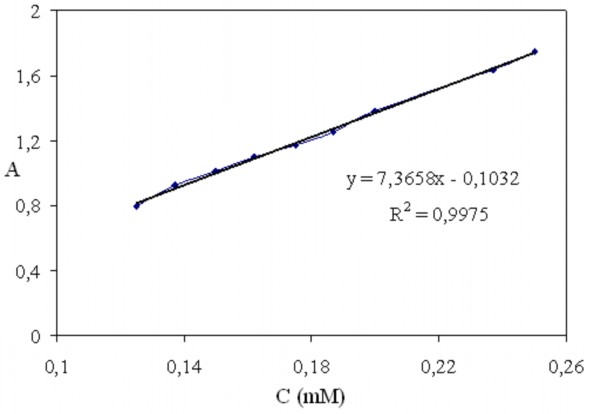
Hình 3.35. Đường chuẩn sự phụ thuộc cường độ hấp thụ tại bước sóng 560 nm vào nồng độ công gô đỏ
* Ảnh hưởng của vật liệu catôt đến sự biến thiên hiệu suất phân hủy công gô đỏ 0,25 mM
Quá trình khoáng hóa công gô đỏ bằng hiệu ứng Fenton điện hóa trong dung dịch Na2SO4 0,05 M, pH3, công gô đỏ 0,25 mM, Fe2+ 1 mM, tại mật độ dòng áp đặt 5 mA/cm2, tốc độ sục oxy 1 l/phút, sử dụng 3 loại điện cực C, C/Ppy và C/Ppy(Cu1,5Mn1,5O4)/Ppy.
Phổ UV-Vis của công gô đỏ theo thời gian khoáng hóa bằng hiệu ứng Fenton điện hóa trong trường hợp sử dụng catôt C/Ppy(Cu1,5Mn1,5O4)/Ppy được biểu diễn trên hình 3.36.
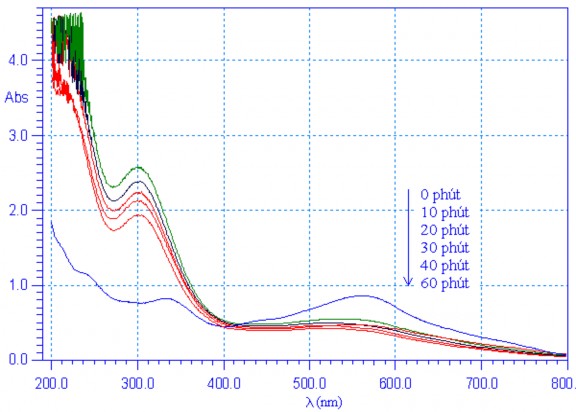
Hình 3.36. Phổ UV-vis của công gô đỏ theo thời gian khoáng hóa, sử dụng catôt C/Ppy(Cu1,5Mn1,5O4)/Ppy
Quan sát giản đồ phổ UV-Vis của công gô đỏ trên hình 3.35 cho thấy, đối với cả 3 loại điện cực, cường độ hấp thụ công gô đỏ tại bước sóng 560 nm đều giảm nhanh, tương ứng với sự phân hủy cấu trúc – N = N – dẫn tới sự mất màu dần của dung dịch công gô đỏ. Ngoài ra còn có một dải phổ khác trong vùng tử ngoại ở bước sóng khoảng 320 nm ngày càng tăng được dự đoán là có sự xuất hiện của sản phẩm trung gian có chứa vòng thơm benzen. Kết quả này cho phép khẳng định, trong quá trình điện phân, nhóm mang màu azo – N
= N – đã bị phá vỡ tạo ra các dẫn xuất hydrocacbon. Theo thời gian, gốc hydroxyl sinh ra sẽ tấn công phá hủy vòng benzen, dẫn tới công gô đỏ bị khoáng hóa hoàn toàn tạo thành CO2, H2O và các khoáng chất khác [83].
Ảnh hưởng của vật liệu catôt đến sự biến thiên hiệu suất phân huỷ công gô đỏ 0,25 mM theo thời gian khoáng hóa được biểu diễn trên hình 3.37. Khi sử dụng điện cực catôt C/Ppy(Cu1,5Mn1,5O4)/Ppy, sau 60 phút điện phân, hiệu suất phân hủy công gô đỏ 0,25 mM đạt giá trị cao nhất 65 % so với khi sử dụng catôt C và C/Ppy với các giá trị tương ứng 46 % và 53 %. Kết quả này một lần nữa cho phép khẳng định, điện cực catôt C/Ppy(Cu1,5Mn1,5O4)/Ppy có khả năng xúc tác tốt đối với quá trình khử oxy tạo H2O2, làm tăng tốc độ phản
ứng tạo gốc HO(phản ứng 1.6), do đó hiệu suất phân hủy công gô đỏ tăng.
C/Ppy(Cu1,5Mn1,5O4)/Ppy C/Ppy
C
75
60
45
30
15
0
0 10 20 30 40 50 60
Thêi gian (phót)
Hình 3.37. Ảnh hưởng của vật liệu catôt đến sự biến thiên hiệu suất phân hủy công gô đỏ 0,25 mM tại mật độ dòng 5 mA/cm2 theo thời gian khoáng hóa
3.5.1.2. Kết quả phân tích COD
Ảnh hưởng của vật liệu catôt đến sự biến thiên hiệu suất suy giảm COD và hiệu suất dòng theo thời gian khoáng hóa công gô đỏ 0,25 mM trong dung dịch Na2SO4 0,05 M, pH3, Fe2+ 1mM, tốc độ sục khí oxy 1 l/phút, tại mật độ dòng áp đặt 5 mA/cm2 trên các điện cực catôt C, C/Ppy và






