Bảng 3.15. Kết quả phân tích phổ NMR của Nuciferin
* C | C a,b | H a,c | |
1 | 144.6 | 145.13 | - |
1a | 126.3 | 126.84 | - |
1b | 127.5 | 128.00 | - |
2 | 151.4 | 151.95 | - |
3 | 110.9 | 111.27 | 6.63 s |
3a | 128.1 | 128.68 | - |
4 | 28.9 | 29.22 | 3.15 m 2.67 dd (16.5, 3.5) |
5 | 52.8 | 53.26 | 3.03* 2.49 td (12.0, 3.5) |
6a | 61.9 | 62.32 | 3.01* |
7 | 34.8 | 35.11 | 3.08 dd (13.5, 4.0) 2.61 t (13.5) |
7a | 135.9 | 136.45 | - |
8 | 127.3 | 127.81 | 7.25 |
9 | 126.7 | 127.26 | 7.22 |
10 | 126.4 | 126.93 | 7.30 tt (8.0, 0.5) |
11 | 127.7 | 128.28 | 8.36 dd (8.0, 0.5) |
11a | 131.6 | 132.12 | - |
1-OMe | 60.17 | 3.65 s | |
2-OMe | 55.82 | 3.87 s | |
6-Me | 43.5 | 43.96 | 2.53 s |
Có thể bạn quan tâm!
-
 Phân Lập Conessin Từ Alcaloid Toàn Phần Của Vỏ Thân Mức Hoa Trắng
Phân Lập Conessin Từ Alcaloid Toàn Phần Của Vỏ Thân Mức Hoa Trắng -
 Hàm Lượng Kaempferol Có Thể Chiết Xuất Được Từ Đơn Lá Đỏ
Hàm Lượng Kaempferol Có Thể Chiết Xuất Được Từ Đơn Lá Đỏ -
 Phân Lập Nuciferin Từ Alcaloid Toàn Phần Của Lá Sen
Phân Lập Nuciferin Từ Alcaloid Toàn Phần Của Lá Sen -
 Chương Trình Sắc Kí Để Định Lượng Và Xác Định Tạp Chất Trong Nguyên Liệu Thiết Lập Chuẩn
Chương Trình Sắc Kí Để Định Lượng Và Xác Định Tạp Chất Trong Nguyên Liệu Thiết Lập Chuẩn -
 Kết Quả Phân Tích Tạp Chất Trong Nguyên Liệu Nuciferin
Kết Quả Phân Tích Tạp Chất Trong Nguyên Liệu Nuciferin -
 Các Chỉ Tiêu Chất Lượng Đánh Giá Và Giới Hạn Chấp Nhận
Các Chỉ Tiêu Chất Lượng Đánh Giá Và Giới Hạn Chấp Nhận
Xem toàn bộ 249 trang tài liệu này.
(a) Dung môi: CDCl3; (b) ở 125 MHz; (c) ở 500 MHz; (*) Dữ liệu công bố của Nuciferin
3.2.4. Xác định độ tinh khiết bằng quét nhiệt vi sai (DSC)
Các hợp chất nghiên cứu đều là các hợp chất kết tinh có điểm nóng chảy xác định nên có thể sử dụng phương pháp quét nhiệt vi sai để xác định độ tinh khiết. Chương trình gia nhiệt được xây dựng dựa trên điểm nóng chảy của mỗi chất. Kết quả được ghi trong Bảng 3.16 và Hình 3.6 ~ 3.7.
Bảng 3.16. Kết quả xác định độ tinh khiết bằng quét nhiệt vi sai
Conessin to phòng - 110 oC: 10 oC/phút. 110 oC – 145 oC: 2 oC/phút. | Kaempferol to phòng - 300 oC: 10 oC/phút. | Nuciferin to phòng – 130 oC: 10 oC/phút. 130 oC – 155 oC: 5 oC/phút. | ||||
Lượng cân (mg) | Độ tinh khiết (%) | Lượng cân (mg) | Độ tinh khiết (%) | Lượng cân (mg) | Độ tinh khiết (%) | |
1 | 4,9 | 98,42 | 1,8 | 97,44 | 6,8 | 99,64 |
2 | 5,3 | 98,56 | 1,8 | 97,96 | 6,4 | 99,67 |
3 | 5,2 | 98,60 | 1,5 | 97,53 | 6,8 | 99,64 |
4 | 5,2 | 98,56 | 2,0 | 97,79 | 9,7 | 99,58 |
5 | 4,6 | 98,51 | 1,8 | 97,44 | 6,8 | 99,64 |
Trung bình | 98,53 | 97,68 | 99,63 | |||
RSD (%) | 0,07 | 0,24 | 0,40 | |||
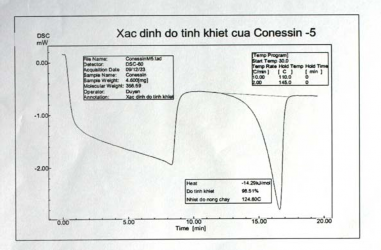
Hình 3.6. Nhiệt đồ của mẫu Conessin
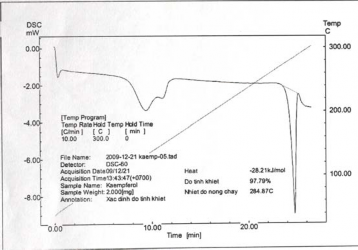
Hình 3.7. Nhiệt đồ của mẫu Kaempferol
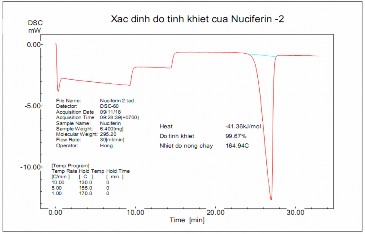
Hình 3.8. Nhiệt đồ của mẫu Nuciferin
3.3. NGHIÊN CỨU THIẾT LẬP CHẤT CHUẨN ĐỐI CHIẾU
3.3.1. Xây dựng và thẩm định phương pháp phân tích
3.3.1.1. Xây dựng phương pháp định lượng và xác định tạp chất bằng HPLC
Dựa trên công thức phân tử và cấu trúc hóa học của các hợp chất nghiên cứu để tìm các các điều kiện sắc kí phù hợp như:
- Bản chất pha tĩnh: tất cả các hợp chất đối tượng phân tích đều phù hợp phân tích bằng sắc kí phân bố pha đảo sử dụng cột RP 18 (Bảng 3.17).
- Thành phần pha động: được khảo sát như nêu trong Bảng 3.18.
Bảng 3.17. Loại cột HPLC đã khảo sát xây dựng phương pháp phân tích
Cột | Cột đã sử dụng | |
Conessin | RP 18 (250 mm x 4,6 mm, 5 µm) | Phenomenex Luna |
Kaempferol | RP 18 (250 mm x 4,6 mm, 5 µm) | Phenomenex Luna |
Nuciferin | RP 18 (150 x 4,6mm; 5µm) | Purospher STAR |
Bảng 3.18. Khảo sát pha động và thành phần pha động
Pha động | Thành phần pha động | Nhận xét | |
Conessin | 1 | MeOH – nước (35 : 65) | Pic không cân xứng. |
2 | MeOH - đệm phosphat pH 3,0 (35 : 65) | Diện tích pic và thời gian lưu ổn định, pic bị kéo đuôi. | |
3 | Đệm phosphat -MeOH (65 : 35), Pha động có chứa 0,1% TEA, điều chỉnh pH 3,0 | Diện tích pic và thời gian lưu ổn định, pic có hình dạng cân xứng (Hệ số bất đối khoảng 1,6). | |
Kaempferol | 1 | MeOH : H3PO4 0,4% (60 : 40) | Diện tích pic không ổn định. |
2 | MeOH - NaH2PO4 0,05 M đã chỉnh đến pH 2,0 bằng H3PO4 (55 : 45) | Diện tích pic và thời gian lưu ổn định. | |
Nuciferin | 1 | ACN: H2O:TEA 0,1%: AcOH (56 : 44 : 1: 0,15) | Diện tích pic nhỏ. |
2 | ACN: H2O : TEA 0,1%:AcOH (27 : 70,5 : 1,5: 1,0) | Có hiện tượng giảm diện tích pic. | |
3 | ACN : TEA 0,1%, Gradient | Có hiện tượng giảm diện tích pic. | |
4 | ACN : TEA 0,1% (70 : 30) | Diện tích pic lớn và ổn định. |
- Bước sóng phát hiện: detector tử ngoại khả kiến UV-VIS loại PDA có thể quét phổ. Dựa vào bước sóng theo tài liệu tham khảo hoặc quét phổ để tìm bước sóng thích hợp.
- Tốc độ dòng: 1 ml/phút
- Thể tích tiêm mẫu: 20 µl
- Nồng độ dung dịch thử: tùy theo mỗi chất, khảo sát nồng độ thích hợp trong khoảng tuyến tính.
- Dung môi pha mẫu
Với mỗi hợp chất nghiên cứu, khảo sát từ 2 - 4 pha động để lựa chọn pha
động phù hợp nhất.
Kết luận: Từ kết quả quét phổ UV-VIS (Hình 3.9 ~ 3.11) lựa chọn được bước sóng phát hiện như trình bày ở Bảng 3.19.
400
300
200
100
0
mAU
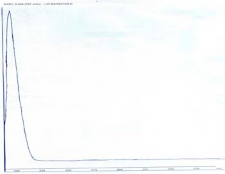
Detector A:205nm
0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 6.5 7.0 min
Hình 3.9. SKĐ và phổ UV của dung dịch đối chiếu Conessin
100
75
50
25
0
mV

Detector A:362nm
0.0 2.5 5.0 7.5 10.0 12.5 15.0 min
Hình 3.10. SKĐ và phổ UV của dung dịch đối chiếu Kaempferol
DAD1 A, Sig=270,4 Ref=360,100 (NUCIFENUCIFE16.D)
mAU
400
300
200
100
0
0
5
10
15
20
min
01..922007
1.294
3.463
6.813
Hợp chất | Bước sóng phát hiện | Nhận xét |
Conessin | 205 nm | Phổ hấp thụ yếu |
Kaempferol | 362 nm | Có cực đại hấp thụ ở vùng đặc hiệu |
Nuciferin | 270 nm và 280 nm | Khả năng hấp thụ tại 270 nm mạnh hơn |
Hình 3.11. SKĐ và phổ UV của dung dịch đối chiếu Nuciferin Bảng 3.19. Kết quả khảo sát bước sóng phát hiện
3.3.1.1. Thẩm định phương pháp phân tích
Tính thích hợp của hệ thống sắc kí:
Tiến hành tiêm lặp lại 6 lần dung dịch chuẩn đã chuẩn bị ở trên, ghi lại các giá trị về thời gian lưu, diện tích pic. Độ lặp lại của hệ thống được biểu thị bằng độ lệch chuẩn tương đối RSD của diện tích pic. Kết quả được trình bày ở Bảng 3.20.
Bảng 3.20. Một số thông số thể hiện sự phù hợp của hệ HPLC đã lựa chọn
Thời gian lưu tR (phút) | Độ lặp lại thời gian lưu | Hệ số bất đối T | Số đĩa lí thuyết N | Độ lặp lại diện tích pic | |
Conessin | 5,59 | 0,54% | 1,6 | 3700 | 0,27 |
Nuciferin | 7,32 | 0,65% | 1,8 | 4250 | 0,61 |
Kaempferol | 15,24 | 0,87% | 1,1 | 11600 | 0,68 |
Yêu cầu | ≤ 2,0% | T ≤ 2,0 | N ≥ 2000 | ≤ 2,0% |
Nhận xét:
Các thông số thực nghiệm thể hiện sự phù hợp của hệ thống sắc kí đã lựa chọn
để phân tích các hợp chất nghiên cứu.
Tính đặc hiệu: Tiêm lần lượt dung môi pha mẫu, dung dịch thử và dung dịch đối chiếu vào hệ thống sắc kí, kết quả cho thấy dung dịch chuẩn và dung dịch thử tương ứng cho pic có thời gian lưu tương ứng, còn dung môi pha mẫu không cho pic ở thời gian tương ứng. Các dữ liệu về độ tinh khiết pic được trình bày ở Hình 3.12 ~ 3. 14. Hệ HPLC đặc hiệu với chất phân tích.
Hình 3.12. Dữ liệu độ tinh khiết pic Conessin
Hình 3.13. Dữ liệu độ tinh khiết pic Kaempferol
Hình 3.14. Dữ liệu độ tinh khiết pic Nuciferin
Độ chính xác: Tiêm 6 dung dịch thử ở nồng độ khảo sát đối với mỗi chất vào hệ thống sắc kí để khảo sát độ chính xác, kết quả được ghi trong Bảng 3.21.