Bảng số liệu 3.4 cho thấy đối với điện cực được phủ lớp composit AuNP-GO, mật độ phân tử theo thứ tự giảm dần là: PET-AET-SAM, PET-SAM, AET-SAM. Từ kết quả số phân tử PET hấp phụ lên AuNP-GO nhiều hơn so với số phân tử AET, thêm một lần nữa khẳng định PET-SAM có khả năng định hướng tốt hơn so với AET- SAM do việc tăng khả năng tương tác giữa các phân tử liền kề. Mặt khác, kết quả thu được cũng cho thấy PET-AET-SAM có khả năng định hướng phân tử tốt nhất để trên cùng một đơn vị diện tích số phân tử tạo thành được nhiều nhất.
3.4. Cơ sở lý thuyết sử dụng SAM biến tính điện cực phân tích Hg (II)
Điện cực sau khi được biến tính bởi SAM được ngâm hấp phụ trong dung dịch Hg (II). Giả sử phản ứng thuận nghịch xảy ra như sau:
⎯⎯(3.11)k2
SAM Hg ⎯k⎯1SAM Hg
Gỉa thiết:
- Tổng lượng phân tử SAM ban đầu trên bề mặt điện cực chưa tham gia liên kết với Hg (II) là 𝑛0.
- Lượng phân tử SAM trên bề mặt điện cực đã tham gia liên kết với Hg (II) là nHg.
- Lượng phân tử SAM trên bề mặt điện cực chưa tham gia liên kết với Hg (II) là nf.
Có thể bạn quan tâm!
-
 Chế Tạo Các Sam Biến Tính Lớp Aunp Trên Điện Cực Gce
Chế Tạo Các Sam Biến Tính Lớp Aunp Trên Điện Cực Gce -
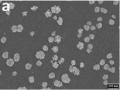
 Ảnh Sem Của Aunp Trên Bề Mặt Điện Cực Gce Với Thời Gian Tạo Vàng Khác Nhau: 50 Giây (A), 300 Giây (B), 600 Giây (C)
Ảnh Sem Của Aunp Trên Bề Mặt Điện Cực Gce Với Thời Gian Tạo Vàng Khác Nhau: 50 Giây (A), 300 Giây (B), 600 Giây (C) -
 Diện Tích Hoạt Động Điện Hóa Của Điện Cực Aunp/gce Và Aunp- Go/gce
Diện Tích Hoạt Động Điện Hóa Của Điện Cực Aunp/gce Và Aunp- Go/gce -
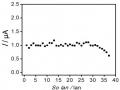
 Sự Biến Đổi Dòng Píc Hg (Ii) Ở Nồng Độ 1 Ppb Theo Số Lần Sử Dụng Của Điện Cực Pet-Sam/aunp
Sự Biến Đổi Dòng Píc Hg (Ii) Ở Nồng Độ 1 Ppb Theo Số Lần Sử Dụng Của Điện Cực Pet-Sam/aunp -
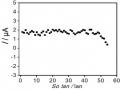
 Kết Quả Phân Tích Hàm Lượng Hg (Ii) Trong Cùng Một Mẫu Trong Hai Ngày Liên Tiếp
Kết Quả Phân Tích Hàm Lượng Hg (Ii) Trong Cùng Một Mẫu Trong Hai Ngày Liên Tiếp -
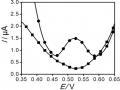
 Đường Dpasv Và Đường Chuẩn Theo Chiều Cao Píc Trên Điện Cực Pet- Aet-Sam/ Aunp-Go Khi Nồng Độ Thủy Ngân Tăng Dần Từ 30 Ppt Đến 3500 Ppt.
Đường Dpasv Và Đường Chuẩn Theo Chiều Cao Píc Trên Điện Cực Pet- Aet-Sam/ Aunp-Go Khi Nồng Độ Thủy Ngân Tăng Dần Từ 30 Ppt Đến 3500 Ppt.
Xem toàn bộ 138 trang tài liệu này.
- Nồng độ Hg (II) trong dung dịch là CHg
Ta luôn có: 𝑛0 = 𝑛𝐻𝑔 + 𝑛𝑓hay 𝑛𝑓 = 𝑛0 − 𝑛𝐻𝑔 (3.12)
Giả sử phản ứng thuận và nghịch đều tuân theo định luật tác dụng khối lượng của động hóa học. Khi đó:
Phản ứng thuận tạo SAM-Hg có tốc độ 𝜐2với hằng số tốc độ k1 là:
𝜐1 = 𝑘1. 𝐶𝐻𝑔. 𝑛𝑓 (3.13)
Phản ứng nghịch có tốc độ 𝜐2 với hằng số tốc độ k2 là:
𝜐2 = 𝑘2. 𝑛𝐻𝑔 (3.14)
Tại mỗi thời điểm tốc độ của phản ứng thuận nghịch bằng 𝜐1 − 𝜐2nên phương trình tốc độ phản ứng có dạng:
𝑑𝑛𝐻𝑔 = 𝜐
− 𝜐
= 𝑘
. 𝐶
𝑛 − 𝑘 𝑛
(3.15)
𝑑𝑡 1 2
Thay (3.12) vào (3.15) ta được:
1 𝐻𝑔 𝑓
2 𝐻𝑔
dnHg dt
dnHg dt
= k1. CHg. (n0 − nHg) − k2. nHg
= k1. CHg. n0 − k1. CHg. nHg − k2. nHg
1
dnHg = k
dt
. CHg
. n0
− nHg
. (k1
. CHg
+ k2
) (3.16)
Đặt 𝑛𝐻𝑔 = 𝑦, 𝐴 = 𝑘1. 𝐶𝐻𝑔. 𝑛0, 𝐵 = 𝑘1. 𝐶𝐻𝑔 + 𝑘2
Khi đó (3.16) có dạng:
𝑑𝑦
𝑑𝑡
= 𝐴 − 𝐵𝑦
⇔𝑑𝑦
𝐴−𝐵𝑦
= 𝑑𝑡. Lấy nguyên hàm 2 vế ta được:
𝑑𝑦
∫
𝐴 − 𝐵𝑦
= ∫ 𝑑𝑡
1
⇔ ∫ −
𝐵
1
𝑑(𝐴 − 𝐵𝑦)
.
(𝐴 − 𝐵𝑦)
= ∫ 𝑑𝑡
⇔ − 𝑙𝑛( 𝐴 − 𝐵𝑦) = 𝑡 + 𝑐𝑜𝑛𝑠𝑡
𝐵
⇔ 𝑙𝑛( 𝐴 − 𝐵𝑦) = −𝐵𝑡 + 𝑐𝑜𝑛𝑠𝑡
⇔ 𝐴 − 𝐵𝑦 = 𝑒−𝐵.𝑡. 𝑐𝑜𝑛𝑠𝑡
Tại thời điểm t = 0 => y = 0 (do lúc này SAM chưa liên kết với Hg) nên
𝑛𝐻𝑔 = 0 ⇒ 𝐴 = 𝑐𝑜𝑛𝑠𝑡
⇒ 𝐴 − 𝐵𝑦 = 𝐴. 𝑒−𝐵𝑡
𝐴(1 − 𝑒−𝐵𝑡)
⇔ 𝑦 =
𝑛𝐻𝑔 =
𝑘1.𝑛0.𝐶𝐻𝑔
𝑘1.𝐶𝐻𝑔+𝑘2
(1 − 𝑒−(𝑘1.𝐶𝐻𝑔+𝑘2).𝑡)
⇒
(3.16)
𝐵
(3.17)
Nếu lượng điện tỉ lệ thuận nồng độ Hg(II) trên bề mặt thì chiều cao pic tỉ lệ thuận với điện lượng như vậy chiều cao pic sẽ tỉ lệ với y (𝑛𝐻𝑔)
Xét 2 trường hợp:
Trường hợp 1: Hg(II) chưa bão hòa trên bề mặt điện cực Khai triển Taylor cho hàm một biến ta có:
𝑒−𝐵𝑡 = 1 − 𝐵𝑡 +
(𝐵𝑡)2
2!
(𝐵𝑡)3
−
3!
+. . . . . . +
(−𝐵𝑡)𝑛
𝑛!
(3.18)
2 3 𝑛
Giả sử 𝐵𝑡 < 0,1 khi đó: (𝐵𝑡) − (𝐵𝑡) +. . . . . . + (−𝐵𝑡) ≪ 1, chuỗi trở thành:
2! 3! 𝑛!
𝑒−𝐵𝑡 = 1 − 𝐵𝑡. Khi đó (3.17) có dạng:
𝑦 = 𝐴(1−1+𝐵𝑡) = 𝐴𝐵𝑡 = 𝐴𝑡 hay
𝑛𝐻𝑔 = 𝑘1. 𝑛0. 𝐶𝐻𝑔. 𝑡
𝐵 𝐵
Từ phương trình thu được cho thấy:
(3.19)
Khi nồng độ thủy ngân nhỏ (𝐵𝑡 < 0,1) thì 𝑛𝐻𝑔tuyến tính với thời gian ngâm hấp phụ t và𝐶𝐻𝑔hay chiều cao pic thủy ngân tuyến tính với thời gian ngâm hấp phụ t và𝐶𝐻𝑔. Trường hợp 2: Hg(II) bão hòa trên bề mặt điện cực
Khi 𝑡 → ∞thì 𝑒−(𝑘1.𝐶𝐻𝑔+𝑘2).𝑡 → 0, khi đó (3.17) có dạng:
𝑛 =
𝑏ℎ
𝑘.𝑛.𝐶
10𝐻𝑔
𝐻𝑔
𝑘1.𝐶𝐻𝑔+𝑘2
(3.20)
٭) 𝐶𝐻𝑔 đủ nhỏ và k1 < k2 => k1.𝐶𝐻𝑔 << k2, khi đó (3.17) có dạng:
𝑛𝑏ℎ =𝑘1.𝑛0.𝐶𝐻𝑔= 𝑘′. 𝐶
(3.21)
𝐻𝑔
𝑘2
𝐻𝑔
𝐻𝑔
⇒ 𝑛𝑏ℎ điện cực tỉ lệ thuận với 𝐶𝐻𝑔hay chiều cao pic tỉ lệ thuận với 𝐶𝐻𝑔
𝑛 =
𝑏ℎ
.𝑛.𝐶
𝑘
𝐻𝑔
10𝐻𝑔
𝑘1.𝐶𝐻𝑔
≈ 𝑛
0
٭) 𝐶𝐻𝑔 đủ lớn và k1 > k2 => k1.𝐶𝐻𝑔 >> k2, khi đó (3.17) có dạng:
(3.22)
𝐻𝑔
𝑛𝑏ℎ không thay đổi, chiều cao pic không phụ thuộc vào nồng độ Hg (II) và trường hợp này không có ý nghĩa định lượng.
3.5. Sử dụng điện cực biến tính các SAM để phân tích Hg (II)
Sau khi đã nghiên cứu sự hình thành SAM trên bề mặt AuNP, AuNP-GO, các điện cực đã được nghiên cứu sử dụng để phân tích Hg(II) trong môi trường nước. Lượng vết Hg (II) trong dung dịch được làm giàu lên bề mặt điện cực nhờ phản ứng với nhóm chức N-pyrydin của PET-SAM và nhóm amino (-NH2) của AET – SAM đã biến tính trên AuNP, AuNP-GO. Quá trình làm giàu này không sử dụng điện thế áp để kết tủa Hg (II) thành Hg (0) nhằm tránh sự làm giàu đồng thời các chất lạ có mặt trong dung dịch góp phần nâng cao độ nhạy và độ chọn lọc. Sau quá trình làm giàu, Hg (II) đã liên kết với các nhóm chức của SAM được phát hiện nhờ kỹ thuật xung vi phân để tiến hành phân tích Hg (II), đây là phương pháp có độ nhạy cao trong số các phương pháp đo điện hóa.
3.5.1 Quá trình làm giàu
Để chứng minh cho sự xuất hiện tín hiệu Hg (II) khi sử dụng điện cực SAM, ngoài việc sử dụng PET biến tính AuNP thì AET cũng được sử dụng để biến tính AuNP ứng dụng trong việc phát hiện Hg (II) trong môi trường nước bởi các SAM này có khả năng liên kết với Hg (II) trong dung dịch. Do đó, có thể tiến hành làm giàu Hg (II) lên bề mặt điện cực mà không cần áp thế kết tủa để tạo Hg (0). Như vậy, quá trình làm giàu diễn ra đơn giản là quá trình hấp phụ hóa học trên các điện cực biến tính với SAM. Ưu điểm này được thể hiện như trên hình 3.15.
Đường DPASV phát hiện Hg (II) đo trong dung dịch KCl 0,1 M và HCl, pH = 3 sử dụng điện cực PET-SAM (hình trái), AET-SAM (hình phải), trong dung dịch Hg (II) nồng độ 1ppb với thời gian làm giàu 30 phút.
Trong nghiên cứu này, tín hiệu thủy ngân trên các điện cực biến tính với SAM ngâm hấp phụ trong dung dịch có nồng độ Hg (II) là 1 ppb với nền điện li gồm KCl 0,1 M và HCl, pH = 3 đã được khảo sát. Kết quả thu được cho thấy với dung dịch thủy ngân ở cùng nồng độ điện cực PET-SAM và AET-SAM đều xuất hiện píc ở thế 0,52V, trong khi đường nền không có píc này. Sự hình thành liên kết giữa Hg (II) với PET và AET đều theo tỉ lệ Hg (II) – N-pyrydine/NH2=1:2 [183], được biểu diễn theo phương trình 3.23:
2 AuS-(CH2)2-NH2 + Hg2+= (AuS-(CH2)2-NH2)2Hg (3.23)
và phương trình 3.24:
2 AuS-(CH2)2-C6H4N + Hg2+ = (AuS-(CH2)2- C6H4N)2Hg (3.24)
Kết quả chứng tỏ xuất hiện píc của thủy ngân được làm giàu trên bề mặt. Như vậy, phép đo DPASV có thể sử dụng để khảo sát khả năng phân tích ion Hg (II) trong các mẫu nước. Píc thủy ngân xuất hiện ở thế 0,52 V trong môi trường điện li KCl 0,1 M và HCl, pH = 3.
3.5.2. Ảnh hưởng của chiều quét thế đến việc xác định Hg(II)
Lượng Hg (II) sau khi được làm giàu trên bề mặt điện cực được xác định bằng hai kỹ thuật quét thế: quét thế chiều catot và quét thế chiều anot.
٭ Đối với kỹ thuật quét thế chiều catot, thế áp lên điện cực làm việc được quét theo chiều âm từ +0,66 V về +0,35 V với tốc độ quét v = 0,1 V/s trong dung dịch KCl 0,1 M +HCl, pH=3 để lượng Hg (II) làm giàu trên bề mặt sẽ bị khử thành Hg (0). Tương ứng với quá trình khử đó, trên phổ đồ von-ampe sẽ thu được píc khử như trên hình
3.16. Chiều cao píc tính được là: 0,45 µA.
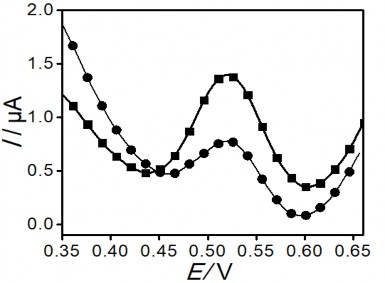
Hình 3. 16. Sự ảnh hưởng của chiều quét Von-Ampe đến chiều cao píc: quét chiều catot (●) và quét theo chiều anot (■). Các phổ xung vi phân được đo với PET- SAM/AuNP/GCE làm giàu trong dung dịch Hg (II) 1 ppb với thời gian ngâm 30 phút
٭ Đối với kỹ thuật quét thế chiều anot, lượng Hg (II) sau khi được làm giàu trên bề mặt điện cực biến tính sẽ bị khử toàn bộ thành Hg (0) khi áp thế -0,4 V một khoảng thời gian vừa đủ, sau đó quét thế theo chiều anot từ 0,35 V đến 0,66 V với tốc độ quét v = 0,1 V/s trong dung dịch KCl 0,1 M +HCl, pH=3 để oxi hóa ngược lại
thành Hg (II) và tạo píc oxi hóa như trên hình 3.16. Khoảng thời gian cần thiết để khử toàn bộ Hg (II) thành Hg (0) đã được khảo sát, kết quả thu được như trên hình 3.17.
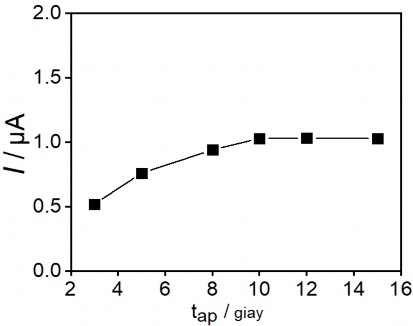
Hình 3. 17. Ảnh hưởng của thời gian áp thế đến tín hiệu thủy ngân
Kết quả thu được cho thấy tín hiệu dòng píc tăng dần khi tăng thời gian áp thế từ 3 giây đến 10 giây và đạt giá trị dòng cực đại tại 10 giây, sau đó giá trị dòng không đổi khi kéo dài thời gian áp thế. Lúc này, toàn bộ Hg (II) trên bề mặt bị khử thành Hg (0). Vì vậy, thời gian áp 10 giây được lựa chọn là thời gian áp thế trước khi quét thế theo chiều anot.
Chiều cao píc tính được ở kỹ thuật quét anot là 1,01 µA, cao gấp 2,44 lần so với kỹ thuật quét catot. Kết quả này có thể được giải thích bởi: ở kỹ thuật quét theo chiều catot thì quá trình quét xảy ra nhanh nên lượng Hg (II) được làm giàu có thể sẽ không bị khử hết, bởi vậy ở kỹ thuật quét theo chiều anot có thêm giai đoạn khử về Hg (0) trong 10 giây trước khi quét thế theo chiều anot. Do đó, píc thu được sẽ cao hơn píc đo bằng kỹ thuật quét theo chiều catot như trình bày trên hình 3.16. Mặt khác, việc sử dụng quét thế theo chiều anot còn thuận lợi hơn là sau khi quét lượng Hg (II) sẽ khuếch tán vào trong dung dịch. Như vậy, sẽ loại bỏ được thủy ngân ra khỏi bề mặt ở các lần đo tiếp theo. Vì vậy, kỹ thuật quét theo chiều anot được sử dụng cho các nghiên cứu tiếp theo.
3.5.3. PET-SAM/AuNP phân tích Hg (II)
3.5.3.1. Vai trò của AuNP trong điện cực biến tính phân tích Hg (II)
Vai trò của AuNP trong việc sử dụng chế tạo điện cực phân tích Hg (II) được thể hiện trong phổ đồ xung vi phân của hai loại điện cực: điện cực đĩa vàng và điện cực AuNP/GCE cùng được biến tính bởi PET-SAM. Kết quả thu được như trên hình 3.18.
Từ kết quả DPASV thu được cho thấy tín hiệu thu được trên hai điện cực đều xuất hiện píc tại thế 0,52 V. Tuy nhiên, chiều cao píc đo được khi sử dụng điện cực AuNP (chiều cao píc đạt 1µA) cao gấp 3 lần (chiều cao píc đạt 0,33 µA) so với điện cực vàng đĩa. Sự tăng chiều cao này do sự tăng diện tích bề mặt hình học nhờ lớp AuNP. Diện tích bề mặt thật của lớp vàng nano cũng được đánh giá bằng phương pháp quét CV trong dung dịch K3(Fe(CN)6) pha trong đệm photphat 0,1 M, pH=7. Từ giá trị dòng píc thu được, tính toán theo phương trình Randles-Sevcik, tỉ lệ Ahđ/Ahh=1,6.
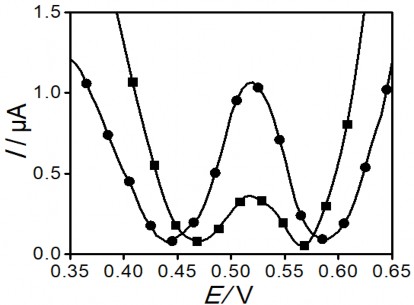
Đường DPASV phát hiện Hg (II) của PET-SAM/Au đĩa (■) và PET- SAM/AuNP (●) sau khi làm giàu trong dung dịch Hg (II) 1 ppb với thời gian ngâm 30 phút, ghi đo trong dung dịch KCl 0,1 M +HCl, pH=3
Như vậy, với phương pháp kết tủa tạo AuNP trên bề mặt GCE diện tích hoạt động điện hóa tăng 60% so với diện tích hình học. Đây là nguyên nhân làm tăng số lượng các phân tử SAM hấp phụ hóa học trên bề mặt GCE được biến tính với AuNP.
3.5.3.2. Ảnh hưởng của các ion đến tín hiệu Hg (II)
Trong các mẫu nước phát thải môi trường thường tồn tại nhiều loại ion khác nhau, mỗi mẫu nước sẽ có thành phần khác nhau. Việc tồn tại Hg (II) cùng các ion kim loại khác thường rất phổ biến, các ion này dễ gây ảnh hưởng đến việc phân tích bằng phương pháp điện hóa do thế tiêu chuẩn của chúng gần với thủy ngân. Do đó, việc nghiên cứu ảnh hưởng của các cation kim loại nhằm nâng cao độ chọn lọc với Hg (II) là rất cần thiết.
*Ảnh hưởng của các cation
Trong nghiên cứu ảnh hưởng của cation kim loại, một số cation được lựa chọn có khả năng cùng tồn tại với Hg (II) trong mẫu nước: Cu2+, Pb2+, Zn2+, Cd2+, Fe3+, Ni2+, Mn2+ với nồng độ đến 120 ppb, gấp 120 lần so với nồng độ Hg (II) có trong dung dịch. Sự chọn lọc đối với Hg (II) được đánh giá thông qua giá trị dòng, kết quả thể hiện như trên hình 3.19.
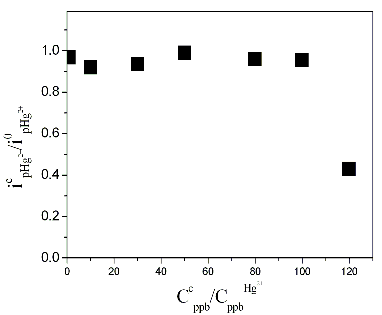
Hình 3. 19. Sự ảnh hưởng của các cation trong dung dịch đến tín hiệu dòng Hg(II)
Kết quả dòng píc đo được biểu diễn ở dạng tỉ lệ giữa dòng píc thu được khi có mặt của các cation kim loại (icpHg(II)) và dòng píc thu được khi chỉ có Hg (II) (i0pHg(II). Kết quả trên hình cho thấy nồng độ các cation có trong dung dịch cao gấp 100 lần nồng độ Hg (II) thì tỷ lệ dòng píc thu được khi có mặt và không có mặt gần như thay đổi không đáng kể và nồng độ cation lên đến 120 ppb gía trị dòng píc bắt đầu có xu hướng giảm.