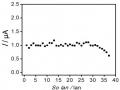
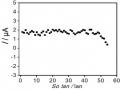
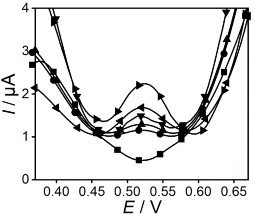
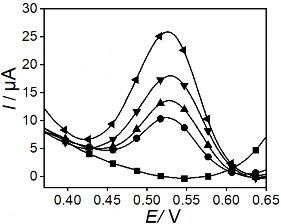
Các kết quả trên hình 3.33 biểu diễn sự biến đổi của giá trị dòng theo số lần sử dụng của điện cực PET-SAM/AuNP-GO và PET-AET-SAM/ AuNP-GO. Kết quả cho thấy dòng ghi đo điện cực PET-SAM/AuNP-GO lặp lại sau 53 lần ghi đo với độ lặp lại là 6,221 % và điện cực PET-AET-SAM/AuNP-GO lặp lại sau 112 lần ghi đo với độ lặp lại 5,191 % chứng tỏ các điện cực có độ bền tốt và điện cực PET-AET- SAM/ AuNP-GO có độ bền tốt hơn so với điện cực PET-SAM.
3.5.5.6. Xây dựng đường chuẩn
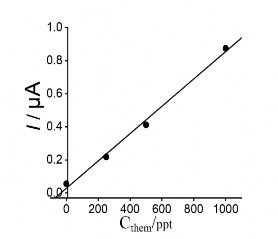
Hình 3.34 là đồ thị đường chuẩn thể hiện mối tương quan giữa nồng độ Hg
(II) và dòng píc tương ứng.
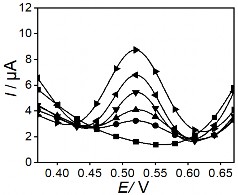
Hình 3. 34. Đường DPASV và đường chuẩn theo chiều cao píc trên điện cực PET- AET-SAM/ AuNP-GO khi nồng độ thủy ngân tăng dần từ 30 ppt đến 3500 ppt.
Từ phổ đồ DPASV cho thấy các mẫu đo đều xuất hiện một píc rất rò ở thế 0,52
V. Trên đường đo có thể quan sát được chiều cao píc thủy ngân tăng tương ứng với sự tăng của nồng độ và có sự tương quan tuyến tính tốt, với khoảng nồng độ tuyến tinh 30 ppt – 3500 ppt. Hệ số tương quan tuyến tính R = 0,999.
Từ kết quả phân tích trên phần mềm origin, phương trình sự phụ thuộc của cường độ dòng (chiều cao píc) vào nồng độ thủy ngân là:
y = (0,0034 ± 3,31.10-5) x C + (0,0441 ± 0,0568) (3.27)
Vậy với thể tích mẫu là 40 ml thì tuyến tính của đường trong trong khoảng 30 ppt đến 3500 ppt.
3.5.5.7. Giới hạn phát hiện của phương pháp
Xác định giới hạn phát hiện bằng cách đo độ lặp lại 7 lần mẫu dung dịch chuẩn
Hg (II) có nồng độ 30 ppt sử dụng điện cực PET-AET-SAM/AuNP-GO, các điều kiện đo được xác lập như lập đường chuẩn, chấp nhận sự sai khác giữa độ lệch chuẩn của dung dịch và độ lệch chuẩn của mẫu trắng là không đáng kể: Sb = Sy. Bậc tự do (n-1): 6. Giá trị t tra bảng với bậc tự do: 6, độ tin cậy 99%: 3,143.
Kết quả được thể hiện ở bảng 3.14.
Bảng 3. 14. Giới hạn phát hiện và độ thu hồi thủy ngân trên điện cực PET-AET- SAM/AuNP-GO
PET-AET-SAM/AuNP-GO | ||
Hàm lượng Hg (ppt) | Độ thu hồi | |
1 | 34,411 | 114,705 |
2 | 41,441 | 138,137 |
3 | 48,205 | 160,686 |
4 | 42,323 | 141,078 |
5 | 49,970 | 166,568 |
6 | 39,382 | 131,274 |
7 | 34,647 | 115,490 |
Trung bình | 41,483 | 138,277 |
Độ lệch chuẩn | 6,042 | |
LOD | 18,992 |
Có thể bạn quan tâm!
-
 Cơ Sở Lý Thuyết Sử Dụng Sam Biến Tính Điện Cực Phân Tích Hg (Ii)
Cơ Sở Lý Thuyết Sử Dụng Sam Biến Tính Điện Cực Phân Tích Hg (Ii) -
 Sự Biến Đổi Dòng Píc Hg (Ii) Ở Nồng Độ 1 Ppb Theo Số Lần Sử Dụng Của Điện Cực Pet-Sam/aunp
Sự Biến Đổi Dòng Píc Hg (Ii) Ở Nồng Độ 1 Ppb Theo Số Lần Sử Dụng Của Điện Cực Pet-Sam/aunp -
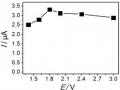
 Kết Quả Phân Tích Hàm Lượng Hg (Ii) Trong Cùng Một Mẫu Trong Hai Ngày Liên Tiếp
Kết Quả Phân Tích Hàm Lượng Hg (Ii) Trong Cùng Một Mẫu Trong Hai Ngày Liên Tiếp -
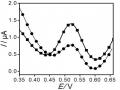
 Ảnh Hưởng Của Thế Áp (A); Nồng Độ Kcl (B); Thời Gian Điện Phân (C); Và Thời Gian Khuấy (D) Đến Tín Hiệu Hg (Ii)
Ảnh Hưởng Của Thế Áp (A); Nồng Độ Kcl (B); Thời Gian Điện Phân (C); Và Thời Gian Khuấy (D) Đến Tín Hiệu Hg (Ii) -
 Nghiên cứu biến tính điện cực than thuỷ tinh bằng vật liệu có cấu trúc nano ứng dụng để xác định thuỷ ngân trong môi trường nước - 16
Nghiên cứu biến tính điện cực than thuỷ tinh bằng vật liệu có cấu trúc nano ứng dụng để xác định thuỷ ngân trong môi trường nước - 16 -
 Nghiên cứu biến tính điện cực than thuỷ tinh bằng vật liệu có cấu trúc nano ứng dụng để xác định thuỷ ngân trong môi trường nước - 17
Nghiên cứu biến tính điện cực than thuỷ tinh bằng vật liệu có cấu trúc nano ứng dụng để xác định thuỷ ngân trong môi trường nước - 17
Xem toàn bộ 138 trang tài liệu này.
Kết quả thu được ở bảng cho thấy phương pháp Von – Ampe xung vi phân sử dụng điện cực PET-AET-SAM/AuNP-GO có giới hạn phát hiện rất thấp (18,99 ppt) và hoàn toàn có thể sử dụng để phân tích hàm lượng siêu vết thủy ngân.
3.5.6. Kỹ thuật điện hóa làm sạch điện cực
Bước làm sạch điện hóa là bước cần thiết nhằm loại bỏ Hg (II) trên bề mặt điện cực biến tính sau mỗi lần đo để tiến hành cho các lần làm giàu và đo tiếp theo. Để làm sạch, tiến hành hai bước áp thế:
Bước 1: Áp thế E1=-0,4 V trong thời gian 60 giây. Với việc áp thế đủ âm, Hg
(II) còn lại trên bề mặt điện cực của lần đo trước sẽ được chuyển thành Hg (0).
Bước 2: Áp thế E2= 0,65 V trong thời gian 60 giây. Giá trị thế này được lựa chọn để đủ dương hơn so với thế píc tại 0,52 V trên phổ đồ DPASV nhằm đảm bảo
quá trình ôxy hóa chuyển thành Hg(II) được hoàn toàn và khuếch tán vào trong dung dịch.
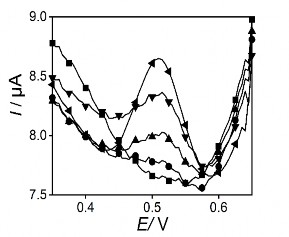
Sau khi áp thế làm sạch, bề mặt điện cực được kiểm tra lại như hình 3.35.
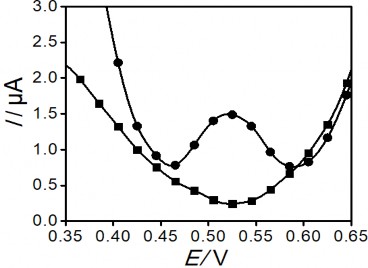
Hình 3. 35. Đường DPASV của điện cực PET-SAM trước (●) và sau (■) khi làm sạch bằng phương pháp điện hóa. Phổ Von-Ampe đo với mẫu có chứa Hg 1ppb
Kết quả cho thấy sau khi áp thế với thời gian 60 giây làm sạch điện cực phổ đồ không còn xuất hiện píc thủy ngân, điều đó chứng tỏ điện cực sau mỗi lần đo đã được làm sạch để sử dụng cho lần tiếp theo.
3.6. Ứng dụng phân tích Hg (II) trong mẫu thực
Để đánh giá khả năng phân tích Hg (II) của điện cực biến tính, một số mẫu nước biển và mẫu nước thải nhà máy đã qua xử lý đã được phân tích.
3.6.1. Phân tích mẫu giả trong phòng thí nghiệm
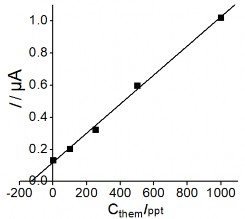
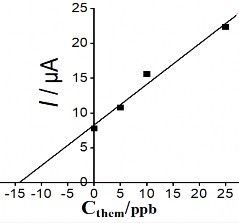
Mức độ tin cậy về khả năng phân tích phát hiện Hg (II) trong mẫu nước của điện cực chế tạo đã được nghiên cứu. Tiến hành pha mẫu giả có nồng độ Hg (II) 1ppb bằng nước cất hai lần để kiểm chứng, và thêm 5 nồng độ khác nhau để xây dựng đường thêm chuẩn. Các điều kiện cho việc tiến hành đo dựa trên các kết quả nghiên cứu tìm điều kiện tối ưu đã trình bày ở trên, sử dụng điện cực PET-SAM/AuNP để phân tích. Hình 3.36 biểu diễn đại diện phổ DPASV và đường thêm chuẩn của phép phân tích mẫu giả:
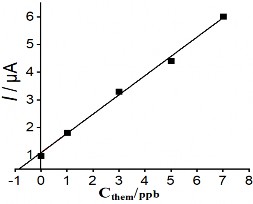
Hình 3. 36. Đường thêm chuẩn (hình trái) và phổ DPASV (hình phổ) của phép phân tích mẫu giả có nồng độ 1 ppb
Số lần phân tích mẫu giả được tiến hành lặp lại 3 lần để lấy trung bình và tính sai số của phép phân tích. Kết quả nồng độ Hg (II) trong mẫu giả được trình bày ở bảng 3.15 dưới đây:
Bảng 3. 15. Kết quả phân tích mẫu giả sử dụng phương pháp điện hóa
Số lần đo | Gía trị trung bình (ppb) | Độ lệch chuẩn | Độ lệch chuẩn tương đối | |||
Lần 1 (ppb) | Lần 2 (ppb) | Lần 3 (ppb) | ||||
1 | 0,985 | 1.010 | 0,982 | 0,992 | 0,015 | 1,512 % |
Đồng thời với việc phân tích mẫu giả bằng phương pháp điện hóa, mẫu giả được phân tích bằng phương pháp quang phổ hấp phụ nguyên tử (AAS) để so sánh. Kết quả của hai phương pháp được trình bày ở bảng sau:
Bảng 3. 16. So sánh kết quả phân tích Hg (II) trong mẫu giả giữa phương pháp điện hóa và phương pháp AAS
Phương pháp điện hóa (ppb) | Phương pháp AAS (ppb) | Sai số giữa hai phương pháp | |
1,000 | 0,992 | 0,960 | 3,225 % |
So sánh kết quả phân tích mẫu giả bằng phương pháp điện hóa và AAS cho thấy kết quả phân tích bằng điện hóa có sai số so với nồng độ Hg (II) trong mẫu giả là 0,800 %. Kết quả phân tích bằng phương pháp AAS so với nồng độ Hg (II) trong
mẫu giả có sai số là 4` %. Sai số giữa hai phương pháp đối với mẫu giả là 3,225 %. Kết quả phân tích mẫu giả trên cho thấy khả năng phân tích phát hiện Hg (II) đối với điện cực chế tạo là đáng tin cậy.
3.6.2. Kết quả đo mẫu thực trong phòng thí nghiệm
3.6.2.1. Kết quả đo mẫu nước biển và nước thải công nghiệp qua xử lý
Để đánh giá khả năng phân tích Hg (II) của điện cực biến tính, một số mẫu nước biển và nước thải công nghiệp đã qua xử lý tại những địa điểm khác nhau đã được phân tích tại phòng thí nghiệm nhằm phân tích đánh giá đối với đa dạng loại mẫu có các thành phân khác nhau.
Mẫu nước biển được lựa chọn bởi hàm lượng các chất ô nhiễm trong loại mẫu này rất thấp, trong đó có thuỷ ngân do có nhiều nguồn xả thải đổ ra biển, nên để phân tích phát hiện thuỷ ngân trong loại mẫu này đòi hỏi phương pháp phân tích phải có độ nhạy rất cao. Các mẫu nước biển tại Hải Tiến (Thanh Hóa), Lạch Vạn (Nghệ An) đã được lấy để phân tích đánh giá khả năng phát hiện lượng vết Hg (II) đối với điện cực chế tạo. Các kết quả phân tích được xác định bằng phương pháp thêm chuẩn. Chiều cao píc Hg (II) được xác định từ phổ đồ Von-Ampe như trình bày dưới đây:
٭ Mẫu nước biển Hải Tiến (Thanh Hóa):
|
Hình 3. 37. Đồ thị thêm chuẩn (hình trái) và đường DPASV (hình phải) xác định Hg
(II) trong mẫu nước biển Hải Tiến (Thanh Hóa)
٭ Mẫu nước biển Lạch Vạn (Nghệ An)
|
Hình 3. 38. Đồ thị thêm chuẩn (hình trái) và đường DPASV (hình phải) xác định Hg
(II) trong mẫu nước biển Lạch Vạn (Nghệ An).
Không chỉ tiến hành phân tích đối với mẫu nước biển, mẫu nước thải công nghiệp đã qua xử lý cũng được lấy để phân tích Hg (II). So với nước biển, nước thải công nghiệp có thành phần phức tạp hơn do chứa nhiều chất ô nhiễm, vô cơ, hữu cơ, kim loại nặng. Do vậy, để giảm thiểu sự ảnh hưởng của các chất ô nhiễm đến quá trình phân tích, mẫu nước được lấy tại vị trí không có sự xả thải trực tiếp nước thải công nghiệp, nước thải sinh hoạt. Kết quả phân tích Hg (II) được xác định bằng phương pháp thêm chuẩn. Chiều cao píc Hg (II) được xác định từ phổ đồ Von-Ampe như trình bày dưới đây:
٭ Mẫu nước thải nhà máy bóng đèn phích nước Rạng Đông (Hà Nội)
|
Hình 3. 39. Đồ thị thêm chuẩn (hình trái) và đường DPASV (hình phải) xác định Hg
(II) trong mẫu nước thải nhà máy bóng đèn phích nước Rạng Đông (Hà Nội)
Bảng 3. 17. Kết quả phân tích Hg (II) trong mẫu thực
Phương pháp xác định nồng độ Hg (II) | |||
Phương pháp điện hóa (ppb) | Phương pháp AAS (viện Hóa học) (ppb) | Phương pháp AAS (viện Môi trường) (ppb) | |
Biển Lạch Vạn | 0,151 | < 0,5 | |
Biển Hải Tiến | 0,045 | < 0,5 | |
Nước thải nhà máy bóng đèn Rạng Đông | 14,601 | 15,260 |
Kết quả phân tích bằng phương pháp điện hóa cho thấy mẫu Hg (II) ở nồng độ vết, cỡ ppt thì điện cực biến tính bởi SAM vẫn có khả năng phát hiện được. So sánh với các kết quả phân tích bằng phương pháp AAS cho thấy các kết quả thu được bằng phương pháp điện hóa có độ chính xác có thể chấp nhận được.
3.6.2.2. Kết quả đo mẫu nước sông Tô Lịch được xử lý bằng phương pháp điện hóa
Với mục đích thử nghiệm khả năng phân tích của điện cực biến tính SAM đối với Hg(II) trong một số loại mẫu khác nhau, mẫu nước thải sinh hoạt cũng đã được nghiên cứu thử nghiệm. Đối vói loại mẫu nước thải này, nghiên cứu đã sử dụng phương pháp điện hóa để tiền xử lý các chất hữu cơ có trong mẫu nước thải nhằm giảm thiểu sự ảnh hưởng của chúng trong quá trình đo. Sử dụng phương pháp điện hóa có ưu điểm hơn so với phương pháp khác là tránh tạo ô nhiễm thứ cấp đối với mẫu bằng cách đưa thêm hóa chất có vai trò tác nhân oxi hóa vào mẫu.
Phương pháp xử lý điện hóa còn có ưu điểm là có thể oxi hóa trực tiếp các chất ô nhiễm khi bị hấp phụ lên trên bề mặt anot, cũng như oxi hóa gián tiếp thông qua sự tạo thành tác nhân oxi hóa hypoclorit. Nhờ đó, các chất ô nhiễm sẽ bị xử lý ngay trong lòng dung dịch. Để giảm thiểu ảnh hưởng của bước xử lý điện hóa đến quá trình phân tích phát hiện, điện cực Pt đã được sử dụng làm anot, catot và bổ sung vào một lượng KCl vào mẫu để tạo tác nhân oxy hóa OCl- là sản phẩm của quá trình điện hóa trên anot nhằm oxi hóa gián tiếp các chất ô nhiễm có trong mẫu nước như phản ứng sau:
Trên anot: Trên catot:
2Cl- → Cl2 + 2e-
H2O + 2e- → H2 + 2OH-
Trong dung dịch, xảy ra các quá trình:
Cl2 + H2O → HClO + H+ + Cl-HClO → H+ + ClO-
Mẫu nước được lựa chọn tiến hành nghiên cứu thử nghiệm tiền xử lý là nước sông Tô Lịch. Điện cực PET-AET-SAM/AuNP+GO với ưu điểm: khoảng tuyến tính rộng, giới hạn phát hiện thấp và có độ bền lên đến 112 lần như đã trình bày ở trên đã được sử dụng để đo mẫu. Kết quả mẫu trước và sau xử lý điện hóa được thể hiện trên hình 3.40:
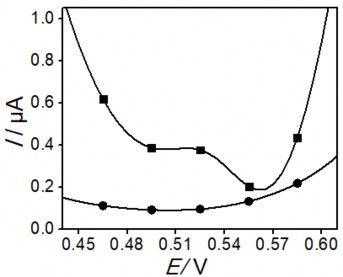
Hình 3. 40. Đường DPASV phat hiện Hg (II) của mẫu nước không qua xử lý (■) và được xử lý điện hóa (●), sử dụng điện cực PET-AET-SAM / AuNP - GO
Kết quả DPASV cho thấy mẫu không qua xử lý không xuất hiện tín hiệu Hg (II). Ngược lại, đối với mẫu được xử lý điện hóa, có sự xuất hiện píc Hg (II) tại thế 0,52 V. Kết quả cho thấy nhờ có quá trình oxi hóa diễn ra tại anot nên các chất hữu cơ có trong mẫu nước thải đã bị phân huỷ, dẫn đến giảm thiểu sự ảnh hưởng của chúng đến việc xác định Hg (II), và tạo ra sự xuất hiện của pic như trên hình 3.40.