có chứa sẵn 50ml các môi trường khác nhau có thành phần như bảng 2.4 [133]. Chủng vi khuẩn được nuôi trên máy lắc với tốc độ 150 vòng/phút, thời gian nuôi 24 giờ. Thí nghiệm được bố trí theo kiểu đầy đủ ngẫu nhiên với 3 lần lặp lại.
+ Chỉ tiêu theo dõi: Mật độ vi khuẩn (CFU/ml) được nuôi trong các môi trường trên sau khi lên men trong bình tam giác.
pH
+ Chuẩn bị giống cấp 1: Cấy chủng vi khuẩn tuyển chọn từ ống giống vào bình tam giác có chứa 50ml môi trường đã được khảo sát ở trên (môi trường đã hấp khử trùng ở 121oC trong 15 phút). Nuôi vi khuẩn trên máy lắc với tốc độ 150 vòng/phút, thời gian 24 giờ, điều chỉnh để đạt mật độ 108 CFU/ml
+ Lên men trong bình tam giác: Chuyển 1ml giống cấp 1 với mật độ 108 CFU/ml vào 50ml môi trường thích hợp cho mỗi chủng ở các điều kiện pH 5; 5,5; 6; 6,5; 7; 7,5; 8; 8,5 và 9 [132]. Các chủng vi khuẩn được nuôi trên máy lắc với tốc độ 150 vòng/phút, thời gian 24 giờ. Thí nghiệm được bố trí theo kiểu đầy đủ ngẫu nhiên với 3 lần lặp lại.
+ Chỉ tiêu theo dõi: Mật độ vi khuẩn (CFU/ml) được nuôi trong các môi trường với các dãy pH khác nhau sau khi lên men trong bình tam giác.
Thời gian
- Chuẩn bị giống cấp 1: Chuẩn bị 4 bình tam giác chứa 50ml môi trường thích hợp đã khảo sát ở trên và hấp khử trùng ở 121oC trong 15 phút. Cấy vi khuẩn từ ống giữ giống vào 4 bình đã chuẩn bị, nuôi vi khuẩn ở các điều kiện thời gian khác nhau 12 giờ, 24 giờ, 36 giờ, 48 giờ trên máy lắc với tốc độ 150 vòng/phút.
- Lên men trong bình tam giác: Chuyển 10ml dung dịch vi khuẩn từ 4 bình giống cấp 1 của mỗi chủng vào 4 bình lên men chứa sẵn 65ml môi trường đã khảo sát ở trên (môi trường đã hấp khử trùng ở 121oC trong 15 phút). Các chủng vi khuẩn được lên men trong thời gian 0 giờ, 6 giờ, 8 giờ, 10 giờ trên máy lắc với tốc độ 150 vòng/phút. Thí nghiệm được bố trí theo kiểu đầy đủ ngẫu nhiên với 3 lần lặp lại.
- Chỉ tiêu theo dõi: Mật độ vi khuẩn (CFU/ml) tại các thời điểm lên men 0 giờ, 6 giờ, 8 giờ, 10 giờ.
Nhiệt độ
- Chuẩn bị giống cấp 1: Cấy vi khuẩn từ ống giống vào bình tam giác có chứa 50ml môi trường và pH thích hợp đã khảo sát ở trên (môi trường đã hấp khử trùng ở
121oC trong 15 phút). Vi khuẩn được nuôi trên máy lắc với tốc độ 150 vòng/phút, thời gian 24 giờ, điều chỉnh để đạt mật độ 108 CFU/ml.
- Lên men trong bình tam giác: Chuyển 1ml giống cấp 1 vào các bình tam giác có chứa sẵn 50ml môi trường và pH thích hợp đã khảo sát cho mỗi chủng vi khuẩn. Vi khuẩn được nuôi trong tủ ấm ở các dãy nhiệt độ 29oC, 31oC, 33oC, 35oC, 37oC, 39oC với thời gian lên men tối ưu đã được khảo sát ở trên. Thí nghiệm được bố trí theo kiểu đầy đủ ngẫu nhiên với 3 lần lặp lại.
- Chỉ tiêu theo dõi: Mật độ vi khuẩn (CFU/ml) được nuôi trong các môi trường với nhiệt độ nuôi cấy khác nhau sau khi lên men trong bình tam giác.
Tốc độ lắc
- Chuẩn bị giống cấp 1: Cấy vi khuẩn từ ống giống vào bình tam giác có chứa sẵn 50ml môi trường đã được hấp khử trùng ở 121oC trong 15 phút. Nuôi vi khuẩn trên máy lắc với thời gian 24 giờ, tốc độ 150 vòng/phút.
- Chuẩn bị lên men trong bình tam giác: Chuyển giống cấp 1 vào các bình tam giác có chứa sẵn các môi trường và pH thích hợp đã khảo sát, hấp khử trùng ở 121oC trong 15 phút. Nuôi vi khuẩn trên máy lắc với thời gian, nhiệt độ đã khảo sát, tốc độ lắc 0 vòng/ phút, 100 vòng/ phút, 150 vòng/phút và 200 vòng/ phút và 250 vòng/phút.
- Chỉ tiêu theo dõi: Mật độ vi khuẩn (CFU/ml) được nuôi trong các môi trường với tốc độ lắc khác nhau sau khi lên men trong bình tam giác
Thí nghiệm 6: Phương pháp xác định đặc tính kháng Phytophthora, Fusarium của chủng vi khuẩn tuyển chọn
* Thời gian và địa điểm nghiên cứu: nghiên cứu được tiến hành từ tháng 04/2019 – 08/2019 tại phòng Công nghệ vi sinh, Viện CNSH&MT và phòng Công nghệ vi sinh, Bộ môn Sinh học, trường Đại học Tây Nguyên
* Đối tượng nghiên cứu: chủng vi khuẩn RB.DS29 kháng Phytophthora capsici, chủng vi khuẩn RB.CJ41 kháng nấm Fusarium oxysporum đã được tuyển chọn ở thí nghiệm 2.
* Ảnh hưởng của dịch nuôi cấy vi khuẩn có bổ sung bào tử Phytophthora capsici hoặc Fusarium oxysporum, casein, chitin, β-glucan đến khả năng ức chế Phytophthora capsici hoặc Fusarium oxysporum
- Xác định hoạt tính enzyme chitinase: Nuôi cấy vi khuẩn trong100ml môi trường đã được khảo sát ở thí nghiệm 5, có bổ sung chitin 1% không có agar ở 30oC, tốc độ lắc 150 vòng/phút, nuôi cấy trong 4 ngày, sau đó ly tâm dịch nuôi cấy (13000 vòng/ phút ở 4oC trong 5 phút) để loại bỏ vi khuẩn, thu dịch trong. Sử dụng một phần dịch trong để xác định hoạt tính chitinase (UI/ml) theo phương pháp định lượng đường khử dựa trên sản phẩm thủy phân chitin bởi chitinase là N – acetyl – glucosamine. Phần dịch trong còn lại được sử dụng để xác định hoạt tính kháng Phytophthora/Fusarium.
- Xác định hoạt tính enzyme protease: Nuôi cấy vi khuẩn trong 100ml môi trường đã được khảo sát ở thí nghiệm 5 có bổ sung casein 1% không có agar ở 37oC, tốc độ lắc 150 vòng/phút, nuôi cấy trong 4 ngày, sau đó ly tâm dịch nuôi cấy (13000 vòng/ phút ở 4oC trong 5 phút) để loại bỏ vi khuẩn, thu dịch trong. Sử dụng một phần dịch trong để xác định hoạt tính protease (UI/ml) theo phương pháp Anson cải biên dựa trên sản phẩm thủy phân casein bởi protease là tyrosin. Phần dịch trong còn lại được sử dụng để xác định hoạt tính kháng Phytophthora/Fusarium.
- Xác định hoạt tính enzyme β-glucanase: Nuôi cấy vi khuẩn trong 100ml môi trường đã được khảo sát ở thí nghiệm 5 có bổ sung β-glucan 0,1% không có agar ở 37oC, tốc độ lắc 200 vòng/phút, nuôi cấy trong 4 ngày, ly tâm dịch nuôi cấy (13000 vòng/ phút ở 4oC trong 5 phút) để loại bỏ vi khuẩn, thu dịch trong. Sử dụng một phần dịch trong để xác định hoạt tính β-glucanase (UI/ml) [134]. Phần dịch trong còn lại được sử dụng để xác định hoạt tính kháng Phytophthora/Fusarium.
- Chuẩn bị bào tử Phytophthora/Fusarium: Nuôi cấy Phytophthora/Fusarium trong 30ml môi trường Potato glucose (PG) lỏng, ở nhiệt độ phòng, tốc độ lắc 150 vòng/phút, thời gian nuôi cấy 36 giờ, điều chỉnh để đạt mật độ 107 CFU/ml. Ly tâm dịch nuôi cấy (4000 vòng/phút trong 5 phút) thu cặn chứa bào tử nấm. Bào tử nấm được hấp khử trùng ở 121oC, 1atm, thời gian 15 phút.
- Nuôi cấy vi khuẩn trong môi trường thích hợp bổ sung bào tử Phytophthora/Fusarium: Nuôi cấy vi khuẩn trong 100ml môi trường đã được khảo sát ở thí nghiệm 5 có bổ sung bào tử Phytophthora capsici hoặc Fusarium oxysporum ở điều kiện nhiệt độ 37oC, tốc độ lắc 150 vòng/phút trong 4 ngày. Ly tâm dịch nuôi cấy
(13000 vòng/ phút ở 4oC trong 5 phút), thu dịch trong. Sử dụng một phần dịch trong để xác định hoạt tính enzyme protease, chitinase, β-glucan. Phần dịch trong còn lại được sử dụng để xác định hoạt tính kháng Phytophthora/Fusarium và xây dựng mối tương quan giữa hoạt tính enzyme và hoạt tính đối kháng Phytophthora capsici hoặc Fusarium oxysporum
- Phương pháp xác định hoạt tính kháng Phytophthora/Fusarium của dịch nuôi cấy vi khuẩn trong môi trường có bổ sung bào tử Phytophthora/Fusarium, chitin 1%, casein 1%, β-glucan 0,1%: Phần dịch trong còn lại sau khi xác định hoạt tính enzyme được lọc qua màng lọc kích thước 0,2 µm để loại bỏ vi khuẩn. Chia dịch lọc làm 2 phần: một phần xử lý ở nhiệt độ 100oC trong 1 giờ và một phần không xử lý nhiệt. Tiến hành thử nghiệm tính đối kháng của dịch nuôi cấy trên môi trường PGA như sau: Đĩa đối chứng chỉ cấy Phytophthora capsici hoặc Fusarium oxysporum ở giữa đĩa petri. Đĩa thí nghiệm tiến hành trải 1ml dịch lọc đã được xử lý nhiệt hoặc chưa xử lý nhiệt trên môi trường PGA và cấy Phytophthora capsici hoặc Fusarium oxysporum vào giữa. Mỗi thí nghiệm thử tính đối kháng lặp lại 3 lần. Đặt các đĩa ở trong tủ ấm nhiệt độ 28oC. Chỉ tiêu theo dõi: Bán kính tản nấm và tính hiệu suất đối kháng theo công thức Abott sau 7 ngày nuôi cấy.
Cách tính hiệu suất đối kháng AE (%) = [(C - T)]/ C] × 100
Trong đó:AE (antagonistic efficacy): hiệu suất đối kháng; C: bán kính tản nấm ở đĩa đối chứng; T: bán kính tản nấm ở công thức thí nghiệm.
*Xác định thành phần hóa học trong dịch nuôi cấy của chủng vi khuẩn vùng rễ khả năng kháng Phytophthora capsici hoặc Fusarium oxysporum bằng phân tích LC- MS và GC-MS
- Chuẩn bị giống cấp 1: Nuôi cấy vi khuẩn trong 50 ml môi trường, điều kiện pH, nhiệt độ, tốc độ lắc thích hợp đã khảo sát ở thí nghiệm 5 trong 24 giờ, điều chỉnh để đạt mật độ 108 CFU/ml.
- Chuẩn bị dịch nuôi cấy vi khuẩn cho phân tích LC-MS, GC-MS: Bổ sung bào tử Phytophthora capsici hoặc Fusarium oxysporum đã hấp khử trùng (nhằm cảm ứng để vi khuẩn tổng hợp các hợp chất thứ cấp) và 2ml dịch nuôi cấy cấy vi khuẩn trong 100ml môi trường thích hợp cho mỗi chủng, tại các điều kiện pH, nhiệt độ, tốc độ lắc, thời gian thích hợp đã khảo sát ở thí nghiệm 5. Sau đó ly tâm dịch nuôi cấy (13000 vòng/ phút trong 10 phút, ở 4oC) để loại bỏ vi khuẩn, thu dịch trong. Dịch này
được gửi phân tích LC-MS và GC-MS tại Phòng phân tích trung tâm, Trường ĐH Khoa học Tự nhiên Tp. Hồ Chí Minh.
- Phương pháp LC-MS được tiến hành như sau: Lấy 2 ml dịch trong bổ sung 2ml acetonitrile, trộn đều sau đó ly tâm 6000v/ phút trong 5 phút thu dịch trong. Thể tích tiêm mẫu 20μl. Các mẫu được phân tích trên Hệ thống khối phổ MS/MS phân giải cao micrOTOF-QII Bruker Daltonic (Germany) có cấu tạo như sau: nguồn tạo ion theo kiểu ESI, bộ lọc ion gồm Dual Ion Funnel ghép với Hexapole, bộ cô lập khối Analytical Quadrupole, nguồn ion hóa nội CID, bộ tách khối phân giải cao TOF, đầu dò ion multichannel. Các dữ liệu được xử lý trên phần mềm Data Analysis (Bruker, Germany). Hệ thống sắc ký lỏng siêu cao áp Agilent 1290 (USA) bao gồm: bơm đôi cao áp (trộn dòng áp suất cao), bộ tiêm mẫu tự động, lò cột. Bộ bơm mẫu trực tiếp bằng Syringe (kdScientifit, USA). Các thông số được thiết lập như sau:
+ Pha tĩnh: cột ACE3- C18 (4.6 ![]() 150mm, 3,5 µm), được ổn nhiệt ở 400C.
150mm, 3,5 µm), được ổn nhiệt ở 400C.
+ Pha động: chương trình pha động được thực hiện theo Bảng 1 tại tốc độ dòng 0,5 mL/phút. Trong đó, pha A là dung dịch nước khử ion chứa 0,1 % acid formic và pha B là MeOH chứa 0,1 % acid formic.
Bảng 2.5. Chương trình pha động trên cột C18
%Pha A* | % Pha B* | |
0 | 90 | 10 |
2 | 90 | 10 |
20 | 5 | 95 |
30 | 5 | 95 |
Có thể bạn quan tâm!
-
 Tình Hình Nghiên Cứu Về Vi Sinh Vật Vùng Rễ Trên Cây Hồ Tiêu
Tình Hình Nghiên Cứu Về Vi Sinh Vật Vùng Rễ Trên Cây Hồ Tiêu -
 Phương Pháp Tuyển Chọn Các Chủng Vi Khuẩn Phân Lập Từ Vùng Rễ Cây Hồ Tiêu Tại Tây Nguyên, Định Danh Các Chủng Có Tiềm Năng Kháng Phytophthora, Fusarium
Phương Pháp Tuyển Chọn Các Chủng Vi Khuẩn Phân Lập Từ Vùng Rễ Cây Hồ Tiêu Tại Tây Nguyên, Định Danh Các Chủng Có Tiềm Năng Kháng Phytophthora, Fusarium -
 Sơ Đồ Bố Trí Thí Nghiệm Tuyển Chọn Chủng Vi Sinh Vật Vùng Rễ Có Khả Năng Kháng Nấm Fusarium Trên Cây Hồ Tiêu Con Trong Điều Kiện Vườn Ươm
Sơ Đồ Bố Trí Thí Nghiệm Tuyển Chọn Chủng Vi Sinh Vật Vùng Rễ Có Khả Năng Kháng Nấm Fusarium Trên Cây Hồ Tiêu Con Trong Điều Kiện Vườn Ươm -
 Quy Trình Phân Tách Các Hợp Chất Vk01, Vk02, Vk03 Và Vk05
Quy Trình Phân Tách Các Hợp Chất Vk01, Vk02, Vk03 Và Vk05 -
 Hiệu Quả Kháng Phytophthora Capsici Trên Đoạn Thân Hồ Tiêu
Hiệu Quả Kháng Phytophthora Capsici Trên Đoạn Thân Hồ Tiêu -
 Ảnh Hưởng Của Chủng Vi Khuẩn Đến Sinh Trưởng Rễ Của Cây Hồ Tiêu Sau 90 Ngày Lây Nhiễm Phytophthora
Ảnh Hưởng Của Chủng Vi Khuẩn Đến Sinh Trưởng Rễ Của Cây Hồ Tiêu Sau 90 Ngày Lây Nhiễm Phytophthora
Xem toàn bộ 224 trang tài liệu này.
(): tính theo % về thể tích
Độ đúng ion m/z được hiệu chỉnh trên dung dịch hiệu chỉnh ESI – L tuning mix bằng bộ bơm mẫu trực tiếp Syringe tại tốc độ 200 μL/giờ. Các thông số MS được thiết lập như sau: Thông số nguồn tạo ion ESI : Điện áp mao quản 4500V, áp suất máy phun sương 1.2Bar, khí khô 8L/ phút, nhiệt độ 200oC.; bộ lọc ion (Funnel) gồm thế RF 1 350V, thế RF2 360V, bộ cô lập ion (Q); năng lượng Ion 8eV, khối phổ thấp nhất 100m/z; nguồn tạo ion nội (CID) có điện thế 8eV, RF: 300V, bộ tách khối (TOF) có thời gian chuyển 120m/s.
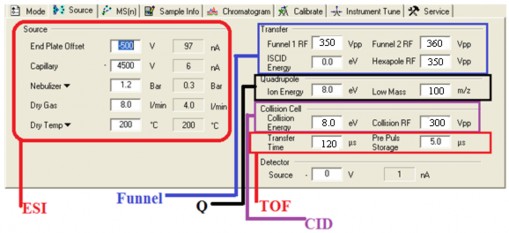
Hình 2.1. Thông số thiết bị MS/MS dùng để nhận danh
- Phương pháp GC-MS được tiến hành như sau: (1) Hút 10 mL mẫu vào ống 20 mL, gia nhiệt 50oC trong 30 phút. Hút 500 uL pha hơi tiêm vào máy GC-MS. (2) Hệ Headspace được bộ môn vật lý của trường chế tạo GC 6890 và MS 5972 của hãng Agilent; (3) Thông số MS là cột DB 5 MS, tốc độ khí He 1 mL/phút, tỷ lệ chia dòng 1:25, nhiệt độ buồng tiêm 250oC. Nhiệt độ lò cột tăng từ 50oC tới 250oC trong 20 phút. Nhiệt độ dòng chuyển 280oC; (4) Với mỗi phổ MS, thư viện đề xuất cho 3 hợp chất phù hợp nhất. ttong đó, mỗi chất được đề xuất có 1 điểm số. Chọn chất có điểm số cao nhất. Điểm số là con số nằm cuối dòng của mỗi hợp chất.
Thí nghiệm 7:Xác định đặc tính kháng tuyến trùng của chủng vi khuẩn tuyển chọn
* Thời gian và địa điểm nghiên cứu: nghiên cứu được tiến hành từ tháng 08/2019 đến tháng 12/2019 tại phòng Công nghệ Vi sinh - Viện CNSH&MT và phòng Công nghệ vi sinh, Bộ môn Sinh học, Khoa KHTN&CN, Trường Đại học Tây Nguyên.
* Đối tượng nghiên cứu: Chủng RB.EK7 có hoạt tính kháng tuyến trùng
Meloidogyne sp.
* Phương pháp xác định ảnh hưởng của dịch nuôi cấy vi khuẩn có bổ sung tuyến trùng, enzyme protease và chintinase đến tỷ lệ chết của tuyến trùng theo thời gian: Hút 200 𝛍l dịch vi khuẩn có bổ sung tuyến trùng, chitin, casein sau khi thu nhận vào ống eppendorf 1,5 ml chứa 100 𝛍l nước cất vô trùng có khoảng 30 tuyến trùng, bổ sung 100 𝛍g/ml streptomycine, 100 𝛍g/ml chloramphenicol, lắc đều. Ủ 20oC, theo dõi số tuyến trùng chết trong các ống eppendorf ở các thời điểm 12 giờ , 24 giờ và 48 giờ. Mỗi thí nghiệm lặp lại 3 lần. Thí nghiệm được tiến hành tương tự với dịch vi khuẩn có bổ sung tuyến trùng, chitin, casein đã bất hoạt bằng nhiệt độ. Mỗi thí nghiệm lặp lại 3 lần. Đồng thời xây dựng mối tương quan giữa hoạt tính enzyme và tỷ lệ chết của tuyến trùng.
Đối chứng môi trường: 200 𝛍l môi trường nuôi vi khuẩn + 0,1 ml nước cất vô trùng chứa khoảng 30 tuyến trùng + 100 𝛍g/ml streptomycine + 100 𝛍g/ml chloramphenicol, lặp lại 3 lần. Đối chứng nước: 0,1 ml nước cất vô trùng chứa khoảng 30 tuyến trùng + 200 𝛍l nước cất vô trùng, lặp lại 3 lần.
* Phương pháp xác định ảnh hưởng của enzyme protease và chitinase đến tỷ lệ nở của trứng tuyến trùng theo thời gian: Hút 200 μl dịch vi khuẩn có bổ sung tuyến trùng, chitin, casein sau khi thu nhận vào ống eppendorf 1.5ml chứa 100 μl nước cất vô trùng có khoảng 30 trứng tuyến trùng (Trứng được thu nhận bằng cách bóc trực tiếp từ rễ cây hồ tiêu bị u sưng), bổ sung 100 μg/ml streptomycine, 100 μg/ml chloramphenicol, lắc đều. Ủ 20oC, theo dõi số tuyến trùng chết trong các ống eppendorf ở các thời điểm 12 giờ, 24 giờ, 48 giờ và 72 giờ. Mỗi thí nghiệm lặp lại 3 lần. Thí nghiệm được tiến hành tương tự với dịch vi khuẩn có bổ sung tuyến trùng, chitin và casein đã bất hoạt bằng nhiệt độ. Đồng thời xây dựng mối tương quan giữa hoạt tính enzyme và tỷ lệ nở của trứng tuyến trùng.
Đối chứng môi trường: 200 𝜇l môi trường nuôi vi khuẩn +0,1 ml nước cất vô trùng chứa khoảng 30 trứng tuyến trùng + 100𝜇g/ml streptomycine+ 100𝜇g/ml chloramphenicol, lặp lại 3 lần. Đối chứng nước: 0,1 ml nước cất vô trùng chứa khoảng 30 tuyến trùng + 200 𝜇l nước cất vô trùng, lặp lại 3 lần.
* Xác định thành phần hóa học trong dịch nuôi cấy của chủng vi khuẩn vùng rễ có khả năng kháng Phytophthora bằng phân tích LC-MS và GC-MS
Chuẩn bị dịch vi khuẩn vùng rễ cho phân tích LC-MS, GC-MS: Bổ sung tuyến trùng đã hấp khử trùng và 1ml dịch nuôi cấy vi khuẩn vùng rễ trong 100ml môi trường thích hợp tại các điều kiện pH, nhiệt độ, tốc độ lắc, thời gian đã khảo sát. Sau đó ly tâm dịch nuôi cấy (13000 vòng/ 10 phút, ở 4oC) để loại bỏ vi khuẩn, thu dịch trong. Dịch này được gửi đi phân tích LC-MS và GC-MS tại Phòng phân tích trung tâm, Trường ĐH Khoa học Tự nhiên Tp. Hồ Chí Minh. Địa chỉ: 227 Nguyễn Văn Cừ, Q.5, Tp. Hồ Chí Minh. Phương pháp LC- MS và GC- MS được thực hiện tương tự như ở thí nghiệm 6.
Thí nghiệm 8:Phân tách, xác định cấu trúc và hoạt tính kháng tuyến trùng, kháng nấm của các hợp chất thứ cấp từ chủng vi sinh vật tuyển chọn
* Thời gian và địa điểm nghiên cứu: Nghiên cứu được tiến hành từ tháng 01/2020 đến 09/2020 tại Phòng Công nghệ vi sinh, Bộ môn Sinh học, phòng Phân tích sắc ký, Viện CNSH&MT, trường Đại học Tây Nguyên, và Khoa Hóa, Trường
ĐH KHTN Tp. Hồ Chí Minh.
* Đối tượng nghiên cứu: Chủng RB.EK7 có hoạt tính kháng tuyến trùng
Meloidogyne sp.
* Phân tách các hợp chất thứ cấp từ chủng vi sinh vật tuyển chọn
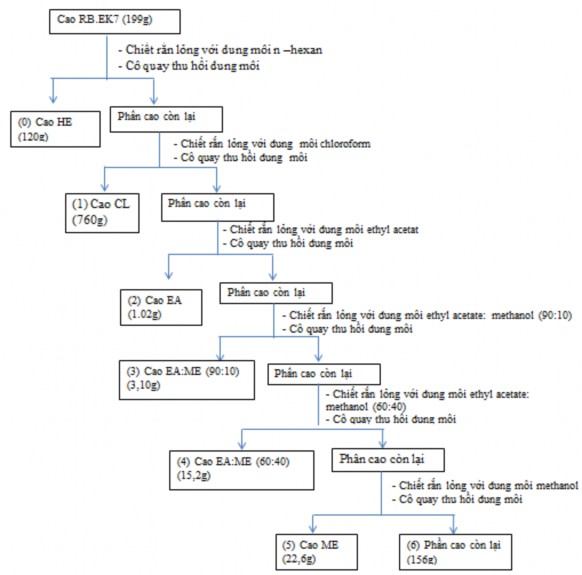
Hình 2.2 Quy trình điều chế cao chiết
Chủng RB.EK7 có hoạt tính kháng tuyến trùng nuôi cấy trên môi trường (thể tích 28 lít), pH, nhiệt độ, tốc độ lắc, thời gian đã được khảo sát bổ sung tuyến trùng và trứng tuyến trùng. Sau đó ly tâm dịch nuôi cấy 8000 vòng/ phút trong 15 phút, ở 4oC để loại bỏ vi khuẩn, thu dịch trong. Dịch này đem đi cô cạn đạt khối lượng 199g tiến hành trích rắn lỏng với các dung môi, hệ dung môi n-hexane, chloroform, ethyl acetate, ethyl acetate: methanol (90:10), ethyl acetate: methanol (60 :40), methanol thu được các dịch trích và được cô quay thu hồi dung môi dưới áp suất kém, thu được các loại cao tương ứng có khối lượng như sau: (1) Cao n-hexane (0): Dạng rắn, màu