2.2. Phương pháp nghiên cứu
2.2.1. Phương pháp tuyển chọn các chủng vi khuẩn phân lập từ vùng rễ cây hồ tiêu tại Tây Nguyên, định danh các chủng có tiềm năng kháng Phytophthora, Fusarium và kháng tuyến trùng Meloidogyne gây bệnh rễ trên cây hồ tiêu tại Tây Nguyên
2.2.1.1. Phương pháp thu mẫu, bảo quản mẫu rễ cây hồ tiêu và phân lập các chủng vi khuẩn vùng rễ cây hồ tiêu
* Thời gian và địa điểm nghiên cứu: Các mẫu rễ được thu thập từ tháng 5/2017
– 12/2017 tại ba tỉnh trồng hồ tiêu có diện tích và sản lượng lớn nhất Tây Nguyên và Việt Nam là Đắk Lắk, Gia Lai và Đắk Nông.
Đắk Lắk bao gồm các huyện Cư Kuin, Buôn Hồ, Ea Kar, Krông Năng và Buôn Ma Thuột; Gia Lai bao gồm các huyện Chư Sê, Chư Pứh, Đức Cơ; Đắk Nông bao gồm các huyện Cư Jut, Đắk Song, Đắk Rlấp. Mỗi huyện chọn 1-3 vườn; mỗi vườn thu 5 mẫu.
* Phương pháp lấy mẫu: Mẫu rễ được thu ở các vườn hồ tiêu sinh trưởng khỏe, năng suất cao, ổn định, ít bị bệnh rễ hoặc tại các cây hồ tiêu khỏe mạnh trên vườn tiêu bệnh. Thu rễ ở cây hồ tiêu 3 đến 10 năm tuổi (Đặc điểm vườn thu mẫu ở Phụ lục 1). Chọn mẫu rễ non và rễ tơ vì đây là nơi có nhiều vi sinh vật tập trung. Thu rễ phần rìa ngoài cách trụ tiêu với bán kính khoảng 1,0- 1,5m; độ sâu rễ từ 10 -20 cm, lấy khoảng 10cm từ đầu nút của rễ vào bên trong. Mẫu rễ sau đó sẽ được giữ trong túi polyethylen vô trùng, chuyển về phòng thí nghiệm để phân lập ngay. Nếu chưa kịp xử lý, cần bảo quản trong tủ lạnh ở 4oC cho đến khi tiến hành phân lập.
* Lưu ý: kiểm tra cách lấy mẫu, các thông tin ghi trên mẫu, thời gian từ khi lấy mẫu đến khi phân lập không quá 15 ngày và giữ ở tủ lạnh 4oC để đảm bảo không ảnh hưởng đến các chủng vi sinh vật vùng rễ cây hồ tiêu.
Thí nghiệm 1: Phân lập các chủng vi khuẩn vùng rễ cây hồ tiêu.
Phân lập vi khuẩn vùng rễ hồ tiêu được thực hiện theo quy trình của White và cộng sự (2015) có cải tiến cho phù hợp với đối tượng cây trồng [119]. Tóm tắt như sau: Cân khoảng 5g/mẫu rễ hồ tiêu, cắt ngắn khoảng 1-2cm cho vào bình tam giác 100ml, bổ sung 15ml nước cất đã hấp khử trùng lắc cho sạch đất và thu dịch lần 1, rễ tiếp tục cho vào bình tam giác 100ml, bổ sung 15ml nước cất đã hấp khử trùng lắc cho sạch đất và thu dịch lần 2, rễ tiếp tục cho vào bình tam giác 100ml và bổ sung
15ml nước cất đã hấp khử trùng lắc cho sạch đất thu dịch lần 3. Sau đó cho các mẩu rễ vào các ống ly tâm nhựa 25ml (Falcon 25 ml) có chứa 15ml dung dịch PBST (đệm phốt phát + Muối sinh lý + Tween 20). Đặt các ống ly tâm vào bể siêu âm trong 60 giây, sau đó chuyển rễ sang ống ly tâm mới chứa 15 ml PBST, siêu âm tiếp 60 giây lần hai, chuyển rễ sang ống ly tâm thứ ba chứa 15 ml PBST và siêu âm trong 10 phút. Dịch thu được của các ống sau khi siêu âm được cấy trải trên môi trường TSA bằng phương pháp pha loãng (theo Nguyễn Lân Dũng, 2009) để phân lập vi khuẩn vùng rễ cây hồ tiêu [120]. Những khuẩn lạc trên môi trường TSA có hình thái, màu sắc giống nhau tạm coi là một chủng. Các chủng này được cấy ria, làm thuần và mã hóa chủng. Các chủng được mã hóa theo nguyên tắc là "RB". "Địa điểm thu mẫu viết tắt". Các địa điểm thu mẫu bao gồm Cư Kuin (CK), Buôn Hồ (BH), Ea Kar (EK), Krông Năng (KN) và Buôn Ma Thuột (BMT), Chư Sê (CS), Chư Pứh (CP), Đức Cơ (DC), Cư Jut (CJ), Đắk Song (DS), Đắk Rlấp (DR). Các chủng vi khuẩn vùng rễ sau khi mã hóa được cấy chuyền, giữ giống trên ống thạch nghiêng bảo quản ở điều kiện nhiệt độ 4oC và sử dụng cho các nghiên cứu tiếp theo.
2.2.1.2. Phương pháp tuyển chọn các chủng vi khuẩn phân lập từ vùng rễ cây hồ tiêu tại Tây Nguyên có tiềm năng kháng Phytophthora, Fusarium, tuyến trùng Meloidogyne gây bệnh rễ ở cây hồ tiêu
Thí nghiệm 2:Tuyển chọn các chủng vi khuẩn vùng rễ cây hồ tiêu có tiềm năng kháng Phytophthora, Fusarium, tuyến trùng Meloidogyne gây bệnh rễ ở cây hồ tiêu trong điều kiện in vitro
* Thời gian và địa điểm nghiên cứu: Nghiên cứu được tiến hành từ tháng 01/2018 đến tháng 12/2018 tại phòng Công nghệ Vi sinh, Viện CNSH&MT và phòng Công nghệ vi sinh, Bộ môn Sinh học, Khoa KHTN&CN, Trường Đại học Tây Nguyên.
* Đối tượng nghiên cứu: 269 chủng vi khuẩn đã được phân lập từ vùng rễ cây hồ tiêu tại Tây Nguyên ở thí nghiệm 1.
* Tuyển chọn các chủng vi khuẩn vùng rễ cây hồ tiêu có tiềm năng kháng Phytophthora capsici và Fusarium oxysporum trong điều kiện in vitro theo phương pháp của Toh và cộng sự (2016) [121]: Thử nghiệm tính đối kháng được thực hiện trên môi trường PGA. Đĩa đối chứng: Đĩa thạch cấy Phytophthora capsici hoặc Fusarium oxysporum ở giữa đĩa petri và không cấy vi khuẩn. Đĩa thí nghiệm: cấy các
chủng vi khuẩn thử nghiệm tính đối kháng (từng loại một) tại một điểm cách đều nhau và cách điểm cấy nấm bệnh một khoảng 3cm (cấy trước), sau đó cấy nấm bệnh ở giữa đĩa petri (cấy sau). Mỗi thí nghiệm thử tính đối kháng lặp lại 3 lần. Đặt các đĩa ở trong tủ ấm nhiệt độ 28oC, nếu xuất hiện các vùng ức chế (vòng vô khuẩn) nghĩa là có sự đối kháng tại điểm đó. Chỉ tiêu theo dõi: Bán kính tản nấm và tính hiệu suất đối kháng theo công thức Abott sau 7 ngày nuôi cấy.
Cách tính hiệu suất đối kháng AE (%) = [(C - T)]/ C] × 100
Trong đó:AE (antagonistic efficacy): hiệu suất đối kháng; C: bán kính tản nấm ở đĩa đối chứng; T: bán kính tản nấm ở công thức thí nghiệm
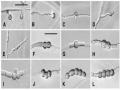
* Tuyển chọn các chủng vi khuẩn vùng rễ có hoạt tính kháng Phytophthora/ Fusarium trên đoạn thân hồ tiêu theo phương pháp của Dinu và cộng sự (2007) [122]: Cắt lươn tiêu (khoảng 8cm có chứa 1 đốt thân); Rửa sạch dưới vòi nước sau đó khử trùng với Javen 0,1% trong 10 phút; Loại bỏ Javen và rửa sạch với nước hấp khử trùng 5 lần; Đặt đoạn thân trên giấy thấm khử trùng khoảng 30 phút; Dùng kim tạo vết thương trên đoạn thân, cách đầu đoạn thân 0,5 cm, tạo khoảng 10 vết thương; Ngâm đoạn thân trong dịch huyền phù vi khuẩn mật độ bào tử 107 CFU/ml trong 60 phút, cách đầu đoạn thân tạo vết thương 1cm; Đặt đoạn thân trên giấy thấm khử trùng khoảng 30 phút; Ngâm đoạn thân trong dịch bào tử nấm bệnh Phytophthora/ Fusarium mật độ 107 CFU/ml trong 30 phút; Đặt đoạn thân trên giấy thấm khử trùng đã làm ướt, ủ trong tối 96 giờ; Đọc kết quả: Chiều dài đoạn thân hồ tiêu bị đen hoàn toàn do Phytophthor/ Fusarium. Đối chứng: thay dịch huyền phù vi khuẩn bằng nước cất hoặc môi trường. Các nghiệm thức được bố trí ngẫu nhiên, mỗi nghiệm thức gồm 5 đoạn thân với 3 lần lặp lại.
* Tuyển chọn các chủng vi khuẩn vùng rễ có tiềm năng kháng tuyến trùng trong điều kiện in vitro: Các chủng vi khuẩn vùng rễ được thử nghiệm hoạt tính kháng tuyến trùng qua 2 bước chính.
Bước 1: Sàng lọc sơ bộ hoạt tính kháng tuyến trùng của các chủng vi sinh vật vùng rễ cây hồ tiêu
Mục đích: Nhằm thu hẹp tổng số chủng vi khuẩn phải tập trung nghiên cứu, chúng tôi sử dụng phương pháp của Aravind và cộng sự (2009) đã cải tiến nhằm sàng lọc những chủng vi khuẩn có khả năng tiêu diệt tuyến trùng so với đối chứng [123].
Cách tiến hành: Nhân nuôi vi khuẩn vùng rễ cây hồ tiêu trong môi trường LB, nuôi cấy lắc với tốc độ 150 vòng/ phút, ở nhiệt độ phòng trong 12 giờ. Hút 0,4 ml huyền phù vi khuẩn đạt OD từ 0,2 - 0,3 ở bước sóng 610 nm cho vào eppendorf, ly tâm lạnh với tốc độ 8000 vòng/phút, 4oC trong 10 phút, thu cặn. Bổ sung vào mỗi eppendorf 0,2ml nước cất vô trùng chứa 30 tuyến trùng. Eppendorf được ủ ở nhiệt độ thường trong 24 giờ. Đối chứng là nước cất. Mỗi thí nghiệm thử nghiệm hoạt tính kháng lặp lại 3 lần. Đếm số tuyến trùng bị chết trong mỗi eppendorf bằng kính hiển vi soi nổi. Tuyến trùng được cho là đã chết khi kiểm tra thấy cơ thể chúng nằm bất động, duỗi thẳng, nội tạng bị phá hủy.
Bước 2: Tuyển chọn các chủng vi khuẩn có hoạt tính kháng tuyến trùng
Hoạt tính kháng tuyến trùng của các chủng vi khuẩn vùng rễ được thực hiện theo phương pháp của Aravind và cộng sự (2009) [123].
Các bước tiến hành:
- Xây dựng phương trình tương quan giữa chỉ số OD 610nm và số tế bào của từng chủng vi khuẩn vùng rễ đã được sàng lọc ở bước 1: Pha loãng huyền phù chứa vi khuẩn cần kiểm tra sao cho các dung dịch thu được khi đo trên máy so màu ở bước sóng 610nm được các trị số OD gần 0,1; 0,2; 0,3; 0,4; 0,5. Dùng phương pháp đếm khuẩn lạc xác định số lượng vi khuẩn có trong 1ml kí hiệu N/ml. Vẽ đồ thị thể hiện mối tương quan giữa mật độ tế bào và nồng độ pha loãng. Tính mật độ: Từ trị số OD đo được đối chiếu trên đồ thị tương quan giữa mật độ tế bào và OD để xác định số lượng tế bào.
- Tuyển chọn các chủng vi khuẩn có hoạt tính mạnh để tiếp tục cho nghiên cứu tiếp theo: Sau khi nhân nuôi vi khuẩn vùng rễ trong môi trường LB, nuôi cấy lắc với tốc độ 150 vòng/ phút ở nhiệt độ phòng trong 24 giờ. Hút 0,4 ml huyền phù vi khuẩn vùng rễ, mật độ 107 CFU/ml cho vào mỗi eppendortf, ly tâm lạnh với tốc độ 8000 vòng/phút trong 10 phút, 4oC, thu cặn, bỏ dịch. Bổ sung 0,2 ml nước cất vô trùng chứa 30 tuyến trùng. Eppendorf được ủ ở nhiệt độ phòng trong 24 giờ. Đối chứng là nước cất. Đếm số tuyến trùng chết trong mỗi eppendof bằng kính hiển vi soi nổi. Chỉ tiêu theo dõi: Số lượng tuyến trùng chết của các lô thí nghiệm so với lô đối chứng.
Tỷ lệ tuyến trùng chết được tính theo công thức:
𝑇ỉ 𝑙ệ 𝑡ử 𝑣𝑜𝑛𝑔 = 𝑠ố 𝑡𝑢𝑦ế𝑛 𝑡𝑟ù𝑛𝑔 𝑐ℎế𝑡 𝑥 100
𝑡ổ𝑛𝑔 𝑠ố 𝑡𝑢𝑦ế𝑛 𝑡𝑟ù𝑛𝑔
Thí nghiệm 3:Tuyển chọn các chủng vi khuẩn vùng rễ cây hồ tiêu có tiềm năng kháng Phytophthora, Fusarium, tuyến trùng Meloidogyne gây bệnh rễ ở cây hồ tiêu trong điều kiện vườn ươm
* Thời gian và địa điểm nghiên cứu:Nghiên cứu được tiến hành từ tháng 06/2018 – 06/2019 tại phòng Công nghệ Vi sinh, Viện CNSH&MT và vườn ươm số 68 Ywang, phường EaTam, Tp. Buôn Ma Thuột, tỉnh Đắk Lắk.
* Đối tượng nghiên cứu: Các chủng vi khuẩn vùng rễ cây hồ tiêu có tiềm năng kháng Phytophthora, Fusarium, tuyến trùng Meloidogyne đã được tuyển chọn từ thí nghiệm 1 bao gồm 7 chủng vi khuẩn vùng rễ kháng Phytophthora capsici, 06 chủng vi khuẩn vùng rễ kháng nấm Fusarium oxysporum và 06 chủng vi khuẩn vùng rễ có kháng tuyến trùng Meloidogyne.
* Phương pháp chung:
- Chuẩn bị vườn ươm: vườn ươm cần có lưới che phía trên và xung quanh có nhiệt độ từ 25-30oC, độ ẩm từ 70 -80 %, cường độ ánh sáng 50-500 µmol m2/s- 1(đo từ 8h-16h).
- Chuẩn bị đất trồng hồ tiêu: Đất ươm tiêu phải chọn đất tốt, không lấy đất ở những vùng trồng cây đã bị tuyến trùng, nấm bệnh gây hại. Đất được đập nhỏ, tạo lớp mỏng phơi nắng 1 ngày trước khi vào bịch. Thành phần đất trồng trong bịch: tỷ lệ đất: cát: phân chuồng là 2:1:1. Phối trộn, ẩm độ 60 – 70%. Đóng bịch: 1 kg/ bịch. Hấp khử trùng: 90 – 95 oC, 1giờ, để nguội, ươm trồng hồ tiêu.
- Chuẩn bị bầu ươm hồ tiêu: Bầu ươm kích thước: 13 x 22cm; có 8 lỗ thoát nước ở nửa dưới bầu phân bố thành 2 hàng, hàng dưới cách đáy bầu khoảng 2 cm.
- Chuẩn bị dịch vi khuẩn: Các chủng vi khuẩn được nuôi cấy trên môi trường LB Agar trong 24 giờ, sau đó chuyển vào bình 200ml chứa môi trường LB lỏng, ủ trong máy lắc với tốc độ 150 vòng/ phút trong 2 ngày ở 25oC. Tế bào vi khuẩn được điều chỉnh ở mật độ 108CFU/ml được coi là dịch khuẩn gốc.
- Chuẩn bị hom giống hồ tiêu: Theo Tiêu chuẩn cơ sở về cây giống Hồ tiêu (TCCS 07: 2012/BP). Chọn dây lươn giống tiêu Vĩnh Linh. Đối với hom dây lươn chọn những dây lươn bánh tẻ, cắt thành các hom giống, mỗi hom 2 đốt. Dây lươn không sâu bệnh, được lấy ở các vườn tiêu 4 tuổi không có triệu chứng bệnh. Hom được cắt hết lá khi đem ươm, cắt hom vào buổi sáng, khi trời mát.
Thí nghiệm 3.1: Tuyển chọn các chủng vi khuẩn vùng rễ có tiềm năng kháng Phytophthora capsici trong điều kiện vườn ươm
- Phương pháp bố trí thí nghiệm: gồm 9 nghiệm thức (2 nghiệm thức đối chứng và 7 nghiệm thức sử dụng vi khuẩn), được bố trí với 3 lần lặp lại. Ngâm hom trong 10 ml dịch vi khuẩn với mật độ108CFU/ml, thời gian 30 phút trước khi giâm hom. Giâm hai hom/bầu. Mỗi nghiệm thức 15 bầu. Chăm sóc cây hồ tiêu theo đúng quy trình chăm sóc cây trong vườn ươm của Bộ Nông Nghiệp và Phát Triển Nông Thôn (quyết định số 730/QĐ-BNN-TT). Sau khi tiêu đạt 5 lá thật, loại bỏ những cây không đủ số lá, 1 cây con/bầu, chiều cao đồng đều, tiến hành lây bệnh nhân tạo. Các nghiệm thức RB.BH15, RB.DS29, RB.CS1, RB.CP15, RB.CJ35, RB.EK2, RB.EK4 và ĐC2
được lây bệnh nhân tạo với Phytophthora, sau 15 ngày tưới các chủng vi khuẩn với mật độ đã chuẩn bị lần lượt là RB.BH15, RB.DS29, RB.CS1, RB.CP15, RB.CJ35, RB.EK2, RB.EK4. Nghiệm thức ĐC1: Không lây nhiễm nấm bệnh và không bổ sung vi khuẩn.
- Chuẩn bị nguồn bệnh cho lây bệnh nhân tạo: Phytophthora capsici được nhân sinh khối để thực hiện các thí nghiệm lây bệnh. Chủng nấm P.capsici được nuôi cấy trên môi trường PGA trong 5 ngày, ở 28oC. Chuyển sợi nấm sang bình tam giác chứa 50 ml môi trường PG (Potato Glucose) lỏng, nuôi cấy lắc với tốc độ 150 vòng/ phút trong 2 ngày ở 28oC. Mật độ bào tử được điều chỉnh để đạt 107CFU/ml được coi là dịch gốc.
- Phương pháp lây bệnh nhân tạo: Thí nghiệm lây bệnh nhân tạo được tiến hành trong nhà lưới, thí nghiệm được bố trí theo kiểu đầy đủ ngẫu nhiên. Tổng số cây thí nghiệm: 9 nghiệm thức x 15 cây/ nghiệm thức x 3 lần lặp lại = 405 cây. Giữa các lô thí nghiệm (lô 1, lô 2 và lô 3 tương ứng với 3 lần lặp lại) cách nhau 60cm và giữa các nghiệm thức trong cùng một lô cách nhau 50 cm. Thí nghiệm được bố trí theo bảng
2.1. Chủng nhiễm 10ml dịch bào tử Phytophthora (mật độ107CFU/ml) đã chuẩn bị vào mỗi bầu hồ tiêu. Sau 7 ngày bổ sung 10ml dịch vi khuẩn vùng rễ với mật độ (mật độ108CFU/ml)/bầu.
Bảng 2.1 Sơ đồ bố trí thí nghiệm tuyển chọn các chủng vi khuẩn vùng rễ có tiềm năng kháng Phytophthora capsici
I | II | III | |
1 | RB.BH15 | ĐC2 | RB.CP15 |
2 | RB.EK2 | RB.CS1 | RB.DS29 |
3 | RB.CS1 | RB.CJ35 | ĐC2 |
4 | RB.CP15 | RB.EK2 | RB.BH15 |
5 | RB.DS29 | RB.EK4 | RB.CS1 |
6 | ĐC1 | RB.DS29 | RB.CJ35 |
7 | RB.EK4 | RB.BH15 | RB.EK2 |
8 | RB.CJ35 | RB.CP15 | ĐC1 |
9 | ĐC2 | ĐC1 | RB.EK4 |
Có thể bạn quan tâm!
-
 Bệnh Chết Chậm Trên Cây Hồ Tiêu Do Nấm Fusarium Sp. Và Tuyến Trùng
Bệnh Chết Chậm Trên Cây Hồ Tiêu Do Nấm Fusarium Sp. Và Tuyến Trùng -
 Các Giải Pháp Tổng Hợp Để Kiểm Soát Dịch Bệnh Trên Cây Hồ Tiêu Và Sản Xuất Bền Vững
Các Giải Pháp Tổng Hợp Để Kiểm Soát Dịch Bệnh Trên Cây Hồ Tiêu Và Sản Xuất Bền Vững -
 Tình Hình Nghiên Cứu Về Vi Sinh Vật Vùng Rễ Trên Cây Hồ Tiêu
Tình Hình Nghiên Cứu Về Vi Sinh Vật Vùng Rễ Trên Cây Hồ Tiêu -
 Sơ Đồ Bố Trí Thí Nghiệm Tuyển Chọn Chủng Vi Sinh Vật Vùng Rễ Có Khả Năng Kháng Nấm Fusarium Trên Cây Hồ Tiêu Con Trong Điều Kiện Vườn Ươm
Sơ Đồ Bố Trí Thí Nghiệm Tuyển Chọn Chủng Vi Sinh Vật Vùng Rễ Có Khả Năng Kháng Nấm Fusarium Trên Cây Hồ Tiêu Con Trong Điều Kiện Vườn Ươm -
 Chương Trình Pha Động Trên Cột C18
Chương Trình Pha Động Trên Cột C18 -
 Quy Trình Phân Tách Các Hợp Chất Vk01, Vk02, Vk03 Và Vk05
Quy Trình Phân Tách Các Hợp Chất Vk01, Vk02, Vk03 Và Vk05
Xem toàn bộ 224 trang tài liệu này.

- Chỉ tiêu theo dõi sau 3 tháng lây nhiễm nấm bệnh:
+ Các chỉ tiêu sinh trưởng bao gồm (1) Số lá/cây: tính bằng cách đếm tất cả số lá có trên dây tiêu; (2) Diện tích lá (mm2) tính bằng cách sử dụng giấy đo diện tích lá chuyên dụng; (3) Chiều dài dây tiêu (cm) tính bằng cách đo từ gốc dây đến đỉnh; (4) Đường kính cây tiêu (mm) sử dụng thước cặp điện tử HT-022 chuyên dụng để đo đường kính thân; (5) Khối lượng cây tươi (g) cân toàn bộ cây tiêu. Thân cây được tính từ nơi mọc lên của từng hom tiêu, không kể đoạn hom. Trọng lượng tươi của cây xác định ngay sau khi nhổ cây; (6) Khối lượng rễ tươi (g) được tính bằng cách cân toàn bộ bộ rễ sau khi đã rửa sạch đất và để ráo nước; (7) Số rễ hồ tiêu được tính bằng cách đếm toàn bộ số rễ chính; (8) Chiều dài rễ (cm) được tính bằng cách đo chiều dài từ gốc rễ đến chóp rễ của rễ dài nhất; (9) Hàm lượng diệp lục tố (chlorophyll) được phân tích bằng phương pháp quang phổ (Yoshida và cộng sự (1976) [124]); (10) Mật độ VSV tổng số trong đất: Mật độ vi khuẩn tổng số được xác định bằng phương pháp xác định gián tiếp số lượng tế bào thông qua cách đếm số lượng khuẩn lạc mọc trên môi trường LB agar [125]. Mẫu sau khi trộn đều được nghiền mịn trong cối sứ vô trùng, cân 1 g mẫu cho vào 9 ml nước muối sinh lý vô trùng, đồng nhất mẫu rồi tiến hành pha loãng ở các độ pha loãng khác nhau. Lấy 0,1ml dung dịch mẫu ở các độ pha loãng khác nhau vào đĩa petri, dàn đều bằng que gạt thủy tinh vô trùng.
+ Số rễ bệnh để đánh giá tỷ lệ rễ bệnh
Tỷ lệ rễ bệnh (%) = (Tổng số rễ bị bệnh/ Tổng số rễ điều tra) x100
+ Số cây chết để đánh giá tỷ lệ cây chết
Tỷ lệ cây chết (%) = (Tổng số cây chết/ Tổng số cây điều tra) x100
+ Mật độ Phytophthora trong đất: Mẫu đất sau 90 ngày lây nhiễm với Phytophthora được gửi phân tích tại Viện CNSH&MT, trường Đại học Tây Nguyên. Phương pháp pha loãng dung dịch đất được sử dụng để phân lập, xác định mật độ các loài nấm bệnh trong đất. Môi trường chọn lọc PSM được sử dụng để phân lập và xác định mật độ Phytophthora.
1. Phơi mẫu đất cho khô trong bóng mát, dùng cối chày nghiền sơ đất (loại cối chày làm bằng đá dùng trong nấu bếp) và trộn đều.
2. Cho 10g mẫu đất vào một lọ có chứa 90ml thạch nước cất 0.01% đã hấp tiệt trùng, tạo dung dịch có độ pha loãng 10-1.
3. Đổ 10mL dung dịch sang lọ thứ hai chứa 90ml thạch nước cất 0.01% tạo dung dịch có độ pha loãng 10-2 và lắc đều để đảm bảo đất được phân tán đều trong dung dịch. Lặp lại bước này để có dung dịch với độ pha loãng 10-3.
4. Phân tán đều 1ml dung dịch đất trên bề mặt môi trường thạch trong một đĩa Petri đường kính 90mm:
• Chuẩn bị các đĩa môi trường thạch và để khô trong vài ngày để loại bỏ hơi nước đọng trên bề mặt đĩa
• Dùng pipette cẩn thận hút 1ml dung dịch đất cho vào một phía ở rìa của đĩa môi trường. Cầm đĩa hơi nghiêng từ mép có dung dịch và lắc nhẹ vuông góc với chiều dốc để dung dịch ướt đều trên bề mặt đĩa.
5. Đặt các đĩa thạch này dưới ánh sáng trong 5-7 ngày cho đến khi các tản nấm phát triển.
Nấm được định danh dựa vào khoá phân loại của Erwin và cộng sự (1996) [126]. Số lượng những đơn vị tạo khuẩn lạc (colony-forming units - CFU) này trong mỗi gram đất được tính như sau: Độ pha loãng × số khuẩn lạc trung bình của loài nấm trên các đĩa phân lập = CFU/g đất.