CHƯƠNG 3
VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU
3.1 Thời gian và địa điểm
Thời gian: 10/2009 – 12/2010
Địa điểm: Khoa Thủy Sản – Đại học Cần Thơ
3.2 Vật liệu nghiên cứu
Dụng cụ và thiết bị thí nghiệm: Kính hiển vi, cân điện tử, lame, lamelle, ống đong, ống nhỏ giọt nhựa, pipet, ống chích, khẩu trang, găng tay, bình tam giác, chai chịu nhiệt, que cấy, đèn cồn, viết lông dầu, bình xịt cồn, bộ tiểu phẩu, đĩa petri, ống nghiệm, khay nhôm.
Có thể bạn quan tâm!
-
 Sử dụng chất chiết xuất từ cây hoàng kỳ (astragalus membranaceus) để phòng bệnh mủ gan do vi khuẩn edwardsiella ictaluri trên cá tra (pangasinodon hypophthalmus). - 1
Sử dụng chất chiết xuất từ cây hoàng kỳ (astragalus membranaceus) để phòng bệnh mủ gan do vi khuẩn edwardsiella ictaluri trên cá tra (pangasinodon hypophthalmus). - 1 -
 Sử dụng chất chiết xuất từ cây hoàng kỳ (astragalus membranaceus) để phòng bệnh mủ gan do vi khuẩn edwardsiella ictaluri trên cá tra (pangasinodon hypophthalmus). - 2
Sử dụng chất chiết xuất từ cây hoàng kỳ (astragalus membranaceus) để phòng bệnh mủ gan do vi khuẩn edwardsiella ictaluri trên cá tra (pangasinodon hypophthalmus). - 2 -
 Thành Phần Hóa Học Và Tác Dụng Dược Lý Cây Hoàng Kỳ
Thành Phần Hóa Học Và Tác Dụng Dược Lý Cây Hoàng Kỳ -
 Ảnh Hưởng Của Chất Chiết Xuất Từ Cây Hoàng Kỳ Lên Các Chỉ Tiêu Huyết Học Của Cá Tra Cảm Nhiễm Vi Khuẩn E. Ictaluri.
Ảnh Hưởng Của Chất Chiết Xuất Từ Cây Hoàng Kỳ Lên Các Chỉ Tiêu Huyết Học Của Cá Tra Cảm Nhiễm Vi Khuẩn E. Ictaluri. -
 Ảnh Hưởng Của Chiết Xuất Hoàng Kỳ Lên Sự Nhiễm Bệnh Mủ Gan Do Vi Khuẩn
Ảnh Hưởng Của Chiết Xuất Hoàng Kỳ Lên Sự Nhiễm Bệnh Mủ Gan Do Vi Khuẩn -
 Sử dụng chất chiết xuất từ cây hoàng kỳ (astragalus membranaceus) để phòng bệnh mủ gan do vi khuẩn edwardsiella ictaluri trên cá tra (pangasinodon hypophthalmus). - 7
Sử dụng chất chiết xuất từ cây hoàng kỳ (astragalus membranaceus) để phòng bệnh mủ gan do vi khuẩn edwardsiella ictaluri trên cá tra (pangasinodon hypophthalmus). - 7
Xem toàn bộ 72 trang tài liệu này.
Bếp khuấy gia nhiệt, tủ cấy vô trùng, máy ly tâm lạnh, tủ lạnh, tủ cấy, tủ ấm, nồi thanh trùng, máy chuẩn độ pH. Các chỉ tiêu pH, Nhiệt độ, Oxy được đo bằng nhiệt kế và test kit.
Bể thí nghiệm: nhựa 250 lít, bể composit 2 m3

Hóa chất: NaCl, Na2SO4, Na2HPO4.2H2O, NaH2PO4.2H2O, KH2PO4, Formaline (37%), Methyl violet, nước cất, Methanol, Glycerol, dung dịch Wright&Giemsa, Acid nitric, môi trường TSA, NB, cồn đốt, cồn 700C.
Nguồn cá tra thí nghiệm được mua từ trại cá giống ở Thành phố Cần Thơ.
Chiết xuất hoàng kỳ (40% polysaccharide) do hãng Xuancheng Baicao, Trung Quốc sản xuất.
Nguồn vi khuẩn E. ictaluri CAF 258 từ bộ sưu tập vi khuẩn của Bộ môn Sinh học và Bệnh Thủy Sản, Khoa Thủy Sản, Đại Học Cần Thơ.
3.3 Phương pháp nghiên cứu
3.3.1 Phục hồi và nuôi tăng sinh vi khuẩn
Chủng vi khuẩn thí nghiệm được phục hồi trên môi trường TSA. Sau 48 giờ quan sát hình dạng, màu sắc khuẩn lạc và nhuộm gram kiểm tra tính thuần của chủng vi khuẩn được phân lập. Sau đó nuôi tăng sinh trong môi trường BHI để chuẩn bị cho thí nghiệm xác định LD50 và thí nghiệm cảm nhiễm.
3.3.2 Thí nghiệm xác định LD50 Chuẩn bị thí nghiệm
Cá tra thí nghiệm có trọng lượng 20-25g sau khi mua về được nuôi dưỡng trong bể có thể tích 1m3, có sục khí và cho ăn hằng ngày đến khi nào thấy cá ăn đều thì tiến hành thí nghiệm. Trước khi bố trí thí nghiệm cá được kiểm tra kí sinh trùng và vi khuẩn nhằm lựa chọn được cá khỏe.
Chuẩn bị vi khuẩn gây cảm nhiễm
Vi khuẩn được nuôi tăng sinh trong 200ml môi trường BHI và ủ qua đêm ở 28-300C trên máy lắc 180 vòng/phút. Sau đó vi khuẩn được cho vào ống falcon tiệt trùng (50ml) và ly tâm 5.000 r.p.m trong 10 phút ở 4 0C để thu vi khuẩn. Vi khuẩn được rửa qua nước muối sinh lý (0,9% NaCl) 3 lần và đếm mật độ vi khuẩn bằng máy so màu quang phổ ở bước sóng 610nm (OD=1±0,1≈109 CFU/ml) sau đó dung dịch vi khuẩn được pha loãng 10 lần để được các mật độ cần thí nghiệm là 103, 104, 105,
106. Mật độ vi khuẩn cũng được xác định bằng cách nhỏ 20 µl (lặp lại 6 lần) dung
dịch vi khuẩn đã điều chỉnh mật độ lên đĩa TSA và ủ 28-30 0C rồi đếm số khuẩn lạc trung bình sau 24-48 giờ.
Bố trí thí nghiệm
Thí nghiệm được bố trí hoàn toàn ngẫu nhiên với 5 nghiệm thức ở nồng độ 103, 104, 105, 106 và nghiệm thức đối chứng không tiêm vi khuẩn, mỗi nghiệm thức lặp lại 3 lần với mật độ 10 con cá/bể. Cá được tiêm (0,1ml vi khuẩn/cá) tại gốc vi ngực. Mật độ vi khuẩn E. ictaluri tiêm cho thí nghiệm là: 2,8x103, 5,4x104, 5x105, 0,8x106. Sau khi tiêm, các biểu hiện của cá được theo dòi và ghi nhận số cá chết liên tục trong 14 ngày. LD50 được xác định theo phương pháp của Reed và Muench (1938).
LD50= mức gây tỷ lệ nhiễm bệnh trên cá 50% thấp nhất- số nội suy (p.d) p.d = (L%-50)(L%-H%)
Trong đó:
L%: tỷ lệ cá nhiễm bệnh thấp nhất trên 50% H%: tỷ lệ cá nhiễm bệnh cao nhất dưới 50%
3.3.3 Thí nghiệm cho ăn thảo dược.
Thí nghiệm được bố trí hoàn toàn ngẫu nhiên với 6 nghiệm thức và 3 lần lặp lại được thực hiện trong 5 tuần. Trong đó nghiệm thức 1 (NT1) cho ăn thức ăn (TĂ) không bổ sung hoàng kỳ (HK), nghiệm thức 2 (NT2) cho ăn thức ăn có bổ sung hoàng kỳ, nghiệm thức 3 (NT3) cho ăn thức ăn không bổ sung hoàng kỳ nhưng
được tiêm vắc-xin ở tuần thứ 3, nghiệm thức 4 (NT4) cho ăn thức ăn có bổ sung hoàng kỳ và tiêm vắc-xin ở tuần thứ 3, nghiệm thức 5 (NT5) cho ăn thức ăn không bổ sung, nghiệm thức 6 (NT6) cho ăn thức ăn có bổ sung hoàng kỳ.
3.3.4 Thí nghiệm gây cảm nhiễm sau khi cho ăn thảo dược 5 tuần.
Sau 5 tuần cho ăn thảo dược tiến hành gây cảm nhiễm vi khuẩn E. ictaluri cho cá ở
các nghiệm thức 2, 3, 4 và 5, riêng nghiệm thức 6 thì tiêm NaCl.
Vắc-xin được điều chế từ chủng E. ictaluri độc lực cao bằng cách làm vở tế bào vi khuẩn bằng formaline 4% trong 24 giờ. Vắc-xin được tiêm với liều lượng 0,1ml/con, nồng độ 105.17 cfu/ml. Thời gian hiệu ứng của Vắc-xin là 3 tuần. Sau đó gây cảm nhiễm cho cá bằng các chủng vi khuẩn E. ictaluri có khả năng gây bệnh thông qua kết quả thí nghiệm LD50. Sau khi tiêm các chủng vi khuẩn trên vào các bể thí nghiệm trừ bể đối chứng tiêm nước muối sinh lý thì theo dòi liên tục trong 1 tuần. Để đánh giá chính xác khả năng bảo hộ của vắc-xin, trước khi thí nghiệm kết thúc thì tiến hành tái phân lập các cá còn sống nhằm xác định sự tấn công của các chủng vi khuẩn đã công cường độc (Đặng Thị Hoàng Oanh và ctv., 2002). Các chỉ
tiêu ghi nhận bao gồm: (1) dấu hiệu bệnh mủ gan của cá; (2) số cá chết và thời gian chết.
3.3.3 Xác định hiệu quả của chiết xuất thảo dược lên sự đề kháng bệnh mủ gan trên cá tra qua các chỉ tiêu.
Cá từ các nghiệm thức thí nghiệm được thu và lấy máu để nghiên cứu các chỉ tiêu
đánh giá khả năng miễn dịch của cá.
3.3.3.1 Xác định các chỉ tiêu huyết học
Phương pháp đếm hồng cầu
Số lượng hồng cầu được xác định lượng theo phưong pháp của Supranee et al. (1991)
Cho 10 µl máu vào ống nhựa có chứa 1990 µl dung dịch Natt&Herrick. Lắc nhẹ, đều, nhanh ống nghiệm để tránh máu bị đông. Mật độ hồng cầu sẽ được xác định bằng buồng đếm hồng cầu thông qua sự quan sát dưới kính hiển vi quang học (40X). Đầu tiên xem ở vật kính 10X, định vị vùng đếm, đưa vào giữa thị trường, chuyển sang vật kính 40X. Đếm lặp lại 2 lần.
Phương pháp nhuộm mẫu máu
Dùng ống tiêm 1ml lấy máu ở mạch máu phần đuôi cá. Cho 1 giọt máu lên lame và trãi điều mẫu, để khô tự nhiên trong không khí. Cố định mẫu bằng methanol. Tiến
hành nhuộm mẫu theo phương pháp của Humason (1979) trích dẫn bởi Rowley (1993). Cho lame mẫu vào dung dịch Wright trong 3-5 phút. Chuyển mẫu sang dung dịch pH 6.2-6.8 từ 5-6 phút. Sau đó cho vào dung dịch Giemsa trong 20-30 phút. Tiếp tục cho mẫu vào dung dịch pH 6.2 trong 15-30 phút. Rửa sạch lại bằng nước cất, để khô tự nhiên và đọc kết quả dưới kính hiển vi.
Định lượng và định loại các tế bào bạch cầu (Hrubec et al, 2000)
Quan sát lame mẫu dưới kính hiển vi ở vật kính 100x có giọt dầu.Sau khi nhuộm bạch cầu ta tiến hành đếm. trên mỗi lam đếm 1500 tế bào theo hình zichzac.
Tổng tế bào bạch cầu (TBC) được xác định bằng cách đếm tổng số 1500 tế bào hồng cầu và bạch cầu trên lame mẫu.
(Số bạch cầu x mật độ tế bào hồng cầu)
TBC (tb/mm3) =
Số hồng cầu trên lame mẫu
Đếm 200 tế bào bạch cầu nhằm xác định mật độ từng loại bạch cầu.
Số lượng mỗi loại bạch cầu x TBC
Mật độ từng loại bạch cầu (tb/mm3) =
200
3.3.3.2 Phương pháp xác định hàm lượng lysozyme trong huyết thanh
Hàm lượng lysozyme trong huyết thanh được xác định theo phương pháp của Ellis (1990) trích dẫn bởi Doan Nhat Phuong (2007) như sau:
- Dung dịch Micrococcus lysodeikticus được chuẩn bị bằng cách cho 75 mg vi khuẩn Micrococcus lysodeikticus (R3770, sigma) vào 100ml phosphate buffer saline (PBS).
- Các nồng độ lysozyme chuẩn được chuẩn bị bằng cách cho 20 mg lysozyme vào 10 ml phosphate buffer saline (PBS) để được dung dịch lysozyme có nồng độ 20 µg/ml. Sau đó lấy 0,5 ml dung dịch lysozyme nồng độ 20 µ g/ml vào 0,5 ml PBS thì được dung dịch lysozyme nồng độ 10 µg/ml . Tiếp theo lấy 0,5 ml dung dịch lysozyme nồng độ 10 µg/ml vào 0,5 ml PBS thì được dung dịch lysozyme nồng độ 5 µg/ml. Kế đến lấy 0,5 ml dung dịch lysozyme nồng độ 5 µg/ml vào 0,5 ml PBS được dung dịch lysozyme nồng độ 2,5µg/ml. Tiếp tục lấy 100µl dung dịch lysozyme nồng độ 10µg/ml vào 0.9ml PBS được dung dịch lysozyme nồng độ 1µg/ml. Tiếp tục lấy 0,5ml dung dịch lysozyme nồng độ 1µg/ml vào 0,5ml PBS
được dung dịch lysozyme nồng độ 0,5µg/ml. Từ đó xây dựng đường cong chuẩn về các nồng độ khác nhau của lysozyme.
Các phân tích được tiến hành trên đĩa 96 giếng với ba lần lặp lại. Cho 20 µl dung dịch lysozyme chuẩn ở mỗi nồng độ, 20 µl dung dịch huyết thanh cá và 20 µl dung dịch PBS (mẫu trắng) cho vào 3 giếng khác nhau và lập lại 3 lần. Sau đó tiếp tục cho 250 µl dung dịch PBS (mẫu trắng) vào 3 giếng đầu và 250 µl dung dịch Micrococcus lysodeikticus vào 3 giếng còn lại. Sau khi cho mẫu vào đĩa 96 giếng thì lắc đều, đọc nhanh ở bước sóng 530 nm bằng máy microplate reader. Sau khi đo xong để 5 phút, lắc đều lại và đo lập lại 1 lần nữa. Hoạt tính của của lysozyme trong mẫu huyết thanh được xác định từ đường cong chuẩn trên.
3.3.3.3 Xác định khả năng diệt khuẩn của huyết thanh
Khả năng diệt khuẩn của huyết thanh được xác định theo phương pháp của Secombes (1990).
Phương pháp: Sau khi đĩa vi khuẩn đã được thuần, chọn 1 khuẩn lạc nuôi tăng sinh trong môi trường NB trong 48h ở 280C. Tiến hành pha loãng vi khuẩn đến mật độ 104 cfu/ml. Sau đó pha loãng huyết thanh 10 lần trong nước muối sinh lý. Lần lược cho 100 µl dung dịch NB vào tất cả các giếng, tiếp theo cho 100 µl dung dịch huyết thanh vào các giếng trừ giếng control và blank thì cho NB (TSB), tiếp tục cho 30 µl vi khuẩn vào các giếng trừ giếng blank thì cho NB (TSB) và ủ qua đêm ở 280C. Sau đó cho 10 µl MTT (5 mg/ml nước cất) vào các giếng, lắc trong 15 giây thì đo ở bước sóng 600 nm.
Đọc kết quả: Phần trăm vi khuẩn sống sót được tính bằng công thức sau PSA = ((ODSample - ODblank)/(ODcontrol - ODblank))x100
OD là kết quả đọc ở bước sóng 600 nm.
3.4 Quản lý hệ thống thí nghiệm
- Thí nghiệm được bố trí trong xô nhựa 250 lít, mỗi xô nhựa thả 30 con. Hàng ngày kiểm tra hệ thống, ghi nhận dấu hiệu bệnh lý, số cá chết.
- Thức ăn sử dụng cho cá là thức ăn công nghiệp chứa 28% đạm chuyên dùng cho cá Tra giống của công ty Proconco Cần Thơ .
- Cá được cho ăn theo nhu cầu (khoảng 3 lần/ngày) bằng thức ăn dạng viên với chế độ dinh dưỡng có chứa Hoàng kỳ (0,5%) trong 5 tuần. Đối với cá đối chứng
âm (NT1) và đối chứng dương (NT5) thì cho ăn chế độ dinh dưỡng cơ bản mà không cần bổ sung thảo dược.
- Cách phối trộn: Hòa tan Hoàng Kỳ vào nước rồi phun đều vào thức ăn, đợi cho viên thức ăn hơi khô thì dùng dầu gan mực áo bên ngoài rồi cho cá ăn.
- Mẫu máu (3 con/nghiệm thức) được lấy ở động mạch chủ ở cột sống đuôi (Houston, 1990) sau 1, 2, 3, 4 và 5 tuần sau khi cho ăn. Dùng chất chống đông máu Heparin.
- Mỗi con cá được lấy máu 1 lần để tránh ảnh hưởng đến kết quả xét nghiệm do chảy nhiều máu và ảnh hưởng bởi stress.
3.5 Phương pháp xử lý số liệu
Kết quả được trình bày như sau: trung bình của 5 con cá (± sai số tiêu chuẩn), và được so sánh ở mỗi thời điểm bằng cách sử dụng bảng ANOVA một chiều và kiểm định Duncan của nhiều chiều (SPSS 13). Có sự khác biệt về mặt thống kê giữa các thí nghiệm ở mức ý nghĩa 95%. Tỷ lệ chết (thu được ở phần cuối của thí nghiệm) trong mỗi nhóm điều trị đã được thống kê so với nhóm kiểm soát bằng cách sử dụng kiểm định Chi-square (SPSS 13). Sự khác biệt giữa nhóm kiểm soát và nhóm điều trị ở một mức độ đáng kể P <0,001 và P <0,05.
CHƯƠNG 4
KẾT QUẢ VÀ THẢO LUẬN
4.1 Ảnh hưởng của chiết xuất từ cây Hoàng Kỳ lên các chỉ tiêu huyết học của cá tra.
4.1.1 Hồng cầu
![]()
![]()
![]()
![]()
![]()
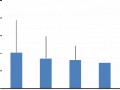
Kết quả (Hình 4.1) cho thấy sau 5 tuần thí nghiệm số lượng hồng cầu trung bình giữa các nghiệm thức dao động từ 1,40 x 106 tế bào/ml đến 2,02 x 106 tế bào/ml và khác biệt có ý nghĩa thống kê (P< 0,05) giữa các nghiệm thức thí nghiệm.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Hình 4.1 Biểu đồ so sánh số lượng hồng cầu của các nghiệm thức thí nghiệm sau 5 tuần. NT1: Cho ăn thức ăn không bổ sung hoàng kỳ. NT2: Cho ăn thức ăn có bổ sung hoàng kỳ. NT3: Cho ăn thức ăn không bổ sung hoàng kỳ và tiêm vắc-xin ở tuần thứ 3. NT4: Cho ăn thức ăn có bổ sung hoàng kỳ và tiêm vắc-xin ở tuần thứ 3. (*) Thể hiện sự khác biệt có ý nghĩa thống kê (p<0,05)
Kết quả phân tích cho thấy sau hai tuần đầu của thí nghiệm số lượng hồng cầu của cá ở NT2 và NT4 cao hơn ý nghĩa thống kê (p<0,05) so với NT1 và NT3. Kết quả này tương tự với nghiên cứu của Trần Thị Yến Nhi và Đặng Thị Hoàng Oanh (2010) khi so sánh số lượng hồng cầu giữa cá tra cho ăn thức ăn có bổ sung hoàng
kỳ và cá cho ăn thức ăn không bổ sung hoàng kỳ cho thấy số lượng hồng cầu ở cá có bổ sung hoàng kỳ cao hơn cá không bổ sung hoàng kỳ và khác biệt có ý nghĩa thống kê (p<0,05).
Sau khi tiêm vắc-xin cho NT3 và NT4 ở tuần thứ 3 thì số lượng hồng cầu của cá ở các nghiệm thức này đều tăng cao hơn có ý nghĩa thống kê so với tuần 1 và 2. Sau 5 tuần cho ăn thì số lựơng hồng cầu ở NT4 là cao nhất, kế đến là NT2, NT3 và thấp nhất là NT1. Sự khác biệt giữa NT2 và NT1 là có ý nghĩa thống kê, tuy nhiên giữa NT2 và NT3 là khác biệt không có ý nghĩa thống kê (p>0,05). Còn sự khác biệt giữa NT4 đối với NT2 và NT3 là có ý nghĩa thống kê (p<0,05). Điều này cho thấy khi bổ sung hoàng kỳ vào khẩu phần thức ăn đã làm tăng số lượng hồng cầu, giúp vận chuyển và phân phối oxy đến các mô tốt hơn. Tóm lại số lượng hồng cầu tăng đều qua các tuần và khác biệt có ý nghĩa thống kê giữa nghiệm thức có bổ sung hoàng kỳ và không bổ sung hoàng kỳ.
Theo Jeney et al. (2002) khi bổ sung vitamin U với hàm lượng 100 ppm vào thức ăn cho cá tầm lai trong 4 tuần làm gia tăng hoạt động thực bào và gia tăng tuần hoàn của bạch cầu so với nhóm cá không bổ sung vitamin U, tuy nhiên khi bổ sung vitamin C vào thức ăn cho cá tầm lai thì số lượng hồng cầu và bạch cầu lại thấp hơn nhóm đối chứng và khác biệt có ý nghĩa thống kê.
Theo nghiên cứu của Yin et al. (2008) khi nuôi cá chép kết hợp tiêm vắc-xin và cho ăn hoàng kỳ và nấm linh chi (Astragalus và Ganoderma) làm kích thích hoạt động hô hấp, sự thực bào của bạch cầu trong máu. Ngoài ra trên cá Rô phi (Oreochromis niloticus) khi cho ăn hai loại thảo dược là Hoàng kỳ (Astragalus membranaceus) và Kim ngân (Lonicera japonica) với hàm lượng 0,1% trong 4 tuần. Kết quả cho thấy hệ miễn dịch của cá được tăng cường. Hoạt động của đại thực bào, hô hấp của tế bào máu được tăng cường và tỷ lệ sống tăng lên (Ardó et al., 2008).
Qua đó cho thấy mặc dù loài cá có khác nhau nhưng khi bổ sung hoàng kỳ vào khẩu phần thức ăn đều làm tăng cường hoạt động của các tế bào máu dẫn đến số lượng hồng cầu tăng và khác biệt có ý nghĩa giữa các nghiệm thức (p<0,05).
4.1.2 Bạch cầu
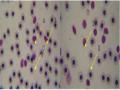
Kết quả định lượng và định loại bạch cầu cho thấy có 4 loại bạch cầu gồm: Tế bào lympho, bạch cầu đơn nhân, bạch cầu trung tính và tiểu cầu (Hình 4.2). Số lượng tổng bạch cầu, tế bào lympho, bạch cầu đơn nhân, bạch cầu trung tính và tiểu cầu