Điều trị đích có thể được chỉ định ở giai đoạn IIIB và giai đoạn có di căn xa (IV), tái phát. Lựa chọn thuốc điều trị phụ thuộc vào thể mô bệnh học, các đặc tính phân tử (có đột biến gen hay không), thể trạng chung của người bệnh.
- Đột biến gen EGFR dương tính có thể chỉ định các thuốc như Gefitinib (Iressa), Erlotinib (Tarceva) thuộc nhóm TKI thế hệ 1, Efatinib (Giotrif) TKI thế hệ 2 hoặc Osimertinib thuộc nhóm TKI thế hệ 3 [11].
- Đột biến gen ALK (Anaplastic Lymphoma Kinase) dương tính sử dụng Crizotinib. Sau khi thất bại với Crizotinib có thể lựa chọn Alectinib, Ceritinib, Brigatinib.
- Đột biến gen BRAF V600E dương tính có thể chỉ định Dabrafenib, Trametinib.
- Kháng thể đơn dòng kháng thụ thể yếu tố tăng sinh mạch VEGF (vascular endothelial growth factor receptor): Bevacizumab, Ramucirumab [8].
1.1.4.5. Điều trị miễn dịch
Theo hướng dẫn của NCCN (National Comprehensive Cancer Network) năm 2018 với những bệnh nhân UTPKTBN giai đoạn di căn xa có PD-L1 (Programmed death -ligand 1) dương tính ≥ 50% có thể điều trị bước một bằng các thuốc ức chế miễn dịch hoặc điều trị bước hai nếu PDL-1 dương tính ≥1%. Nivolumab và Pembrolizumab có tác dụng ức chế thụ thể PD-1. Atezolizumab và Durvalumab có khả năng ức chế PD-L1. Pembrolizumab, Nivolumab và Atezolizumab được khuyến cáo điều trị cho những bệnh nhân UTPKTBN giai đoạn di căn xa. Những bệnh nhân UTPKTBN giai đoạn III sau điều trị hoạt chất có thể được điều trị củng cố bằng Durvalumab [22].
1.2. THỤ THỂ YẾU TỐ TĂNG TRƯỞNG BIỂU BÌ
Thụ thể yếu tố tăng trưởng biểu bì (Epidermal Growth Factor Receptor – EGFR) là một nhóm protein thụ thể trên màng các tế bào biểu mô, trung mô và thần kinh có vai trò trong điều hòa các quá trình sinh trưởng, phát triển, trao đổi chất và sinh lý của tế bào [6].
1.2.1. Cấu trúc EGFR
Có thể bạn quan tâm!
-
 Nhận xét tình trạng đột biến gen EGFR trên bệnh nhân ung thư phổi loại biểu mô vảy tại Bệnh viện Bạch Mai - 1
Nhận xét tình trạng đột biến gen EGFR trên bệnh nhân ung thư phổi loại biểu mô vảy tại Bệnh viện Bạch Mai - 1 -
 Nhận xét tình trạng đột biến gen EGFR trên bệnh nhân ung thư phổi loại biểu mô vảy tại Bệnh viện Bạch Mai - 2
Nhận xét tình trạng đột biến gen EGFR trên bệnh nhân ung thư phổi loại biểu mô vảy tại Bệnh viện Bạch Mai - 2 -
 Đặc Điểm Lâm Sàng Và Cận Lâm Sàng Của Bệnh Nhân Utpbmv
Đặc Điểm Lâm Sàng Và Cận Lâm Sàng Của Bệnh Nhân Utpbmv -
 Đặc Điểm Vị Trí Và Phương Pháp Lấy Mẫu Bệnh Phẩm
Đặc Điểm Vị Trí Và Phương Pháp Lấy Mẫu Bệnh Phẩm -
 Mối Liên Quan Giữa Đột Biến Gen Egfr Với Vị Trí U
Mối Liên Quan Giữa Đột Biến Gen Egfr Với Vị Trí U
Xem toàn bộ 67 trang tài liệu này.
Protein EGFR gồm 1210 axit amin, cấu tạo gồm 3 vùng:
+ Vùng ngoại bào: nơi để gắn kết các yếu tố tăng trưởng
+ Vùng xuyên màng: tập trung tại vùng phân cực phospholipid màng tế bào
+ Vùng nội bào: chứa miền tyrosine kinase, đây là nơi xảy ra phản ứng tự phosphoryl hóa của EGFR.
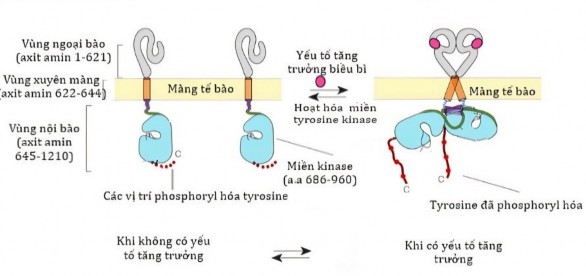
Hình 1.2 Mô hình cấu trúc và hoạt động của EGFR
EGFR gồm ba vùng: vùng ngoại bào, vùng xuyên màng, vùng nội bào chứa miền tyrosin kinase. Hoạt động của EGFR: khi có yếu tố tăng trưởng liên kết vào phần ngoại bào của thụ thể EGFR, hai phân tử EGFR kết hợp với nhau, tự phosphoryl hóa, vùng tyrosin kinase được hoạt hóa sẽ kết hợp với các phân tử tín hiệu ở giai đoạn sau của con đường tín hiệu [20].
1.2.2. Hoạt động và chức năng EGFR
Quá trình hoạt hoá các tín hiệu nội bào phụ thuộc EGFR có thể chia thành 3 bước:
Thứ nhất, các phối tử đặc hiệu với thụ thể như: yếu tố tăng trưởng (EGF), TGFα, HB- EGF, NRGs, … sẽ gắn với vùng ngoại bào của EGFR hoặc một trong số các receptor liên quan đến EGFR (thuộc họ thụ thể ErbB như HER2, HER3, or HER4).
Thứ hai, sự hình thành của một dimer hoạt hóa chức năng khi hai phân tử EGFR kết hợp với nhau (2 phân tử giống nhau) hoặc một dimer EGFR-HER2, EGFR-HER3, hay EGFR-HER4 (2 phân tử khác nhau) gây ra sự phosphoryl hóa phụ thuộc ATP của vùng tyrosine kinase nằm ở vùng nội bảo của EGFR.
Thứ ba, sự phosphoryl hóa này sẽ kích hoạt một phức hợp các tín hiệu nội bào tới bào tương và sau đó tới nhân. Hai con đường nội bào chính được kích hoạt bởi EGFR là con đường RAS–RAF–MEK–MAPK có vai trò kiểm soát phiên mã gen, diễn tiến của chu trình tế bào từ pha G1 dến pha S, và sự tăng sinh tế bào. Con đường thứ 2 là PI3K–Akt, có vai trò kích hoạt chuỗi tín hiệu tránh sự tự chết theo chương trình, kích thích tăng sinh mạch máu, di căn, … [20].
Trong các tế bào bình thường, con đường tín hiệu nội bào trên được kiểm soát một cách chặt chẽ, đảm bảo sự phát triển bình thường của tế bào.
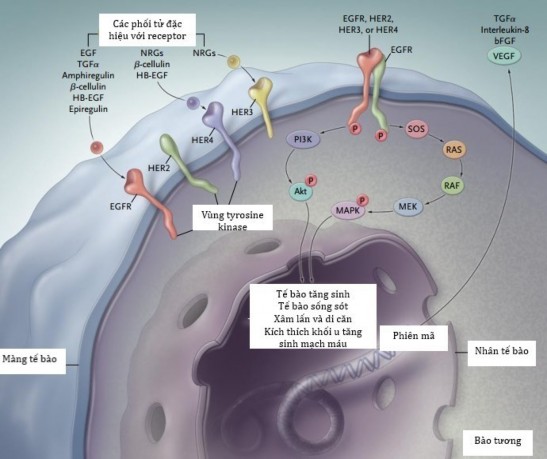
Hình 1.3. Các con đường truyền tín hiệu nội bào khởi nguồn từ EGFR
EGFR tiếp nhận tín hiệu từ yếu tố tăng trưởng, truyền qua các con đường
PI3K/Akt, Ras/Raf/MEK/ERK… vào nhân tế bào, kích thích tế bào biệt hóa, tăng sinh, sống sót, tạo u, sinh mạch. bFGF denotes basic fibroblast growth factor, HB- EGF: heparin-binding EGF, MAPK mitogen-activated protein kinase, P phosphate, PI3K: phosphatidylinositol 3,4,5-kinase; TGFα transforming growth factor α, and VEGF vascular endothelial growth factor. [20]
1.2.3. Đột biến gen EGFR
1.2.3.1. Các dạng đột biến
Gen mã hóa protein EGFR nằm trên cánh ngắn nhiễm sắc thể số 7, tại locus 7p12, được xếp vào nhóm gen tiền sinh khối u (proto-oncogen), dài 110kb và được chia thành 28 exon [2].
Đột biến gen EGFR xảy ra ở giai đoạn rất sớm và có tỷ lệ khá cao trong ung thư phổi không tế bào nhỏ. Tỷ lệ đột biến gen EGFR ở bệnh nhân ung thư phổi biểu mô tuyến châu Á là 51,4%, hay gặp hơn ở bệnh nhân không hút thuốc lá (60,7%) [46]. Tỷ lệ đột biến gen EGFR ở bệnh nhân ung thư phổi biểu mô vảy từ 5,9-7,4% [26,52]. Đột biến thay đổi vùng tyrosine kinase của EGFR khiến cho vùng này luôn được hoạt hóa không phụ thuộc vào sự có mặt của yếu tố tăng trưởng, do đó các con đường tín hiệu phụ thuộc EGFR sẽ luôn được kích hoạt. Những đột biến này được chia làm ba nhóm (Đột biến mất, đột biến thêm, và đột biến sai nghĩa), tất cả đều nằm ở các vị trí quanh khe gắn ATP, bao gồm P-loop, αC-helix và C-loop.
Đột biến gen mã hóa vùng tyrosine kinase của EGFR chủ yếu xảy ra ở bốn exon từ 18 đến 21. Khoảng 90% các đột biến EGFR hoặc là các mất đoạn nhỏ mã hóa cho năm amino acid từ codon 746 đến 750 (ELREA) hoặc là các đột biến sai nghĩa, thay thế leucine thành arginine ở codon 858 (L858R). Có hơn 20 loại đột biến mất, ví dụ, mất đoạn lớn hơn, mất kèm theo đột biến điểm, mất kèm thêm đoạn, …. Khoảng 2% các đột biến xảy ra ở codon 719 dẫn đến sự thay thế glycine thành cysteine, alanine hoặc serine (G719X gồm G719A, G719C, G719S). Cũng
có khoảng 3% đột biến thêm đoạn tại exon 20. Bốn loại đột biến này hiếm khi xảy ra cùng lúc. Có nhiều loại đột biến điểm hiếm, một số đột biến đó xảy ra cùng L858R [38].
1.2.3.2. Hiệu quả điều trị của các chất ức chế tyrosine kinase của EGFR Các kháng thể đơn dòng kháng EGFR
Các kháng thể đơn dòng có vai trò ngăn chặn sự gắn kết của các phối tử nội sinh với phần ngoại bào của EGFR gồm có cetuximab và pantuximab. Cetuximab chủ yếu được sử dụng đơn trị liệu hoặc kết hợp trong ung thư đại trực tràng và ung thư biểu mô vảy đầu cổ di căn, có biểu lộ EGFR. Trong bệnh UTPKTBN, cetuximab kết hợp với hóa trị truyền thống đã cho thấy lợi ích trên các bệnh nhân có đột biến EGFR. Nghiên cứu pha III FLEX đã kết luận điều trị bước 1 bộ đôi cetuximab và hóa chất truyền thống giúp cải thiện thời gian sống cho những bệnh nhân có mức biểu lộ EGFR cao (chẩn đoán bằng kỹ thuật hóa mô miễn dịch), đặc biệt là những bệnh nhân ung thư biểu mô tuyến.
Các chất EGFR TKIs dạng phân tử nhỏ
TKIs dạng phân tử nhỏ là các phân tử tổng hợp có trọng lượng phân tử thấp, có nguồn gốc từ nhóm quinazoline, có vai trò ngăn chặn vị trí gắn kết magnesium- ATP của vùng tyrosine kinase nội bào (làm giảm ái lực của EGFR và phối tử), từ đó ngăn chặn sự tự phosphoryl hóa của EGFR và các con đường tín hiệu xuôi dòng. Nhóm gefitinib và erlotinib cạnh tranh với ATP để gắn với vùng xúc tác nội bào của EGFR tyrosine kinase, do đó ức chế sự tự phosphoryl hóa của EGFR và các tín hiệu nội bào, đặc hiệu cho chỉ EGFR. Thêm vào đó, các thuốc phân tử nhỏ như lapatinib, vandetanib và AEE788 có thể ngăn chặn sự hoạt hóa của các thụ thể yếu tố tăng trưởng khác nhau, bao gồm các thành viên khác của họ EGFR như VEGFR2 [20].
1.2.3.2. Phương pháp phát hiện đột biến EGFR
Xét nghiệm đột biến gen EGFR có thể được phát hiện bằng nhiều phương pháp khác nhau như giải trình tự gen, real-time PCR, lai đầu dò phân tử, …
Giải trình tự gen
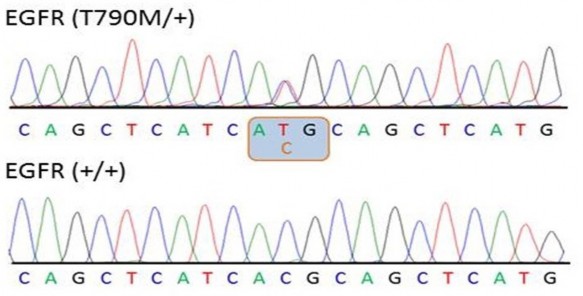
Hình 1.4. Kết quả giải trình tự gen xác định đột biến EGFR T790M
Ở mẫu bình thường (hình dưới), codon 790 của gen EGFR là ACG mã hóa threonine. Trong mẫu phân tích (hình trên), tín hiệu huỳnh quang ghi nhận cả bộ ba ACG (bình thường) và ATG (đột biến, mã hóa methionine), cho thấy có các tế bào mang đột biến T790M xen lẫn các tế bào không đột biến.
Nguyên lý của phương pháp này như sau: Dideoxynucleotid (ddNTP) là một phân tử nhân tạo, cấu trúc của nó tương tự như phân tử deoxynucleotid (dNTP), tuy nhiên ở carbon số 3 của đường deoxyribose không phải là nhóm hydroxyl (– OH) mà là –H. Đoạn DNA cần được giải trình tự được sử dụng như trình tự mẫu cho phản ứng giải trình tự bắt đầu từ vị trí gắn mồi. Hỗn hợp của dNTP và ddNTP được sử dụng trong phản ứng với nồng độ sao cho các ddNTP sẽ gắn vào mỗi vị trí mà các dNTP thường gắn trên đoạn DNA đang được tổng hợp, khi ddNTP được gắn vào đầu 3’ của chuỗi đang tổng hợp thì sự tổng hợp DNA sẽ dừng lại do không hình thành được liên kết phosphodieste với nucleotid tiếp theo, kết quả sẽ tạo ra hỗn hợp các sợi DNA có kích thước khác nhau. Nucleotid tận cùng trên mỗi sợi DNA được xác định bằng cách chạy một phản ứng hỗn hợp nhưng từng loại ddNTP được đánh dấu bằng các chất phát huỳnh
quang đặc hiệu khác nhau. Sản phẩm sau phản ứng giải trình tự sẽ được đọc trình tự bằng máy giải trình tự tự động sử dụng bản gel polyacrylamide. Sau đó, trình tự gen của mẫu nghiên cứu sẽ được đối chiếu với trình tự gen tham chiếu trên ngân hàng gen thế giới (GenBank) và được phân tích để xác định vùng hoặc điểm đột biến.
Realtime PCR
Trong phản ứng khuếch đại DNA (polymerase chain reaction – PCR) thông thường, kết quả của phản ứng PCR cần được kiểm tra bằng kỹ thuật điện di, thực hiện sau khi phản ứng kết thúc. Realtime PCR (Real time PCR) là kỹ thuật PCR mà kết quả khuếch đại DNA đích được hiển thị ngay sau mỗi chu kỳ của phản ứng (vì vậy mà được gọi là PCR thời gian thực). Hai phương pháp phổ biến để xác định được sản phẩm trong PCR định lượng đó là: (1) các dye phát huỳnh quang không đặc hiệu gắn vào bất kỳ đoạn DNA mạch đôi nào đó, và (2) các đầu dò DNA đặc hiệu có chứa các đoạn oligonucleotide đã được đánh dấu với chất phát huỳnh quang, từ đó cho phép phát hiện chỉ khi có sự lai giữa đầu dò với một trình tự bổ sung với nó. Các đường biểu thị cường độ huỳnh quang thu được qua các chu kỳ phản ứng Real–Time PCR (từ đó gián tiếp suy ra tương đối số bản sao sản phẩm PCR trong mẫu xét nghiệm).
Lai đầu dò phân tử
Đây là phương pháp dựa trên nguyên lý lai nucleic acid, dựa trên đặc tính biến tính và hoàn nguyên của acid nucleic. Sản phẩm PCR sau khuếch đại được lai ngược với đầu dò DNA (là những đoạn DNA kích thước ngắn, khoảng 50-100 nucleotide, có trình tự bổ sung với DNA đích), các đầu dò này được bố trí trên 1 thanh test strip (thành các điểm hoặc các băng). Các mồi dùng cho phản ứng PCR thường được gắn phân tử biotin, phân tử này sẽ được hoạt hóa bởi streptavidin thành dạng phát màu, do đó dựa vào vị trí phát màu trên thanh test strip, người ta có thể nhận định kết quả phát hiện đột biến gen.
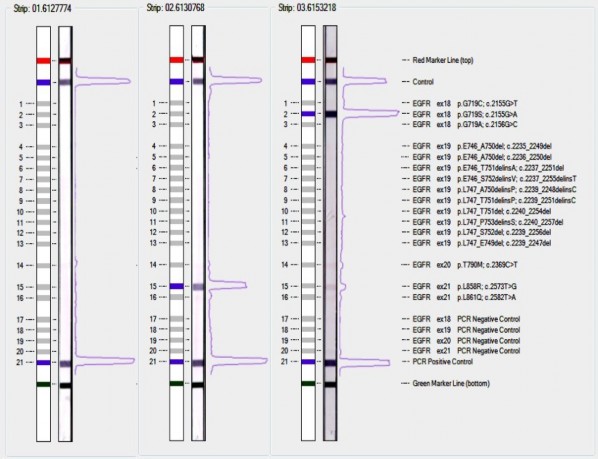
Hình 1.5. Phân tích kết quả trên thanh teststrip.
Trên mỗi thanh teststrip có sẵn vạch control cho phản ứng lai, PCR negative control cho từng exon (vạch 17 - 20) và PCR positive control (vạch 21) làm đối chứng. Các vạch 1 - 16 tương ứng với 16 đột biến trên 4 exon 18 - 21. Mẫu 01.6127774 (trái) không phát hiện đột biến, mẫu 02.6130768 (giữa) phát hiện đột biến L858R trên exon 21, mẫu 03.6153218 (phải) phát hiện đột biến G719S trên exon 18.
1.2.3.3. Tình hình nghiên cứu đột biến EGFR ở bệnh nhân UTPBMV Trên thế giới
Nhiều nghiên cứu quy mô nhỏ đã được tiến hành để xác định tình trạng đột biến gen EGFR ở bệnh nhân UTPBMV. Chủ yếu ở vùng Đông Á, cho thấy tỉ lệ đột biến dao động từ 2%-10%, một số các nghiên cứu trong đó bao gồm cả ung