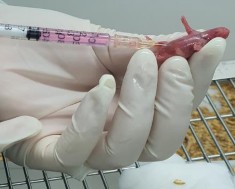
Chuột sau tiêm não 21 ngày Chuột sau tiêm phúc mạc 21 ngày

Chuột chứng (không tiêm)
|
Có thể bạn quan tâm!
-
 So Sánh Trình Tự Nucleotide Của 03 Chủng (Chủng Giống Gốc Bv-Msv-021, Bv-Wsv- 031 Và Chủng Tham Chiếu Beijing-Kanonji)
So Sánh Trình Tự Nucleotide Của 03 Chủng (Chủng Giống Gốc Bv-Msv-021, Bv-Wsv- 031 Và Chủng Tham Chiếu Beijing-Kanonji) -
 Kết Quả Giải Trình Tự Acid Amin Protein E Chủng Giống Gốc Bv-Msv-0210 Và Chủng Giống Sản Xuất Bv-Wsv-0310
Kết Quả Giải Trình Tự Acid Amin Protein E Chủng Giống Gốc Bv-Msv-0210 Và Chủng Giống Sản Xuất Bv-Wsv-0310 -
 Viện Công Nghệ Sinh Học (Ibt), Viện Hàn Lâm Kh&cn Việt Nam (Vast)
Viện Công Nghệ Sinh Học (Ibt), Viện Hàn Lâm Kh&cn Việt Nam (Vast) -
 Kiểm Tra Virus Ngoại Lai Trong Ngân Hàng Tế Bào (Mcb, Wcb)
Kiểm Tra Virus Ngoại Lai Trong Ngân Hàng Tế Bào (Mcb, Wcb) -
 Nghiên cứu xây dựng tiêu chuẩn chất lượng vi rút Beijing-1 để ứng dụng sản xuất vắc xin viêm não Nhật Bản bất hoạt trên tế bào Vero tại Việt Nam - 21
Nghiên cứu xây dựng tiêu chuẩn chất lượng vi rút Beijing-1 để ứng dụng sản xuất vắc xin viêm não Nhật Bản bất hoạt trên tế bào Vero tại Việt Nam - 21 -
 Nghiên cứu xây dựng tiêu chuẩn chất lượng vi rút Beijing-1 để ứng dụng sản xuất vắc xin viêm não Nhật Bản bất hoạt trên tế bào Vero tại Việt Nam - 22
Nghiên cứu xây dựng tiêu chuẩn chất lượng vi rút Beijing-1 để ứng dụng sản xuất vắc xin viêm não Nhật Bản bất hoạt trên tế bào Vero tại Việt Nam - 22
Xem toàn bộ 178 trang tài liệu này.
| |
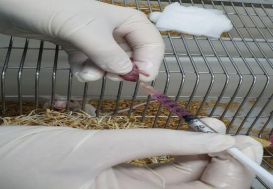
Tiêm phúc mạc chuột ổ 1-3 ngày tuổi | Tiêm não chuột ổ 1-3 ngày tuổi |
|
|
Chuột ổ sau tiêm phúc mạc 14 ngày | Chuột ổ sau tiêm não 14 ngày |
Chuột chứng sau theo dõi 14 ngày | |
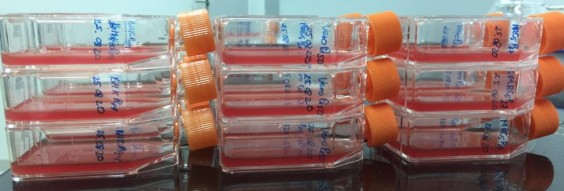
Hình ảnh chai tế bào trước gây nhiễm trên 3 dòng thế bào |
|
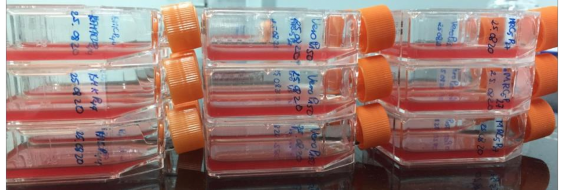
Hình ảnh chai tế bào sau gây nhiễm 3ml/chaihỗn dịch trung hòa (vi rút thử thách (CV) với kháng huyết thanh đặc hiệu): Hàng 1 là kiểm tra vi rút ngoại lai cho chủng MSV-0210; Hàng thứ 2 là là kiểm tra vi rút ngoại lai cho tế bào đối chứng; Hàng 3 là kiểm tra vi rút ngoại lai cho chủng MWS-0310. |
10-6 10-7 10-8 | |
Hình ảnh plaque (đám hoại tử- đốm trắng) của chủng sản xuất BV-MSV- 0210 ở các độ pha 10-6; 10-7; 10-8 | Hình ảnh plaque (đám hoại tử- đốm trắng) của chủng sản xuất BV-WSV- 0310 ở các độ pha 10-6; 10-7; 10-8 |
Phụ lục 4.

Phụ lục 5. Các quy trình kỹ thuật kiểm định
THỬ NGHIỆM VÔ TRÙNG
1. CÁC BƯỚC TIẾN HÀNH
- Kiểm tra vô khuẩn phải được tiến hành trong phòng dành riêng cho thử nghiệm vô khuẩn.
- Phương pháp: cấy trực tiếp.
1.1. Thể tích cấy
- BTP và BTP cuối cùng: 1ml mẫu thử/1 ống môi trường.
- Vắc xin thành phẩm: Tùy theo thể tích đóng trong mỗi lọ vắc xin mà lượng mẫu lấy để thử nghiệm có khác nhau. Cụ thể:
Thể tích vắc xin lấy ra (ml) | Thể tích cấy/ống MT (ml) | |
< 1 | Toàn bộ | Toàn bộ |
Từ 1 đến < 2 | 1 | 1 |
> 4 | 2 | 1 |
1.2. Chuẩn bị
- Ghi số loạt và đánh số ống môi trường.
- Sát trùng các chai đựng BTP, BTP cuối cùng và các lọ vắc xin cần thử bằng dung dịch cồn 700.
1.3. Tiến hành
- Mở lần lượt nắp các chai đựng BTP, BTP cuối cùng và các lọ vắc xin.
- Mở lần lượt nút bông của các ống môi trường Thioglycolate và Soybean.
- Dùng pipet vô trùng để lấy sinh phẩm từ trong mỗi chai (hoặc lọ), cấy trực tiếp bằng cách nhỏ từ từ mẫu thử vào tuýp môi trường.
- Thể tích cấy: mục 6.1.
- Sau khi cấy hơ miệng ống môi trường cẩn thận và đậy kín nút bông.
- Đối với vắc xin đông khô, phải hồi chỉnh bằng nước hồi chỉnh.
- Các thao tác cứ lặp đi lặp lại như vậy cho đến hết số chai (hoặc lọ) mẫu thử.
1.4. Cấy chuyển
- Đối với vắc xin tả: (bao gồm cả bán thành phẩm và bán thành phẩm cuối cùng) phải cấy chuyển vào ngày thứ 7.
- Số lượng môi trường: mục 4.3.3.
- Thể tích cấy: 1ml/1 ống môi trường.
- Không cấy chuyển các ống chứng môi trường.
1.5. Nhiệt độ nuôi cấy
Sau khi các thao tác trong phòng vô trùng, các ống môi trường sẽ được xếp vào 2 giá và giữ ở hai nhiệt độ khác nhau.
BTP và BTP cuối cùng:
- Môi trường Thioglycolate: yêu cầu nhiệt độ 32,5±2,50C
- Môi trường Soybean: yêu cầu nhiệt độ 22,5±2,50C
Vắc xin thành phẩm:
- Môi trường Thioglycolate: 2/3 ống môi trường: 32,5±2,50C và 1/3 ống: 22,5±2,50C
- Môi trường Soybean: 22,5±2,50C
1.6. Thời gian nuôi cấy 14 ngày.
1.7. Theo dõi sau thử nghiệm
- Cả hai loại môi trường đều được theo dõi hàng ngày và ghi kết quả theo dõi vào phiếu theo dõi thử nghiệm vô khuẩn vào các ngày 1, 3, 5, 7, 10 và 14.
2. KẾT QUẢ
2.1. Cách đọc kết quả
- Không có sự phát triển của vi khuẩn và nấm: Cả 2 loại môi trường đều trong, không bị vẩn đục. Môi trường Thioglycolate không bị mất lớp chỉ thị màu ở phía trên.
- Có sự phát triển của vi khuẩn và nấm: Cả 2 loại môi trường đều bị vẩn đục. Môi trường Thioglycolate bị mất lớp chỉ thị màu ở phía trên.
2.2. Giá trị của thử nghiệm
- Loạt môi trường sử dụng để kiểm tra vô khuẩn đạt yêu cầu về thử nghiệm kiểm tra chất lượng môi trường.
2.3. Tiêu chuẩn chấp thuận
- Không có sự phát triển của vi khuẩn và nấm sau 14 ngày theo dõi.
2.4. Hồ sơ
- Kết quả kiểm tra được báo cáo ở Biểu mẫu đính kèm theo SOP#QC-BIO-01 đã được phê duyệt và lưu giữ ở bộ phận QA, phòng QM.
2.5. Thử nghiệm nhắc lại
Điều kiện nhắc lạiKhi không đạt tiêu chuẩn ( mục 7.2 và 7.3).
- Nếu có ống môi trường nuôi cấy bị nhiễm khuẩn: phải tiến hành phân lập và định danh vi sinh vật.
Thử nghiệm nhắc lại lần 1
- Thực hiện với số lượng mẫu và ống môi trường bằng lần thử đầu.
- Thử nghiệm đạt yêu cầu khi đạt mục 7.2 và 7.3.
- Nếu có sự phát triển của vi sinh vật trong bất kỳ ống môi trường nuôi cấy nào: phải phân lập và định danh vi sinh vật.
So sánh kết quả với lần thử đầu: Nếu không có sự khác biệt, sản phẩm bị coi là không đạt vô khuẩn và phải hủy bỏ. Nếu có sự khác biệt, phải tiến hành thử nghiệm nhắc lại lần 2.
Thử nghiệm nhắc lại lần 2:
- Thực hiện với số lượng mẫu và ống môi trường gấp đôi lần thử đầu.
- Thử nghiệm đạt yêu cầu khi đạt mục 7.2 và 7.3.
Nếu phát hiện dù chỉ 1 ống môi trường có bất kỳ loại vi khuẩn tạp nhiễm, loạt sản phẩm đó được kết luận là không đạt yêu cầu về tiêu chuẩn vô khuẩn, phải hủy bỏ.
KIỂM TRA VI RÚT NGOẠI LAI TRÊN TẾ BÀO
1. CÁC BƯỚC TIẾN HÀNH
1.1. Kiểm tra virus ngoại lai trên tế bào chứng trong sản xuất vắc xin/sản xuất chủng
1.1.1. Theo dõi các chai tế bào chứng
+ Theo dõi sự hủy hoại tế bào (CPE) trong các chai tế bào vào ngày thứ 1, 3, 5, 7, 9, 11, 14 và ghi kết quả.
+ Ngày thứ 14 - sau khi quan sát không thấy có CPE, hộn nước nổi trong các chai tế bào, tiến hành kiểm tra virus ngoại lai gây hấp phụ hồng cầu
+ Nước nổi hộn trong các chai tế bào được tiến hành làm các thử nghiệm kiểm tra các tác nhân ngoại lai: - Thử nghiệm kiểm tra vô khuẩn
- Thử nghiệm kiểm tra Mycoplasma
- Thử nghiệm kiểm tra vi khuẩn lao (chỉ áp dụng với tế bào PMKc)
- Kiểm tra các virus ngoại lai trên các dòng tế bào khác
1.1.2. Kiểm tra virus ngoại lai trên các dòng tế bào
3.1.2.1. Chuẩn bị tế bào:
- Số lượng: 6 chai 25cm2 tế bào trong đó 5 chai tế bào/mẫu thử và 1 chai tế bào/mẫu
- Tế bào kín đều một lớp, môi trường trong màu vàng cam.
- Viết tên mẫu thử và ngày tiến hành kiểm tra trên các chai nuôi cấy tế bào.
3.1.2.2. Pha môi trường duy trì tế bào (MEM 2% FBS) theo công thức ở bảng.
Thành phần | Công thức pha 1000 ml | |
1 | MEM(ml) | 980 |
2 | FBS(ml) | 20 |
- Cách pha: Hút môi trường MEM và FBS vào chai thủy tinh. Lắc đều.
3.1.2.3. Kiểm tra trên tế bào
- Loại bỏ môi trường nuôi cấy trong các chai tế bào.
- Rửa tế bào trong dung dịch Hank’s: cho 3ml Hank’s vào mỗi chai, láng đều bề mặt tế bào, hút bỏ Hank’s.
- Nuôi cấy trên tế bào:
Mẫu chứng (1 chai tế bào): 3 ml môi trường duy trì MEM 2% FBS/chai.