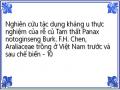
Thể tích tiêm mẫu: 20µl Bước sóng phát hiện: 205nm
Pha tĩnh: Cột Agilent C18 (250 x 4,6mm; 5µm)
Pha động: acetonitril (A) – Acid phosphoric 0,1% trong nước (B), rửa giải theo chương trình sau:
Acetonitril (%) | Acid phosphoric 0,1% trong nước (%) | |
0-20 | 20-22 | 80-78 |
20-45 | 22-46 | 78-54 |
45-55 | 46-55 | 54-45 |
55-70 | 55 | 45 |
Có thể bạn quan tâm!
-
 Tổng Quan Về Các Mô Hình Thực Nghiệm Đánh Giá Tác Dụng Kháng U
Tổng Quan Về Các Mô Hình Thực Nghiệm Đánh Giá Tác Dụng Kháng U -
 Chất Liệu Và Đối Tượng Nghiên Cứu
Chất Liệu Và Đối Tượng Nghiên Cứu -
 Thiết Bị, Dụng Cụ, Hóa Chất Sử Dụngtrong Nghiên Cứu
Thiết Bị, Dụng Cụ, Hóa Chất Sử Dụngtrong Nghiên Cứu -
 Đánh Giá Tác Dụng Của Các Cao Định Lượng Np(H) Và Np(O) Lên Hệ Miễn Dịch Của Chuột Mang Khối U Rắn Sarcoma Tg180.
Đánh Giá Tác Dụng Của Các Cao Định Lượng Np(H) Và Np(O) Lên Hệ Miễn Dịch Của Chuột Mang Khối U Rắn Sarcoma Tg180. -
 Kết Quả Nghiên Cứu Ảnh Hưởng Của Phương Pháp Chế Biến Đến Hàm Lượng Saponin Của Rễ Củ Tam Thất
Kết Quả Nghiên Cứu Ảnh Hưởng Của Phương Pháp Chế Biến Đến Hàm Lượng Saponin Của Rễ Củ Tam Thất -
 Dữ Kiện Phổ 1H Và 13C-Nmr Của Các Hợp Chất Pn3, Pn4, Pn5
Dữ Kiện Phổ 1H Và 13C-Nmr Của Các Hợp Chất Pn3, Pn4, Pn5
Xem toàn bộ 222 trang tài liệu này.

Tiến hành:
Tiêm các dung dịch hỗn hợp chuẩn, ghi nhận sắc ký đồ. Xây dựng đường chuẩn biểu diễn sự phụ thuộc giữa diện tích pic của các chất đối chiếu và nồng độ của chúng trong dung dịch.
Tiêm các dung dịch thử, tiến hành sắc ký, ghi nhận sắc ký đồ.
Hàm lượng một chất trong mẫu dược liệu Tam thất được xác định dựa trên công thức:
Y-b X (%)=
100
x H x k x
100
x
A m x 1000000 100-a
Trong đó:
X: hàm lượng chất cần phân tích tính theo dược liệu khô kiệt (%) Y: diện tích pic của chất cần phân tích trên sắc ký đồ mẫu thử
A,b: các hệ số của phương trình đường chuẩn, xác định bằng thực nghiệm H: độ tinh khiết của chất đối chiếu (tính theo diện tích pic)
k: hệ số điều chỉnh thực nghiệm
m: khối lượng dược liệu mang chiết (g)
41
a: độ ẩm của dược liệu (%)
2.2.1.3. Định lượng hàm lượng saponin trong 2 mẫu cao NP(O) và NP(H) bằng HPLC
* Chuẩn bị mẫu
Dung dịch chuẩn:chuẩn bị như ở mục 2.2.1.2.
Dung dịch thử: Cân chính xác khoảng 200mg cao chiết, thêm ethanol 70%, siêu âm cho tan hoàn toàn, chuyển vào bình định mức 25ml, thêm dung môi đến vạch.
Các dung dịch chuẩn và dung dịch thử được lọc qua màng lọc kích thước 0,45µm trước khi triển khai sắc ký.
Điều kiện sắc ký: như ở mục 2.2.1.2. Tiến hành: như ở mục 2.2.1.2.
Hàm lượng một chất trong mẫu cao Tam thất được xác định dựa trên công thức:
Trong đó:
X (%)= Y-bx H x k x 25x 100 A m x 1000 100-a
- X: hàm lượng chất cần phân tích tính theo khối lượng cao khô kiệt (%)
- Y: diện tích pic của chất cần phân tích trên sắc ký đồ mẫu thử
- A,b: các hệ số của phương trình đường chuẩn, xác định bằng thực nghiệm
- H: độ tinh khiết của chất đối chiếu (tính theo diện tích pic)
- k: hệ số điều chỉnh thực nghiệm
- m: khối lượng cao chiết (mg)
- a: độ ẩm của cao chiết (%)
2.2.2. Nghiên cứu tác dụng kháng u thực nghiệm của các dạng cao định lượng và một số saponin phân lập từ rễ củ Tam thất.
2.2.2.1. Đánh giá tác dụng kháng u của 6 saponin đã phân lập và cao định lượng NP(O), NP(H) trên một số dòng tế bào ung thư người
Theo phương pháp được mô tả bởi Monks A và cộng sự (1991) [117]. Nguyên lý của phép thử: tiến hành xác định hàm lượng protein tế bào tổng số dựa
42
vào mật độ quang học (OD – Optical Density) đo được khi thành phần protein của tế bào được nhuộm bằng Sulforhodamine B (SRB). Giá trị OD máy đo được tỉ lệ thuận với lượng SRB gắn với phân tử protein, lượng tế bào càng nhiều (lượng protein càng nhiều) thì giá trị OD càng lớn.
* Hoạt hóa và nhân nuôi tế bào ung thư người
Tế bào ở trạng thái đông lạnh được rã đông ở 37oC sau đó đem ly tâm ở vận tốc 1300rpm trong 5 phút để thu cặn tế bào. Kết tủa tế bào sau đó được đánh tan trong môi trường nuôi cấy sao cho khả năng phân tán của các tế bào là tốt nhất. Các dòng tế bào ung thư người: ung thư ruột kết (HT29), ung thư tế bào gan (HepG2), ung thư vú (MCF-7), ung thư cơ (RD), ung thư biểu mô đáy phế nang phổi (A549), ung thư biểu mô tuyến phổi (SK-LU-1) sau đó được nuôi cấy trên môi trường thích hợp. Các dòng tế bào dòng tế bào này đều bám dính vào bề mặt đĩa nuôi, được thay môi trường 3 ngày 1 lần cho đến khi số lượng tế bào phủ kín trên 80% diện tích đáy đĩa nuôi cấy tế bào sẽ được tách khỏi chai nuôi bằng Trypsin EDTA 0,04% và cấy chuyển sang đĩa nuôi cấy mới. Chu trình được lặp lại hoàn toàn tương tự cho đến khi thu được lượng tế bào đủ để sử dụng cho các thí nghiệm tiếp theo. Một số tế bào thu được được đem bảo quản trong môi trường nuôi cấy hoàn chỉnh bổ sung 5% DMSO và được lưu trữ ở trong bình chứa Nitơ lỏng.
Thu hoạch tế bào ung thư nuôi cấy trên đĩa nuôi cấy tế bào đường kính 10 cm bằng Trypsin EDTA, sau đó li tâm để loại bỏ môi trường, thu tế bào và hòa đều vào trong môi trường tương ứng. Mật độ tế bào trong môi trường được xác định bằng cách sử dụng buồng đếm Neubauer và kính hiển vi quang học.
* Tiến hành thử nghiệm
Các mẫu thử nghiệm gồm 6 saponin tinh khiết (Mẫu đánh số từ 1 đến 6) và hai mẫu cao định lượng NP(O) và NP(H) được chuẩn bị ở nồng độ gốc là 10 mg/ml trong DMSO100%. Sau đó, mẫu được pha loãng trong điều kiện vô trùng bằng môi trường cơ bản (DMEM) không có FBS (Fetal Bovin Serum) để có dải nồng độ ở đĩa pha mẫu là 100-20-4-0,8 µg/ml; Cuối cùng, 20 µl mẫu từ đĩa pha mẫu ở trên được
đưa vào các giếng của đĩa thử nghiệm 96 giếng, thêm 180 µl dịch tế bào đã điều chỉnh nồng độ phù hợp ở trên vào các giếng này sao cho nồng độ cuối cùng của mẫu thử trong giếng là 10,0 µg/ml; 2,0 µg/ml; 0,4 µg/ml và 0,08 µg/ml. Giếng không có chất thử nhưng có tế bào ung thư (180 µl) sẽ được sử dụng làm đối chứng ngày 0. Giếng đối chứng ngày 0 này, tế bào được cố định bằng Trichloracetic acid - TCA 20% trong 1h. Ủ trong tủ ấm 72 giờ, sau đó tế bào được cố định bằng TCA trong 1 giờ, được nhuộm bằng SRB trong 30 phút ở 37oC, rửa 3 lần bằng acetic acid rồi để khô ở nhiệt độ phòng. Thêm 100µL unbuffered Tris base 10 mM để hòa tan lượng SRB, lắc nhẹ trong 10 phút.Đọc kết quả mật độ quang học (OD) ở bước sóng 540 nm trên máy ELISA Plate Reader (Biotek).
Tỷ lệ (%) ức chế sự phát triển của tế bào khi có mặt chất thử được xác định bằng công thức:
(%) ức chế = 100% -
[OD (chất thử) – OD (ngày 0)] x 100 OD (đối chứng âm) – OD (ngày 0)
Các mẫu được thực hiện lặp lại 3 lần và tính giá trị trung bình.
Giá trị IC50 (nồng độ ức chế 50% sự phát triển) sẽ được xác định bởi phần mềm máy tính TableCurve 2Dv4.
Trong cùng điều kiện thử nghiệm, thuốc chống ung thư Ellipticine ở các nồng độ 10 µg/ml; 2 µg/ml; 0,4 µg/ml và 0,08 µg/ml được dùng làm chất đối chứng dương; dung dịch DMSO 10% được dùng làm đối chứng âm.
2.2.2.2. Đánh giá khả năng gây độc tế bào và khả năng kích thích chết tế bào theo chương trình (apoptosis) của cao định lượng NP(H) trên dòng tế bào ung thư mô liên kết chuột sarcoma TG180.
* Hoạt hóa và nhân nuôi dòng tế bào Sarcoma TG180
Tế bào ở trạng thái đông lạnh được rã đông ở 37oC sau đó đem ly tâm ở vận tốc 1300 vòng/phút trong 5 phút để thu cặn tế bào. Kết tủa tế bào sau đó được đánh tan trong môi trường nuôi cấy RPMI 1640, có bổ sung 10% FBS, 1% kháng sinh
sao cho khả năng phân tán của các tế bào là tốt nhất. Huyền phù được chuyển vào chai nuôi cấy chai nuôi cấy 75cm2 và được giữ trong tủ ấm 37oC, 5% CO2.
Tế bào được thay môi trường nuôi cấy mỗi lần sau hai ngày và cấy chuyển khi tế bào 60 – 70% trong môi trường nuôi cấy, khi đạt được số lượng đủ, tiến hành thu và làm thí nghiệm.
** Đánh giá khả năng gây độc tế bào của cao định lượng NP(H) trên dòng tế bào Sarcoma TG180 nuôi cấy
Để đánh giá khả năng gây độc tế bào của mẫu thử trên dòng tế bào nghiên cứu, chúng tôi sử dụng bộ kit CellTiter 96® Non-Radioactive Cell Proliferation Assay của hãng Promega, Mỹ (gọi tắt là phương pháp MTT).
Nồng độ mẫu thử nghiệmđược trình bày ở bảng 2.1.
Bảng 2.1. Dải nồng độ thử nghiệm của các mẫu thử
Dãy nồng độ thử(*) [Cµg/ml] | ||||||
C1 | C2 | C3 | C4 | C5 | C6 | |
NP(H) | 2000 | 1000 | 500 | 250 | 125 | 62,5 |
Taxol | 2 | 1 | 0,5 | 0,25 | 0,125 | 0,0625 |
ĐCSH(RPMI) | 20 | 20 | 20 | 20 | 20 | 20 |
ĐCDM(DMSO) | 0,5% | 0,5% | 0,5% | 0,5% | 0,5% | 0,5% |
[Cµg/ml] – Nồng độ thử nghiệm tính đơn vị µg/1ml.
ĐCSH là viết tắt của đối chứng sinh học,khi tế bào được nuôi cấy bình thường trong môi trường nuôi cấy RPMI 1460 (Gibco, Mỹ).
ĐCDM là viết tắt của đối chứng dung môi, khi tế bào có ủ với dung môi pha thuốc DMSO (Prolabo, Mỹ).
Quy trình thí nghiệm:
Nạp tế bào: tiến hành nạp tế bào vào trong các giếng của đĩa nuôi cấy 96
giếng với nồng độ 7.000 tế bào/180 µl môi trường nuôi cấy, sau đó ủ trong 37oC, 5% CO2 cho tế bào ổn định trong 24h trước khi tiến hành thử thuốc.
Ủ với thuốc thử: Bổ sung 20µl thuốc thử tương ứng để đạt nồng độ thuốc cần
thiết. Gõ nhẹ vào thành đĩa cho thuốc phân bố đều rồi ủ trong 48h ở trong tủ ấm 37oC, 5% CO2.
Sau 48h, bổ sung vào 40μl dung dịch nhuộm MTS. Gõ nhẹ đĩa và ủ trong 2-
4h ở 37oC. Ở bước này, dung dịch cần được bọc kín để tránh sáng.
Đo mật độ quang học của dung dịch trong giếng bằng máy Microplate Reader ở bước sóng 490 nm.
Dựa vào giá trị mật độ quang học, ta xác định được % tỷ số tăng sinh (A) của
tế bào, từ đó đánh giá được độ độc đối với tế bào của mẫu thử. A được tính theo công thức:
V
A(%) = T x 100
H
VH: giá trị trung bình của mật độ quang học ở các giếng thử với dung môi dùng pha mẫu thử.
T: giá trị trung bình của mật độ quang học ở các giếng thử với mẫu thử.
Nếu A = 50% có nghĩa là mẫu thử có tác dụng gây độc và làm chết 50% tế bào. Nồng độ mẫu thử mà tại đó giá trị A đạt 50% gọi là liều gây chết 50% tế bào, ký hiệu là IC50. Giá trị IC50 càng thấp chứng tỏ khả năng gây độc tế bào của mẫu thử càng cao.
*** Đánh giá khả năng kích thích chết tế bào theo chương trình (apoptosis) của cao định lượng NP(H) trên dòng tế bào ung thư mô liên kết chuột sarcoma TG180
Khả năng kích thích chết tế bào theo chương trình (apoptosis) của cao định lượng NP(H) trên dòng tế bào ung thư mô liên kết chuột sarcoma TG180 được đánh giá bằng kỹ thuật Flow cytometry trên máy BDFACS-Lyric. Tế bào ung thư mô liên kết chuột Sarcomma 180 được ủ với cao định lượng NP(H) tại nồng độ ½
giá trị IC50 (IC50NP(H)/Sar180= 206,65µg/ml) là 103,3µg/ml, với các khoảng thời gian ủ là 12h, 24h và 48h. Thí nghiệm được lặp lại 2 lần.
Sơ đồ thí nghiệm được trình bày ở bảng 2.2
Bảng 2.2. Sơ đồ thí nghiệm đánh giá khả năng kích thích apoptosis của NP(H) trên dòng tế bào ung thư mô liên kết chuột sarcoma TG180
ĐCSH | NP(H) (103,03µg/ml) 12h | NP(H) (103,03µg/ml) 24h | NP(H) (103,03µg/ml) 48h |
ĐCSH | NP(H) (103,03µg/ml) 12h | NP(H) (103,03µg/ml) 24h | NP(H) (103,03µg/ml) 48h |
ĐCSH là viết tắt của đối chứng sinh học, khi tế bào được nuôi cấy bình thường trong môi trường nuôi cấy RPMI 1640 (Gibco, Mỹ).
Chỉ số đánh giá:
Để xác định tỉ lệ tế bào chết theo chương trình chúng tôi sử dụng bộ kít anti- annexin V gắn chất phát huỳnh quang là Fluorescein isothiocyanate (FITC) và chất nhuộm nhân tế bào phát huỳnh quang là 7-Amino Actinomycin D (7AAD). Quy trình chạy flow cytometrytheo hướng dẫn của bộ kit Annexin V Apoptosis Detection (BD) trên máy đếm tế bào BDFACS-Lysis Của hãng BD Mỹ, tại Labo Sinh học phân tử- Bộ môn Sinh lý bệnh, Học viện Quân Y. Các tế bào apoptosis sớm (xác định bởi Annexin V dương tính, PI âm tính), và các tế bào apoptosis muộn (trong giai đoạn sau của quá trình apoptosis hoặc đã chết, xác định bởi Annexin V dương tính, PI dương tính) được đánh giá tự động bởi máy đo, từ đó tính toán ra tỷ lệ % tế bào apoptosis sớm, tỷ lệ % tế bào apoptosis muộn và tỷ lệ % tế bào apoptosis.
2.2.2.3. Nghiên cứu tác dụng ức chế phát triển u của các cao định lượng NP(H) và NP(O) trên chuột nhắt trắng mang khối u rắn sarcoma TG 180.
* Phương pháp tạo khối u rắn sarcoma TG180 trên chuột nhắt trắng
Tế bào ung thư Sarcoma TG180 sau khi được hoạt hóa và nhân nuôi đảm bảo đủ số lượng sẽ được dùng để gây u trên chuột theo phương pháp của Lapis và cộng sự [118]. Cụ thể:
- Tế bào ung thư sarcoma TG 180 được bảo quản trong nitơ lỏng ở -198°C. Đưa tế bào về 37°C cho rã đông. Tế bào ung thư sarcoma TG 180 sau đó được hoạt hóa, nuôi cấy tăng sinh đạt mật độ và số lượng như mong muốn. Ngay trước khi tiêm tế bào gây u, tiến hành li tâm bỏ dịch bảo quản, rửa tế bào 2 lần bằng dung dịch đệm PBS, sau đó pha loãng trong dung dịch PBS. Dùng micropipet hút một lượng nhỏ, cho vào buồng đếm để xác định mật độ tế bào. Pha loãng hỗn dịch tế bào sao để có 5×106tế bào/ml;
- Lắc nhẹ bơm tiêm để các tế bào phân tán đều trong hỗn dịch trước khi tiêm. Các chuột được tiêm 0,1ml hỗn dịch tế bào vào dưới da đùi sau bên phải của chuột, tương ứng với lượng 5×105 tế bào sarcoma TG 180 mỗi chuột.
- Theo dõi trong 5 ngày đầu sau tiêm hỗn dịch tế bào sarcoma TG 180. Đánh giá theo dõi sự hình thành và phát triển khối u tại vị trí tiêm (đùi phải) bằng quan sát, sờ nắn. Những chuột có sự xuất hiện khối u phát triển tại đùi tại chỗ tiêm (thường sau 3 ngày bắt đầu phát hiện rõ khối u), và thể tích khối u tăng dần theo thời gian, được đánh giá là gây u thành công và được đưa vào nghiên cứu.
* Đánh giá tác dụng ức chế phát triển u của các cao định lượng NP(H) và NP(O)
Chuột gây u bằng cách tiêm vào dưới da đùi tế bào sarcoma TG180 như mô tả trên. Các chuột gây u thành công được chia ngẫu nhiên thành 6 lô, thêm 01 lô chuột không gây u, tổng cộng có 7 lô chuột nghiên cứu, mỗi lô 10 con.
- Lô 1 - chứng sinh lý (SL): chuột không gây u, uống nước muối sinh lý 0,3 ml/20g.
- Lô 2 - ung thư (UT): chuột gây u, uống nước muối sinh lý 0,3 ml/20g.