5) Dụng cụ thực địa
Các dụng cụ phục vụ cho công tác điều tra thực địa gồm có: máy định vị GPS, thước đo điện tử độ chính xác 0,01 mm, phiếu giám sát, máy đo nhiệt độ, độ ẩm, máy ảnh, đèn đội đầu, thước dây, ống tiêm, bông tăm, dao lam, bật lửa, bút đánh dấu, cồn, kẹp, tube đựng mẫu DNA, găng tay.
2.3.3. Thu mẫu vật nghiên cứu
Phương pháp thu mẫu: Mẫu vật được thu bằng tay và các dụng cụ chuyên dụng như kẹp có bọc cao su để tránh gây tổn thương đến con vật. Mẫu vật sau khi đo đếm, chụp ảnh, thu mẫu DNA. Các mẫu đại diện sẽ được giữ lại làm tiêu bản nghiên cứu.
Làm tiêu bản: Gây mê bằng miếng bông thấm ethylacetate trong lọ kín (Simmons, 2002), gắn nhãn, cố định trong cồn 90% trong vòng 5-8 giờ tùy thuộc vào kích cỡ của mẫu vật, sau đó chuyển sang bảo quản trong cồn 70%.
Thu mẫu để tách DNA: Các mẫu mô cơ, gan hoặc mô đuôi được thu thập, lưu trữ riêng trong cồn 70% (Merk, CHLB Đức) tại Bộ môn Động vật rừng, Khoa Quản lý Tài nguyên rừng và Môi trường, Trường Đại học Lâm nghiệp, Việt Nam.
2.3.4. Phân tích đặc điểm hình thái và định loại loài tắc kè
Mẫu vật sau khi thu thập được đưa về phòng thí nghiệm trường Đại học Lâm nghiệp Việt Nam để phân tích xử lý. Các chỉ tiêu về kích thước hình thái được đo bằng thước kẹp điện tử với sai số 0,1 mm (Etopoo digital caliper) và đếm các chỉ tiêu vảy bằng kính hiển vi điện tử hiện đại (hình 2.3) (Zoom Stereomicroscope - Olympus SZ61). Các chỉ tiêu hình thái cho từng loài tắc kè theo Nguyen et al. (2013, 2015); Luu et al. (2015, 2016); Ziegler et al.( 2016).
Bảng 2.6. Các chỉ tiêu hình thái các loài tắc kè
Kí hiệu | Giải thích | |
Phần các chỉ số đo (mm) | ||
1 | SVL | Chiều dài thân hoặc kích thước |
2 | TaL | Chiều dài của đuôi |
3 | AG | Khoảng cách từ chi trước đến chi sau |
4 | HL | Chiều dài của đầu |
5 | HW | Chiều rộng của đầu |
6 | HH | Chiều cao của đầu |
7 | SE | Khoảng cách mút mõm đến hốc trước mắt |
8 | EyeEar | Khoảng cách mắt và tai |
9 | ForeL | Chiều dài của chi trước |
10 | FemurL | Chiều dài của đùi |
11 | CrusL | Chiều dài của ống chân |
12 | LD4A | Chiều dài của ngón tay thứ 4 |
13 | LD4P | Chiều dài của ngón chân thứ 4 |
14 | OD | Đường kính của mắt |
15 | EarL | Chiều rộng của tai |
16 | RW | Chiều rộng của tấm mõm |
17 | RH | Chiều cao của tấm mõm |
18 | MW | Chiều rộng của tấm cằm |
19 | ML | Chiều dài của tấm cằm |
Phần các chỉ số đếm (1, 2, 3, ...) | ||
20 | CS | Số gai ở mi mắt |
21 | N | Vảy bao quanh mũi |
22 | I | Tấm giữa tấm trên mũi |
23 | SL | Số vảy môi trên |
24 | IL | Số vảy môi dưới |
25 | IO | Số hàng vảy góc trướcc mắt |
Có thể bạn quan tâm!
-
 Tổng Số Loài Bò Sát Được Ghi Nhận Ở Lào Từng Giai Đoạn
Tổng Số Loài Bò Sát Được Ghi Nhận Ở Lào Từng Giai Đoạn -
 Cây Phát Sinh Chủng Loại Trong Giống Cyrtodactylus Ở Lào.
Cây Phát Sinh Chủng Loại Trong Giống Cyrtodactylus Ở Lào. -
 Thông Tin Điều Kiện Tự Nhiên Địa Điểm Nghiên Cứu
Thông Tin Điều Kiện Tự Nhiên Địa Điểm Nghiên Cứu -
 Các Vị Trí Bắt Gặp, A: Vách Đá; B: Mặt Đất; C: Trên Cây.
Các Vị Trí Bắt Gặp, A: Vách Đá; B: Mặt Đất; C: Trên Cây. -
 Loài Mới Cyrtodactylus Ngoiensis. A: Mẫu Đực (Iebr 4548); B: Mẫu Cái (Iebr A.2013.110). Nguồn Ảnh: A. Teynié Và T.q. Nguyen.
Loài Mới Cyrtodactylus Ngoiensis. A: Mẫu Đực (Iebr 4548); B: Mẫu Cái (Iebr A.2013.110). Nguồn Ảnh: A. Teynié Và T.q. Nguyen. -
 Loài Chưa Xác Định Được Gehyra Sp.1 (A) Mặt Lưng;
Loài Chưa Xác Định Được Gehyra Sp.1 (A) Mặt Lưng;
Xem toàn bộ 204 trang tài liệu này.
Kí hiệu | Giải thích | |
26 | PO | Số hàng vảy từ mũi đến mắt |
27 | PM | Số tấm cằm |
28 | GP | Số vảy bao quanh tấm cằm |
29 | DTR | Số hàng củ lồi trên thân |
30 | GSDT | Số vảy bao quanh củ lồi |
31 | SBL | Số vảy từ sau tấm cằm đến lỗ huyệt |
32 | SR | Số hàng vảy bao quanh thân |
33 | V | Số hàng vảy bụng |
34 | LF1 | Số vảy ngang trên ngón tay 1 |
35 | LF4 | Số vảy ngang trên ngón tay 4 |
36 | LT1 | Số vảy ngang trên ngón chân 1 |
37 | LT4 | Số vảy ngang trên ngón chân 4 |
38 | PP | Số vảy lỗ ở đường trên lỗ huyệt |
39 | PAT | Số củ lồi ở gốc đuôi |
Mẫu vật sau khi đã phân tích các số liệu hình thái được định tên khoa học theo các tài liệu: Smith (1935), Taylor (1963), Đào Văn Tiến (1979), Nguyen et al. (2010, 2011), Hartmann et al. (2013), Ziegler et al. (2013, 2016),
Nguyen et al. (2014), Luu et al. (2014, 2015, 2016), Vassilieva et al. (2016), Schneider et al. (2020) và các tài liệu khác có liên quan.
Ngoài ra, sau khi phân tích định loại mẫu dựa trên các tài liệu, còn so sánh mẫu vật thu được với các mẫu vật đã được định tên đang lưu giữ ở Trường Đại học Lâm nghiệp, Viện Sinh thái và Tài nguyên sinh vật, Hà Nội, Việt Nam.
Danh lục và tên khoa học của các loài tắc kè được sắp xếp theo Uetz et al. (2021). Tên phổ thông của các bậc phân loại theo Nguyen et al. (2009) và một số tài liệu mới công bố gần đây.
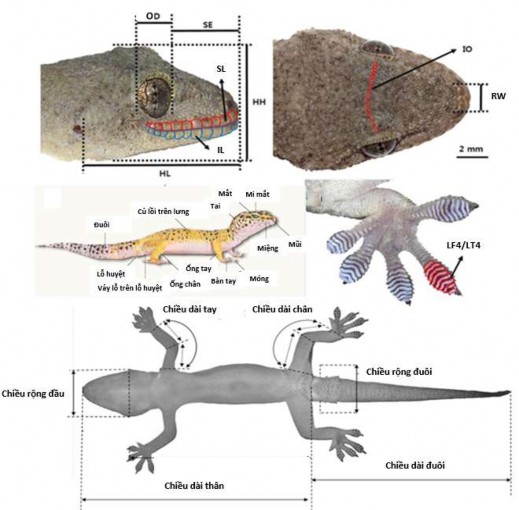
Hình 2.3. Các chỉ tiêu đo và đếm mẫu vật tắc kè
2.3.5. Tách chiết DNA và giải trình tự
Các mẫu mô được lưu trữ ở 4oC trước khi tiến hành tách chiết. Phần mô dùng cho quá trình tách chiết được lấy ở phần sâu bên trong khối mẫu vật nhằm hạn chế nguy cơ nhiễm. Bộ Kit Dneasy Blood and Tissue (Qiagen, CHLB Đức) được sử dụng cho các mẫu có dung lượng ít hoặc thu từ lâu và bảo quản trong điều kiện nhiệt độ và dung dịch không đảm bảo và GeneJet Genomic DNA Purification (ThermoFisher Scientific, Lithuania) cho các mẫu mô mới thu, lượng mẫu nhiều và bảo quản trong điều kiện đảm bảo (cồn Merck 70%, CHLB Đức). Quá trình tách chiết được tiến hành dựa trên hướng dẫn của nhà sản xuất, có chỉnh lý dựa trên quy trình. Quy trình tách chiết được thực hiện theo các bước cụ thể như sau: tiền xử lý mẫu (cắt mẫu thành các mảnh nhỏ, để khô rồi
cho vào ống eppendoft 1.5 ml); phá màng tế bào và loại bỏ protein (sử dụng dung dịch đệm ATL, AL-Qiagen, CHLB Đức; Digestion Solution, Lysis solution-ThermoFisher Scientific, Lithuania và protein K-Qiagen, CHLB Đức); kết tủa DNA (sử dụng cồn 100% hoặc 50%-Merk, CHLB Đức); tách DNA khỏi các thành phần khác của tế bào (cột lọc có chứa màng silica); làm sạch DNA (sử dụng các dung dịch đệm AW1, AW2-Qiagen, CHLB Đức; Wash 1, Wash 2-ThermoFisher, Lithuania), hòa tan DNA (dung dịch đệm AE- Qiagen, CHLB Đức; Elution Buffer-ThermoFisher Scientific, Lithuania). Sau khi tách chiết DNA tổng số, nồng độ ADN tổng số thu được được kiểm tra bằng phương pháp điện di trên gel agarose 1%, đệm TBE 1X (Tris base, Boric acid, EDTA pH 8) ở 70V trong vòng 30 phút. DNA tổng số được so sánh với marker 1 kb và sau đó được hiển thị bằng tia cực tím trên máy Alphamager MINI (Protein Simple, Mỹ).
Phản ứng PCR được thực hiện để khuếch đại đoạn gen COI thuộc hệ gen ty thể với cặp mồi. Trong nghiên cứu này là ưu tiên sử dụng mastermix thành phẩm nhằm bỏ qua thời gian tối ưu hóa điều kiện cho phản ứng PCR và tiết kiệm nguồn mẫu vốn ít ỏi để có thể tiến hành khuếch đại các đoạn gen khắc phục mở rộng nghiên cứu về tiến hóa trong tương lai. Hai mastermix thành phẩm được sử dụng trong nghiên cứu gồm HotStarTaq Mastermix với những mẫu có nồng độ DNA thấp và DreamTaq Mastermix dùng để khuếch đại những mẫu có nồng độ DNA cao.
Tổng thể tích của mỗi phản ứng PCR là 21 µl, bao gồm 1-2 µl ADN khuôn (tùy theo nồng độ DNA tách chiết thu được), 2 µl mỗi mồi (10 µM/µl), 5 µl nước, 10 µl mastermix. Chu trình nhiệt của phản ứng PCR là 95oC ở 15’ đối với mastermix của Qiagen và 5’ đối với mastermix của ThermoFisher; 35 chu kỳ phản ứng ở 95oC trong 30’’, 48oC-60oC trong 45’’, 72oC trong 1’; bước kéo dài cuối cùng ở 72oC trong 6’. Đối chứng âm được tiến hành song song trong mỗi lần tách chiết cũng như trong mỗi lần PCR.
Sản phẩm PCR được kiểm tra bằng phương pháp điện di trên gel agarose 1%, 2pg/ml ethidium-bromide, trong đệm TBE 1X (Tris base, Boric acid, EDTA pH 8) ở 90 V trong 30 phút. Sau đó được hiển thị bằng tia cực tím trên máy Alphamager MINI (Protein Simple, Mỹ). Các sản phẩm PCR thành công được tinh sạch sử dụng kit GeneJET PCR Purification (ThermoFisher Scientific, Lithuania). Qui trình được thực hiện theo hướng dẫn của nhà sản xuất bao gồm các bước: gắn DNA lên màng (sử dụng dung dịch đệm Binding Buffer và cột lọc chứa màng silica); làm sạch DNA (sử dụng 350 µl dung dịch đệm Wash Buffer); hòa tan DNA (sử dụng 30 µl dung dịch đệm hòa tan Elution Buffer). Sản phẩm PCR sau khi tinh sạch được bảo quản ở -4oC sau đó gửi giải trình tự hai chiều tại công ty FirstBase (Malaysia).
2.3.6. Xây dựng cây phát sinh chủng loại
Kết quả giải trình tự được kiểm tra bằng phần mềm Sequencher v5.4.6 (Gene Codes Corp, AnnArbor, MI, USA). Trình tự thu nhận được, được kiểm tra sử dụng công cụ BLAST (Basic Local Alignment Search Tool) có trên trang web của tổ chức National Center for Biotechnology Information. Sau đó, các trình tự đã được giải cùng với các trình tự từ Ngân hàng Gen (Genbank). Sau khi các trình tự được căn chỉnh bằng cách sử dụng phần mềm Clustal X v2 (Thompson et al. 1997), dữ liệu được phân tích bằng cách sử dụng phân tích cú pháp tối đa (MP) như được triển khai trong PAUP*4.0b10 (Swofford 2001), khả năng xảy ra tối đa (ML) như được triển khai trong IQ-TREE v1.6.7.1 (Nguyen et al. 2015), và Bayesian Inference (BI) như được triển khai trong MrBayes v3.2.7 (Ronquist et al. 2012).
Các cài đặt cho phân tích MP và BI theo Le et al. (2006), ngoại trừ việc số thế hệ trong phân tích Bayes đã tăng lên 1×107. Cả BI và ML đều được chạy bằng một mô hình tốt nhất, TVM+I+G, như được chọn bởi jModelTest v2.1.4 (Posada 2008). Điểm giới hạn cho chức năng ghi được đặt là 54 trong phân tích Bayes, vì điểm -lnL đạt mức ổn định sau 54.000 thế hệ trong cả hai lần chạy.
Hỗ trợ Nodal được đánh giá bằng cách sử dụng 1.000 bản sao bootstrap (BP) như được tính toán trong PAUP, 10.000 bản sao bootstrap siêu nhanh (UFB) trong IQ-TREE v1.6.7.1 và xác suất sau (PP) trong MrBayes v3.2. BP ≥ 70 và PP, UFBP ≥ 95% được coi là hỗ trợ mạnh mẽ cho một nhánh (Hillis & Bull 1993; Ronquist et al. 2012; Nguyen et al. 2015) Sự phân kỳ theo cặp không hiệu chỉnh được tính toán trong PAUP* 4.0b10.
2.3.7. Phân tích thống kê
Sử dụng phần mềm MS-Excel trong Microsoft Office 2010 và dựa trên số liệu thu thập được trong quá trình thực địa, kết hợp tham khảo các công trình đã công bố, nghiên cứu này so sánh mức độ tương đồng về thành phần loài giữa miền Bắc và miền Trung các tỉnh có sinh cảnh tương tự. So sánh tương quan giữa thành phần loài giữa các khu vực đã sử dụng phần mềm PAST Statistic Hammer et al. (2001) để phân tích thống kê.
Số liệu được mã hoá theo dạng đối xứng (1: Có mặt; 0: Không có mặt).
Chỉ số tương đồng (Sorensen-Dice index) được tính như sau:
djk = 2M/(2M+N)
Trong đó M là số loài ghi nhận cả 2 vùng; N là tổng số loài chỉ ghi nhận ở một vùng.
2.3.8. Đặc điểm phân bố của các loài tắc kè 1). Phân bố theo sinh cảnh
Căn cứ vào phân chia dạng thảm thực vật và mức độ tác động của con người đếm thảm thực vật theo tài liệu “Sổ tay hướng dẫn điều tra và giám sát đa dạng sinh học (2003) và căn cứ hiện trạng rừng núi đá vôi tại KVNC, được đánh giá phân bố của các loài tắc kè ở 3 dạng sinh cảnh chính gồm:
- Sinh cảnh núi đá vôi thuộc khu canh tác (SC1): là khu vực người dân sử dụng đất trồng các loại cây nông nghiệp và công nghiệp hoặc các loại theo mùa trong đó có các dãy núi đá vôi xen kẽ ở khu đó (hình 2.4).
- Sinh cảnh núi đá vôi thuộc rừng thứ sinh (SC2): là khu vực rừng đã bị tác động hoặc rừng không phát triển, ít cây gỗ to dạng rừng nghèo trong đó có phân bố của núi đá vôi (hình 2.4).
- Sinh cảnh núi đá vôi thuộc rừng nguyên sinh (SC3): là khu vực rừng giầu ít bị tác động có nhiều cây gỗ lớn (hình 2.4).

Hình 2.4. Các dạng sinh cảnh A: (SC1); B: (SC2); C: (SC3)
2). Phân bố theo đai độ cao
Bain & Hurley (2011) căn cứ vào điều kiện tự nhiên gồm địa hình và thảm thực vật đã phân chia khu vực Đông Dương thành 02 đai độ cao là dưới 800 m và trên 800 m. Về nguyên tắc vẫn tuân thủ theo phương pháp phân chia như trên và vẫn tổng hợp số liệu để so sánh.
Tuy nhiên do căn cứ vào đặc điểm thực tế của KVNC có các dạng sinh cảnh phân bố ở nhiều đai độ cao, địa hình có cả đồng bằng và đồi núi từ miền Trung đến miền Bắc và mức độ tác động của con người cũng tương đối giống nhau. Vì vậy để làm rõ và chi tiết hơn độ cao được chia theo mỗi mức là 200 m như: độ cao dưới 200 m, từ 200 đến dưới 400 m, từ 400 đến dưới 600 m, từ 600 đến dưới 800 m, từ 800 đến dưới 1.000 m và trên 1.000 m.
3). Ghi nhận về nơi cư trú của các loài tắc kè
Để đánh giá nơi cư trú của các loài trong họ Tắc kè (Gekkonidae), căn cứ vào vị trí bắt gặp được phân ra thành 3 vị trí gồm:
- Vách đá: là các khe, lỗ, hốc của vách đá cách mặt đất (hình 2.5).