cacbon bằng cách ngâm trong dung dịch keo vàng nano [119] được thể hiện qua ảnh SEM trên hình 1.18.
Có thể bạn quan tâm!
-
 Mục Đích, Phạm Vi Và Đối Tượng Nghiên Cứu Của Đề Tài
Mục Đích, Phạm Vi Và Đối Tượng Nghiên Cứu Của Đề Tài -
![Sơ Đồ Các Giai Đoạn Hấp Phụ Heptanethiol Trên Cu (110) [ 57]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Sơ Đồ Các Giai Đoạn Hấp Phụ Heptanethiol Trên Cu (110) [ 57]
Sơ Đồ Các Giai Đoạn Hấp Phụ Heptanethiol Trên Cu (110) [ 57] -
![Ảnh Sem Graphen Được Chế Tạo Bằng Phương Pháp Cvd [98].](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Ảnh Sem Graphen Được Chế Tạo Bằng Phương Pháp Cvd [98].
Ảnh Sem Graphen Được Chế Tạo Bằng Phương Pháp Cvd [98]. -
 (A) Sự Biến Thiên Thế Theo Thời Gian, (B) Dạng Đường Von-Ampe Hòa Tan Trong Kỹ Thuật Von-Ampe Xung Vi Phân.
(A) Sự Biến Thiên Thế Theo Thời Gian, (B) Dạng Đường Von-Ampe Hòa Tan Trong Kỹ Thuật Von-Ampe Xung Vi Phân. -
 Chế Tạo Các Sam Biến Tính Lớp Aunp Trên Điện Cực Gce
Chế Tạo Các Sam Biến Tính Lớp Aunp Trên Điện Cực Gce -
 Ảnh Sem Của Aunp Trên Bề Mặt Điện Cực Gce Với Thời Gian Tạo Vàng Khác Nhau: 50 Giây (A), 300 Giây (B), 600 Giây (C)
Ảnh Sem Của Aunp Trên Bề Mặt Điện Cực Gce Với Thời Gian Tạo Vàng Khác Nhau: 50 Giây (A), 300 Giây (B), 600 Giây (C)
Xem toàn bộ 138 trang tài liệu này.
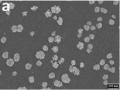
Hình 1. 18. Ảnh SEM các điện cực AuNP được chế tạo bằng các phương pháp khác nhau: áp thế cố định (a) [117], quét thế vòng (b) [120], hấp phụ hóa học (c) [119]
Ảnh SEM cho thấy AuNP chế tạo theo phương pháp điện hóa hay ngâm hấp phụ đều cho hạt vàng ở kích thước nm và có sự phân bố tốt trên điện cực nền. Khi so sánh các phương pháp kết tủa vàng khác nhau, nhóm nghiên cứu của Hezard [106] (năm 2012) đã chỉ ra rằng: so sánh giữa các kĩ thuật kết tủa vàng: quét thế vòng (CV), phương pháp thế tĩnh (CA), thế tĩnh xung kép (PDP) thì chế tạo theo phương pháp thế tĩnh có khả năng kiểm soát được hình thái và mật độ tốt nhất được thể hiện trên hình 1.19.
Hình 1. 19. Ảnh SEM các điện cực AuNP được chế tạo bằng các phương pháp điện hóa khác nhau: phương pháp thế tĩnh (CA) (a), quét thế vòng (CV) (b), thế tĩnh xung kép (PDP) (c) [87]
Ảnh SEM bề mặt điện cực cho thấy: đối với phương pháp CA (hình 1.19a) các hạt vàng tạo thành ở kích thước nano với mật độ dày đặc hơn so với phương pháp CV (hình 1.19b) và không có sự xuất hiện các dây vàng bởi sự xen phủ nhiều vùng khuếch tán dẫn đến sự kết tụ các hạt vàng như phương pháp PDP (hình 1.19c).

Đường CV của điện cực AuNP/GCE trong dung dịch H2SO4 0,5 M [106]
Đặc tính điện hóa của điện cực cũng được tác giả trình bày trong nghiên cứu của mình. Kết quả quét thế vòng trong dung dịch H2SO4 0,5 M của các điện cực cho thấy píc anot tại vị trí thế 1,1 V và 1,3 V tương ứng với quá trình oxi hóa kim loại vàng thành các dạng oxit vàng, chủ yếu là AuO theo phương trình:
Au + H2O → AuO + 2H+ + 2e −
và píc khử tại thế 0,87 V tương ứng với quá trình khử các dạng oxit vàng thành kim loại vàng.
Năm 2016, nhóm nghiên cứu của T.Luczak [22] đã nghiên cứu điện cực biến tính Dopamin trên nền AuNP/Au (kí hiệu Dopamin/AuNP/Au). Các đặc tính điện hóa của điện cực sau chế tạo được so sánh với điện cực biến tính Dopamin trên nền Au (kí hiệu Dopamin/Au) thể hiện trên hình 1.20. Từ kết quả quét CV trong dung dịch đệm photphat ở hình 1.21 (A), tác giả cũng tính toán hệ số độ nhám (roughness factor), điện cực AuNP/Au cao gấp 1,8 lần so với điện cực Au. Kết quả này cũng phù hợp với kết quả ảnh SEM trên hinh 1.21 (B): hình thái bề mặt trên điện cực vàng khá phẳng trong khi trên điện cực AuNP bề mặt gồ ghề hơn, do đó, diện tích bề mặt điện cực AuNP/Au cũng tăng hơn. Bởi vậy, từ đường CV trên hình 1.21 (C) cho thấy tín hiệu dòng tại các píc thu được của điện cực Dopamin/AuNP/Au đều cao hơn so với điện cực Dopamin/Au và các đỉnh pic của điện cực Dopamin/AuNP/Au dịch chuyển về phía âm nên cũng thuận lợi hơn về mặt năng lượng. Từ kết quả thu được đã cho
thấy sử dụng vật liệu điên cực AuNP/Au tạo hiệu ứng xúc tác cao hơn trong quá trình oxi hóa Dopamin so với biến tính trên điện cực Au.
(B) |
(C) |
Hình 1. 21. (A): đường CV của điện cực Au và Au/AuNP trong dung dịch đệm photphat; (B): Ảnh SEM của điện cực Au và AuNP; (C): đường CV của điện cực Dopamin/Au và Dopamin/Au/AuNP trong dung dịch đệm photphat [22]
1.2.2. Vật liệu composit AuNP GO
1.2.2.1. Giới thiệu về graphenoxit
Graphenoxit (GO) là một trong những dẫn xuất quan trọng của graphen, đây là sản phẩm của quá trình oxi hóa graphit. GO có tính chất ổn định hóa học, diện tích bề mặt làm việc lớn (2630 m2/g) [121] và dẫn điện tốt (độ dẫn điện 16,6 S/cm ở điều kiện thường) [122,123], có khả năng hấp phụ tốt thông qua liên kết tĩnh điện và tương tác p-p [124].
Trong GO các nguyên tử cacbon được sắp xếp theo một mô hình lục giác hai chiều đơn lớp với cạnh của các hạt nano chứa các nhóm chức mang oxy: hydroxyl, cacbonyl, carboxylic và epoxy. Cấu trúc của GO phụ thuộc nhiều vào phương pháp tổng hợp và được đưa ra bởi nhiều nhà nghiên cứu [125]. Trong đó, mô hình của Lerf-Klinowski phổ biến hơn cả, graphit sau khi bị oxi hóa, trên mặt phẳng nằm ngang của các lớp có các nhóm hidroxyl, epoxy và trên các góc của mặt phẳng nằm ngang có thể hình thành các nhóm chức cacbonyl hoặc cacboxylic. GO với nhiều nhóm chức trong cấu trúc làm cho vật liệu có xu hướng ưa nước, vì vậy GO phân tán tốt trong nước. Sự hiện diện của của các nhóm chức hoạt động như cacbonyl, epoxy, hidroxyl trên bề mặt của GO cho phép nó tương tác với rất nhiều các phân tử trải dài trên bề mặt biến tính.
GO được tổng hợp từ 3 phương pháp chính đó là: Brodie [126], Staudenmaier
[127] và Hummers và Offeman [128]. Trong đó phương pháp Brodie và Staudenmaier sử dụng kết hợp cả KClO3 và HNO3 để oxy hóa graphit. Trong khi đó, phương pháp Hummers sử dụng cách xử lý graphit với KMnO4 và H2SO4. Với phương pháp Brodie bằng cách sử dụng phương pháp phân tích nguyên tố, phân tử của sản phẩm cuối có công thức C11H4O5. Sản phẩm này có tính axit nhẹ và có khả năng phân tán trong môi trường kiềm, song lại có cấu trúc không hoàn hảo. Với phương pháp Staudenmaier đã có sự thay đổi so với phương pháp Brodie khi sử dụng tác nhân oxy hóa KClO3 để tăng mức độ oxy hóa của GO. Tuy nhiên phương pháp này rất nguy hiểm vì KClO3 là chất dễ gây kích nổ và sản phẩm khí ClO2 được tạo thành có nguy cơ cháy nổ cao.
Phương pháp Hummers sử dụng hỗn hợp H2SO4, NaNO3 và KMnO4 giúp cho sản phẩm GO có mức độ oxy hóa cao hơn các sản phẩm được tổng hợp bằng các phương pháp trước đó [129]. Phụ thuộc vào phương pháp tiến hành oxi hóa mà tỉ lệ cũng như số lượng nhóm chức có khác nhau, ví dụ graphit oxit được tổng hợp bằng phương pháp Hummers có nhiều nhóm epoxy hơn nhóm hydroxyl [130].
1.2.2.2. Vật liệu composit AuNP-GO
Vật liệu nano composit trên cơ sở GO và vàng nano được biết đến với các ưu điểm: dễ tổng hợp, ổn định, có nhiều nhóm chức trên bề mặt, độc tính thấp,…[121], nên được ứng dụng nhiều trong việc loại bỏ kim loại nặng.
Hình 1. 22. Khảo sát bề mặt GO bằng phương pháp đo thế zeta và UV-VIS [131]
Liên kết giữa GO và vàng là liên kết tĩnh điện [132]. So với graphen, GO có nhiều vị trí có mật độ điện tích điện âm cao hơn nên dễ tạo ra tương tác tĩnh điện với
các nguyên tử Au để hình thành composit GO và AuNP, các nhóm oxi trên bề mặt GO cung cấp các vị trí cho sự hình thành liên kết giữa AuNP và GO [131].
Tác giả G. Goncalves đã sử dụng phương pháp đo thế zeta minh chứng cho việc bề mặt GO đều tích điện âm với khoảng pH trải dài từ 1 đến 10,5 (hình 1.22a). Nghiên cứu cũng sử dụng phương pháp UV-VIS chỉ ra rằng GO tương tác với Au tốt hơn so với rGO bởi rGO gây ra sự kết tụ các hạt vàng trong cấu trúc composit (khi rGO chế tạo bởi xử lý nhiệt) hoặc không có sự xuất hiện của các hạt vàng trên rGO (khi rGO chế tạo bởi phương pháp hóa học) được thể hiện trên hình 1.22b. Các nhóm chức trong cấu trúc GO cung cấp các vị trí tạo mầm, kích thích sự tạo mầm và phát triển các hạt vàng nano [131].
1.3. Phân tích thủy ngân
1.3.1. Khái quát chung về thủy ngân
Thủy ngân là nguyên tố có số thứ tự 80, thuộc nhóm IIB trong hệ thống tuần hoàn các nguyên tố hóa học. Thủy ngân có màu trắng bạc, tồn tại ở thể lỏng và dễ bay hơi (ở 20 0C nồng độ bão hòa của hơi thủy ngân là 20 mg/m3, ở 40 0C là 68 mg/m3). Kim loại này có độ dẫn điện cao, nhạy với sự thay đổi nhiệt độ, áp suất và có hệ số nở nhiệt là một hằng số ở trạng thái lỏng. Thủy ngân tan được trong các dung môi phân cực và không phân cực. Một tính chất đặc biệt của thủy ngân là dễ dàng tạo hợp kim với nhiều kim loại khác, hợp kim của thủy ngân được gọi chung là hỗn hống. Tuỳ thuộc vào tỷ lệ của kim loại tan trong thuỷ ngân, hỗn hống có thể ở dạng lỏng hoặc rắn [133,134]. Trong các hợp chất, thủy ngân tồn tại ở hai hóa trị I và II, trong đó các dạng hợp chất chủ yếu được tạo thành từ thủy ngân hóa trị II.
1.3.2. Ứng dụng của thủy ngân
Do một số tính chất hóa lý đặc biệt so với các kim loại khác như: là kim loại có độ dẫn điện cao, dẫn nhiệt kém, có hệ số nở nhiệt là hằng số ở trạng thái lỏng, có khả năng tạo hỗn hống với một số kim loại: vàng, bạc, nhôm,… nên kim loại này được ứng dụng trong nhiều lĩnh vực khác nhau.
Trong công nghiệp, Hg được sử dụng làm nguyên liệu sản xuất bột màu, chất xúc tác trong công nghiệp tổng hợp chất hữu cơ, được sử dụng nhiều trong công nghiệp khai khoáng, các nhà máy thuộc da, nhà máy hóa chất. Ngoài ra, thủy ngân
cũng được sử dụng trong việc chế tạo các dụng cụ đo lường (nhiệt kế, áp lực kế,…), các van tự động điều khiển, các bộ phận chính xác của máy bay phản lực, thiết bị chịu áp lực, bơm chân không.
Trong nông nghiệp, Hg được sử dụng làm thuốc chống nấm, thuốc trừ sâu, diệt côn trùng, diệt chuột, và sử dụng để tẩy uế, sát trùng thú y trong chăn nuôi,… Trong y học, đèn Hg-thạch anh tạo ra bức xạ rất mạnh để khử trùng. Thủy ngân cũng là một thành phần trong hỗn hỗng được sử dụng để chữa các bệnh sâu răng và hàn răng.
Từ sự đa dạng các ngành nghề lĩnh vực sử dụng thủy ngân trong sản xuất như vậy nên việc rò rỉ, phát tán thủy ngân ra môi trường không chỉ gây ô nhiễm nghiêm trọng mà còn làm ảnh hưởng tới sức khỏe con ngưởi.
1.3.3. Độc tính của thủy ngân
Độc tính của thủy ngân phụ thuộc vào từng dạng tồn tại là khác nhau: thủy ngân vô cơ [14], thủy ngân hữu cơ [14], nhưng tất cả đều gây ảnh hưởng nghiêm trọng đến môi trường và sức khỏe con người. Ngộ độc thủy ngân có thể do nhiều nguyên nhân khác nhau: nhiễm độc trực tiếp thông qua ăn uống, hít thở, tiếp xúc qua da với nguồn không khí, hóa chất chứa thủy ngân [135]. Thủy ngân xâm nhâp vào cơ thể con người, tích lũy trong một số bộ phận trong cơ thể: gan, não hoặc các mô từ đó gây ra những vấn đề sức khỏe khác nhau [136]. Khi tiếp xúc với thủy ngân ở nồng độ cao có thể gây ảnh hưởng nghiêm trọng đến hô hấp, viêm phế quản, viêm phổi, loét miệng … Đặc biệt, nếu tiếp xúc với nồng độ thủy ngân ở nồng độ thấp nếu kéo dài vẫn có thể dẫn đến các vấn đề ở hệ tiêu hóa, hệ thống thần kinh hay hệ hô hấp,…
Do ảnh hưởng nghiêm trọng đến sức khỏe như đã trình bày, nên hàm lượng cho phép của thủy ngân trong các mẫu nước rất được quan tâm. Một số tổ chức, quốc gia đã xác định và đưa ra những giới hạn của lượng thủy ngân trong từng loại mẫu nước một cách chi tiết. Ví dụ, Cơ quan Bảo vệ Môi trường Hoa Kỳ (EPA) quy định hàm lượng thủy ngân tối đa trong nước uống là 2 ppb. Giới hạn này được quy định thấp hơn (1 ppb thủy ngân) trong chỉ thị của Liên minh Châu Âu nói riêng [137]. Tổ chức Y tế Thế giới [1] cũng đưa ra khuyến cáo nồng độ thủy ngân trong nước uống không được vượt quá 1 ppb.
Bảng 1. 1. Dạng tồn tại, tính chất và tính độc hại của thủy ngân
Tính chất và độc tính | |
Hg (dạng kim loại) | Ở dạng lỏng tương đối trơ có độc tính thấp |
Hg (dạng hơi) | Có độ bay hơi cao, rất độc khi hít phải |
2+ Hg2 | Tạo được hợp chất không tan với clorua và độc tính thấp |
Hg2+ | Rất độc, khó di chuyển qua màng sinh học |
RHg+ | Có độc tính cao, đặc biệt ở dạng CH3Hg gây nguy hiểm cho hệ thân kinh, não, dễ chui qua màng tế bào sinh học, tích trữ trong mô mỡ |
Nguồn ô nhiễm thủy ngân có thể từ tự nhiên hoặc do con người gây ra: sử dụng thủy ngân như một loại thuốc diệt nấm, thuốc diệt cỏ trong ngành nông nghiệp hay sản xuất giấy, rác thải công nghiệp,… [137]. Chính vì độc tính cao của thủy ngân và sự tích tụ thủy ngân trong môi trường như đã trình bày nên việc phân tích thủy ngân đặc biệt trong các mẫu nước là rất cần thiết.
1.3.4. Các phương pháp phân tích thủy ngân
Tuy các giới hạn cho phép của thủy ngân trong mẫu nước có khác nhau ở các nước, nhưng các giá trị này đều nằm trong khoảng lượng vết. Vì vậy, yêu cầu cần phải có các phương pháp phân tích hiện đại, có độ nhạy và độ chính xác cao để phân tích thủy ngân trong các loại mẫu. Các phương pháp thường được sử dụng trong phân tích thủy ngân là: phổ hấp thụ nguyên tử hóa hơi lạnh (CVAAS), phương pháp phổ khối plasma cảm ứng (ICPMS) và phương pháp điện hóa.
1.3.4.1. Phương pháp quang phổ hấp thụ nguyên tử hóa hơi lạnh
Phương pháp hấp thụ nguyên tử là phương pháp phổ biến phân tích kim loại trong nhiều đối tượng khác nhau: y học, sinh học... với các tính năng ưu việt: độ nhạy, độ chính xác cao. Thuỷ ngân là nguyên tố kim loại duy nhất có áp suất hơi bão hoà rất cao tại nhiệt độ tương đối thấp nên có thể dễ dàng định lượng bằng phổ hấp thụ nguyên tử. Nguyên lý của phương pháp là đo phổ hấp thụ nguyên tử của thủy ngân
kết hợp kỹ thuật hoá hơi lạnh (CVAAS). Trước hết, mẫu được vô cơ hóa bởi các chất oxi hóa mạnh (như: bromua, clorua, thuốc tím hay tia UV…) nhằm chuyển hóa tất cả các dạng thủy ngân tồn tại trong mẫu thành ion Hg2+. Sau khi khử lượng dư thừa các chất oxi hóa ion thủy ngân bị khử đến Hg kim loại bằng các chất khử: như SnCl2 hoặc NaBH4 và thủy ngân nguyên tố được lôi cuốn khỏi pha lỏng của mẫu dưới dạng hơi lạnh bằng việc thổi luồng khí mang trơ qua dung dịch phản ứng. Phổ hấp phụ nguyên tử Hg tại bước sóng 253,7 nm. Để loại trừ ảnh hưởng và làm độ nhạy của phương pháp khi xác định thủy ngân người ta đã sử dụng một số kỹ thuật: kỹ thuật tạo hỗn hống với vàng để làm sạch hơi thủy ngân [138], kỹ thuật bổ chính nền quang học để loại bỏ sự hấp thụ phân tử do hơi hữu cơ gây ra [139].
Trên thế giới đã có rất nhiều nghiên cứu và ứng dụng kỹ thuật hấp thụ nguyên tử hóa hơi lạnh xác định kim loại nặng trong nhiều đối tượng khác nhau. Fátima Silva và cộng sự [140] đã ứng dụng phương pháp CVAAS phân tích thủy ngân trong cá tươi và đưa ra kết quả hàm lượng Hg là 4,8µg/kg cá.
Trong nghiên cứu này, chúng tôi sử dụng phương pháp hấp phụ nguyên tử hóa hơi lạnh để phân tích thủy ngân như một phương pháp để đối chiếu.
1.3.4.2. Phương pháp phổ khối plasma cao tần cảm ứng ICP-MS
Phương pháp phân tích ICP-MS là phương pháp phân tích hiện đại đang được nghiên cứu và phát triển mạnh trong những năm gần đây. Phương pháp phân tích với hệ thiết bị gồm nguồn ICP (nguồn cảm ứng cao tần plasma) chuyển các nguyên tử của nguyên tố trong mẫu thành các ion. Sau đó, những ion này được phân tách và phát hiện bằng thiết bị khối phổ. Phương pháp ICP-MS có khả năng chọn lọc đồng vị của bộ dò phổ khối [141,142] nên cho phép phân tích thủy ngân trong thời gian ngắn và giới hạn phát hiện thấp hơn so với phương pháp AAS.
Phương pháp ICP-MS đã được các tác giả sử dụng trực tiếp hoặc kết hợp với phương pháp phân tích dòng chảy, hoặc hệ sắc ký lỏng để xác định Hg ở hàm lượng vết trong nước tự nhiên, trầm tích cũng như các mẫu trong lĩnh vực sinh hóa, hóa dầu… [14,143-145]. Giới hạn phát hiện thủy ngân xác định bằng phương pháp ICP- MS có thể đạt tới 0,001 ppb. J. Allibone và cộng sự [146] đã nghiên cứu và xác định hàm lượng thủy ngân trong nước bằng phương pháp ICP – MS và đưa ra giới hạn phát hiện của Hg là 0,032 µg/L.

![Sơ Đồ Các Giai Đoạn Hấp Phụ Heptanethiol Trên Cu (110) [ 57]](https://tailieuthamkhao.com/uploads/2022/07/13/nghien-cuu-bien-tinh-dien-cuc-than-thuy-tinh-bang-vat-lieu-co-cau-truc-nano-4-1-120x90.jpg)
![Ảnh Sem Graphen Được Chế Tạo Bằng Phương Pháp Cvd [98].](https://tailieuthamkhao.com/uploads/2022/07/13/nghien-cuu-bien-tinh-dien-cuc-than-thuy-tinh-bang-vat-lieu-co-cau-truc-nano-5-1-120x90.jpg)