Kết quả này cho thấy có sự cản trở của các hợp chất tồn tại trong mẫu phân tích và vai trò của việc xử lý điện hóa đối với các hợp chất hữu cơ trong việc phát hiện Hg (II) trong các mẫu thực. Các điều kiện xử lý điện hóa cũng được tiến hành khảo sát. Kết quả được trình bày dưới đây:
(b) | |
(c) |
(d) |
Có thể bạn quan tâm!
-
 Sự Biến Đổi Dòng Píc Hg (Ii) Ở Nồng Độ 1 Ppb Theo Số Lần Sử Dụng Của Điện Cực Pet-Sam/aunp
Sự Biến Đổi Dòng Píc Hg (Ii) Ở Nồng Độ 1 Ppb Theo Số Lần Sử Dụng Của Điện Cực Pet-Sam/aunp -
 Kết Quả Phân Tích Hàm Lượng Hg (Ii) Trong Cùng Một Mẫu Trong Hai Ngày Liên Tiếp
Kết Quả Phân Tích Hàm Lượng Hg (Ii) Trong Cùng Một Mẫu Trong Hai Ngày Liên Tiếp -
 Đường Dpasv Và Đường Chuẩn Theo Chiều Cao Píc Trên Điện Cực Pet- Aet-Sam/ Aunp-Go Khi Nồng Độ Thủy Ngân Tăng Dần Từ 30 Ppt Đến 3500 Ppt.
Đường Dpasv Và Đường Chuẩn Theo Chiều Cao Píc Trên Điện Cực Pet- Aet-Sam/ Aunp-Go Khi Nồng Độ Thủy Ngân Tăng Dần Từ 30 Ppt Đến 3500 Ppt. -
 Nghiên cứu biến tính điện cực than thuỷ tinh bằng vật liệu có cấu trúc nano ứng dụng để xác định thuỷ ngân trong môi trường nước - 16
Nghiên cứu biến tính điện cực than thuỷ tinh bằng vật liệu có cấu trúc nano ứng dụng để xác định thuỷ ngân trong môi trường nước - 16 -
 Nghiên cứu biến tính điện cực than thuỷ tinh bằng vật liệu có cấu trúc nano ứng dụng để xác định thuỷ ngân trong môi trường nước - 17
Nghiên cứu biến tính điện cực than thuỷ tinh bằng vật liệu có cấu trúc nano ứng dụng để xác định thuỷ ngân trong môi trường nước - 17
Xem toàn bộ 138 trang tài liệu này.
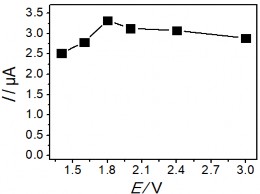
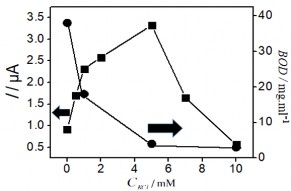
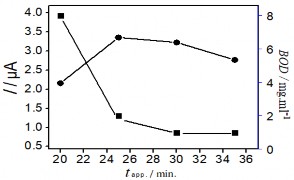
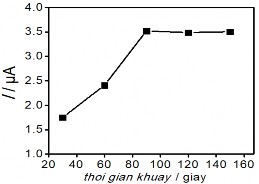
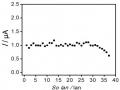
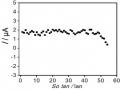
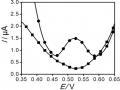
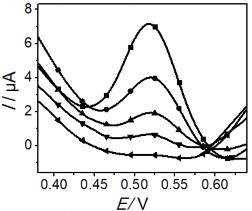
Hình 3. 41. Ảnh hưởng của thế áp (a); nồng độ KCl (b); Thời gian điện phân (c); và thời gian khuấy (d) đến tín hiệu Hg (II)
Kết quả thu được cho thấy, ban đầu sự biến đổi tín hiệu dòng Hg (II) ở hình
3.41 a, b, c tương ứng với thế áp, nồng độ KCl và thời gian điện phân đều tăng đến một điểm dừng, tại đây tín hiệu dòng thu được là lớn nhất. Ngược lại, hình 3.41 b, c cho thấy sự giảm đáng kể BOD cho thấy sự giảm lượng hợp chất hữu cơ trong mẫu. Kết quả thu được này cho thấy rò vai trò của quá trình xử lý điện hóa để loại bỏ ảnh hưởng của các hợp chất hữu cơ trong việc xác định Hg (II). Sau đó, dòng píc có xu hướng giảm dần qua điểm dừng khi tiếp tục tăng thế áp, nồng độ KCl và thời gian điện phân. Thế áp để xảy ra quá trình điện phân đạt giá trị lớn nhất là +1,8 V, việc tăng thế áp hơn nữa có thể ảnh hưởng đến hiệu suất điện phân. Khi nồng độ KCl lớn hơn 5 mM tín hiệu dòng Hg (II) giảm nhanh cho thấy ảnh hưởng của chất oxy hóa
đến bề mặt SAM. Liên kết Au-S dễ bị oxy hóa trong điều kiện môi trường xung quanh, và ảnh hưởng xấu đến chất lượng và cấu trúc SAM [187]. Kết quả này cũng phù hợp với nghiên cứu của tác giả khác [188]. Sự gia tăng thời gian điện phân trong 25 phút dẫn đến xu hướng giảm tín hiệu dòng, vậy thời gian 25 phút là thời gian vừa đủ để oxi hóa các chất trong mẫu. Hình 3.41d khảo sát thời gian khuấy, là khoảng thời gian mà dung dịch được khuấy ở tốc độ quay 60 vòng / phút sau khi kết thúc quá trình điện phân. Sự biến thiên của tín hiệu dòng Hg (II) cho thấy việc kéo dài thời gian đến 80 phút là điều kiện tối ưu, đủ để loại bỏ các hợp chất hữu cơ oxy hóa trong mẫu thực. Kết quả phân tích Hg (II) được xác định bằng phương pháp thêm chuẩn. Chiều cao píc Hg (II) được xác định từ phổ đồ Von-Ampe như trình bày dưới đây:
|
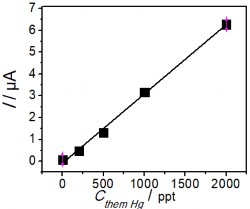
Hình 3. 42. Đồ thị thêm chuẩn (hình trái) và đường DPASV (hình phải) xác định Hg
(II) trong mẫu nước sông Tô Lịch đã qua xử lý
Hình 3.42 là phổ DPASV sử dụng điện cực PET-AET-SAM / AuNP + GO xác định Hg (II) trong mẫu nước sông Tô Lịch với các nồng độ khác nhau. Trong hình này, có thể quan sát thấy sự xuất hiện của đỉnh ở điện thế 0,52 V và dòng píc tăng dần khi thêm dần dung dịch chuẩn Hg (II). Kết quả thu được có sự tương quan tuyến tính tốt giữa tín hiệu dòng và nồng độ với hệ số tương quan R=0,996 và hàm lượng Hg(II) được xác định là 24 ppt.
Kết quả thu được cho thấy hoàn toàn có thể xử lý các mẫu thực có chứa các hợp chất hữu cơ với các điều kiện tối ưu và sử dụng điện cực biến tính SAM để xác định Hg (II) ở hàm lượng vết.
KẾT LUẬN
Các nghiên cứu trong bản luận án đã tập trung vào việc biến tính bề mặt điện cực than thủy tinh (GCE) sử dụng vật liệu nano là các hạt vàng dạng cầu (AuNP), graphen oxit (GO) cùng 4- pyridine ethanthiol (PET) và 2-aminoethanthiol (AET) để tạo đơn lớp tự sắp xếp (Self-Assembled Monolayer - SAM), nhằm nâng cao độ nhạy và độ chọn lọc cho việc phân tích phát hiện lượng vết Hg(II) trong mẫu nước. Các kết quả chính gồm:
1. Đã chế tạo thành công lớp phủ AuNP cũng như composit AuNP-GO trên bề mặt GCE bằng phương pháp điện hóa làm vật liệu nền để biến tính với PET và AET. Các kết quả cho thấy sự có mặt của AuNP đã liên kết được với các phân tử PET và AET, cũng như sự có mặt của GO đã làm tăng diện tích bề mặt hoạt động điện hóa của điện cực biến tính đến 26,98 %.
2. Đã nghiên cứu sử dụng các điện cực biến tính với SAM đơn cấu tử PET, AET cũng như SAM hai cấu tử này (PET-AET) để tăng độ chọn lọc đối với Hg(II) trong quá trình làm giàu. Các kết quả Vol-Ampe xung vi phân đã cho thấy chiều cao dòng pic ứng với tín hiệu của Hg(II) (IHgII) tăng đáng kể đối với điện cực biến tính PET- AET-SAM/AuNP-GO tương ứng là: 0,3 A (AET-SAM/AuNP), 1,0 A (PET- SAM/AuNP), 1,80 A (PET-AET-SAM/AuNP), 3,50 A (PET-AET- SAM/AuNP+GO). Giới hạn phát hiện Hg(II) của điện cực biến tính PET-AET- SAM/AuNP+GO là 18,99 ppt, nhỏ hơn nhiều so với các giá trị của các điện cực biến tính PET-SAM/AuNP và PET-AET-SAM/AuNP tương ứng là 38,42 ppt và 31,97 ppt.
3. Khả năng tăng độ nhạy phát hiện Hg(II) đối với điện cực biến tính PET-AET- SAM/AuNP-GO đã được nghiên cứu do không chỉ sự tăng diện tích bề mặt hoạt động điện hóa do sự mặt của GO trên vật liệu nền, mà còn do thay đổi định hướng của các phân tử PET, AET khi có mặt GO trên bề mặt nhờ liên kết hidrô giữa các nhóm chức cũng như tương tác giữa các điện tử của vòng benzen. Nhờ đó, PET-AET- SAM trên bề mặt composit AuNP-GO có cấu trúc bền và tăng khả năng liên kết với Hg(II) tại các nhóm chức.
4. Ưu điểm của loại điện cực biến tính PET-AET-SAM/AuNP+GO còn được thể hiện ở việc tăng khoảng tuyến tính giữa dòng píc và nồng độ Hg(II). Khoảng này là 30 ppt – 3500 ppt với hệ tương quan R2 = 0,999 so với 100 ppt – 1000 ppt và 50
ppt – 2000 ppt tương ứng với các điện cực biến tính PET-SAM/AuNP, PET-AET- SAM/AuNP. Hơn nữa, số lần sử dụng của điện cực biến tính PET-AET-SAM/AuNP- GO để phân tích Hg(II) lên đến 112 lần với độ lặp lại RSD 5,19% so với 30 lần và 51 lần tương ứng với các điện cực biến tính PET-SAM/AuNP và PET-AET- SAM/AuNP.
5. Khả năng ứng dụng của điện cực biến tính cũng đã được tiến hành đối với một số mẫu nước biển và nước thải công nghiệp. Các kết quả thu được có độ chính xác có thể chấp nhận được so với phương pháp hấp thụ nguyên tử, cho thấy loại điện cực biến tính có thể được sử dụng phân tích phát hiện lượng vết Hg(II) trong một số mẫu môi trường.
NHỮNG ĐÓNG GÓP MỚI CỦA LUẬN ÁN
1. Đã chế tạo các điện cực AuNP và composit AuNP-GO được biến tính bằng đơn lớp tự sắp xếp (SAM) của 2-aminoethanethiol hydrochloride (AET) và 4-pyridine ethanethiol hydrochloride (PET).
2. Các điện cực đã chế tạo cho thấy điện cực AuNP-GO biến tính bởi hai cấu tử PET và AET có khả năng xác định Hg (II) tốt hơn cả, với giới hạn phát hiện là 18,99 ppt, khoảng tuyến tính 30 ppt – 3500 ppt với hệ số tương quan là 0,999.
DANH MỤC CÔNG TRÌNH CÔNG BỐ LIÊN QUAN ĐẾN LUẬN ÁN
1. Đặng Thanh Huyền, Phạm Thị Hải Yến, Nguyễn Hoàng Anh, Phạm Hồng Phong. Bước đầu ứng dụng sensor điện hóa có cấu trúc nano xác định lượng vết thủy ngân trong nước biển. Tạp chí Hóa học, 52 (6A), 181-185, 2014.
2. Phạm Hồng Phong, Đặng Thanh Huyền, Nguyễn Hoàng Anh, Vũ Thị Thu Hà. Effects of Introducing 2-aminoethanethiol into 4-pyridineethanethiol Self- assembled Monolayer Applicable to Enhance Sensitivity of Hg(II) Electrochemical Analysis, Journal of New Materials for Electrochemical System, 18, 207-212, 2015.
3. Đặng Thanh Huyền, Vũ Đức Lợi, Phạm Hồng Phong. Study of an electrochemical behaviour of modified binary self-assembled monolayers for enhancing sensitivity of Hg(II) detection. Tạp chí Hóa học, 54(2), 223-227, 2016.
4. Đặng Thanh Huyền, Phạm Hồng Phong. Study of 4-pyridineethanthiol modified composite graphene oxide-AuNPs electrode for inhancing the sensitivity of Hg(II) determination, Tạp chí Hóa học, 54(6e2), 160-164, 2016.
5. Đặng Thanh Huyền, Vũ Đức Lợi, Vũ Thị Thu Hà, Phạm Hồng Phong. Effect elimination of organic compounds by electrolysis to enhance the electrochemical signal of Hg (II) determination using two-component self-assembled thin layer modified the composit on glassy carbon electrode. Tạp chí Hóa học, 56(4e), 136- 140, 2018.
6. Phạm Hồng Phong, Đặng Thanh Huyền, Vũ Đức Lợi, Vũ Thị Thu Hà, Nguyễn Thị Cẩm Hà, Nguyễn Ngọc Hà, Lê Minh Thành. Conformational changes in self- assembled monolayer of 4-pyridineethanethiol and 2-aminoethanethiol on the gold nanoparticles-graphene oxide composite and advantages in Hg(II) determination. Journal of Nanoparticle Research, 21,159, 2019.
TÀI LIỆU THAM KHẢO
1. Guidelines for drinking-water quality, fourth edition, World health organization, (2011).
2. M.S. Jeoung & H.S. Choi, Spectrophotometric determination of trace Hg(II) in cetyltrimethylammonium bromide media, Bulletin of the Korean Chemical Society, 25 (12), 1877-1880, (2004).
3. E. K. Pavlos & G. K. K. Nikolaos, Selective mercury determination after membrane complexation and total reflection X-ray fluorescence analysis, , Analytical Chemistry, 76 (15), 4315-4319, (2004).
4. J.M. Ombaba, Total Mercury determination in Biological and Environmental Standard Samples by Gold Amalgamation Followed by Cold Vapor Atomic Absorption Spectrometry, Micro. Chem. J, 53 (2), 195-200, (1996).
5. P. Jones J. Murphy, S.J. Hill, Determination of total mercury in environmental and biological samples by flow injection cold vapour atomic absorption spectrometry, Spectrochimica Acta Part B: Atomic Spectroscopy, 51 (14), 1867-1873, (1996).
6. H. Bagheri & amp; A. Gholami, Determination of very low levels of dissolved mercury(II) and methylmercury in river waters by continuous flow with on- line UV decomposition and cold-vapor atomic fluorescence spectrometry after pre-concentration on a silica gel-2-mercaptobenzimidazol sorbent, Talanta, 55 (6), 1141-1150, (2001).
7. S. Zampieri P. Ugo, L. M. Moretto, Determination of mercury in process and lagoon waters by inductively coupled plasma-mass spectrometric analysis after electrochemical preconcentration: comparison with anodic stripping at gold and polymer coated electrodes, Analytica Chimica Acta, 434 (2), 291- 300, (2001).
8. A. C. Barbosa & G. A. East G. R. Boaventura, Multivessel system for cold-vapor mercury generation determination of mercury in hair and fish, Biological Trace Element Research, 60 (1-2), 153-161, (1997).
9. M. de la Guárdia J. S. dos Santos, A. Pastor, Determination of organic and inorganic mercury species in water and sediment samples by HPLC on-line coupled with ICP-MS, Talanta, 80 (1), 207-211, (2009).
10. Z. Cheng T. Zhang, Y. Wang, Z. Li, C. Wang, Y. Li, Y Fang, Self-assembled 1-octadecanethiol monolayers on graphene for mercury detection, Nano Lett, 10 (11), 4738-4741, (2010).
11. Giovana L. Okajima Newton L. Dias Filho, Geovanna Pires, Voltammetry of Mercury(II) Based on an Organo-Clay Modified Graphite Electrode, Portugaliae Electrochimica Acta, 26 163-179, (2008).
12. Antje Widmann & amp; Constant M G van den Berg, Mercury Detection in Seawater Using a Mercaptoacetic Acid Modified Gold Microwire Electrode, Electroanalysis, 17 (10), 825-831, (2005).
13. Nor Azah Yusof Nurulhaidah Daud, Tan Wee Tee, Development of Electrochemical Sensor for Detection of Mercury by Exploiting His-Phe-His- Ala-His-Phe-Ala-Phe Modified Electrode, Int. J. Electrochem. Sci., 6 2798 - 2807, (2011).
14. Vũ Đức Lợi, Nghiên cứu xác định một số dạng thủy ngân trong các mẫu sinh học và môi trường, Luận án Tiến sĩ, Viện Hóa học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam, 2008).
15. Phùng Thị Thu Huyền, Xác định lượng vết thủy ngân bằng phương pháp chiết pha rắn quang học, Luận án Thạc sĩ, Place of test, Trường Đại học Khoa học Tự nhiên đại học quốc gia hà nội, (2012).
16. Trịnh Xuân Giản & amp; Tống Thị Thanh Thủy Dương Thị Tú Anh, Nghiên cứu xác định đồng thời hàm lượng vết As(III) và Hg (II) bằng phương pháp Von- ampe hòa tan anot sử dụng điện cực màng vàng, , Tạp chí phân tích Hóa, Lý và Sinh học, 14 (4), 44-48, (2009).
17. VTT Ha PTH Yen, PK Duy, VH Dang, Investigation of electrochemical properties of homemade nano gold electrodes and application in determination of Hg (II) at the trace levels, Vietnam Journal of Chemistry, 53 (5), 657).
18. K.; Morikawa Lee, Y.; Langreth, D. C. , Adsorption of n-Butane on Cu(100), Cu(111), Au(111), and Pt(111): van der Waals Density Functional Study, Phys. Rev., 82 155461, (2010b).
19. Apparao Chaitanya Kumar, Yakub, Corrosion protection of copper by self assembled monolayers, Indian Journal of Chemical Technology, 16 (1), 25- 31, (2009).
20. El-Ads E.H. Atta N.F., Galal A, Self-Assembled Monolayers on Nanostructured Composites for Electrochemical Sensing Applications, (2016).
21. R.W. Cernosek, Palladium as a Substrate for Self-Assembled Monolayers Used in Biotechnology, Anal. Chem, 76 (20), 6116-6121, (2004).
22. M.Osińska T.Łuczak, New self-assembled layers composed with gold nanoparticles, cysteamine and dihydrolipoic acid deposited on bare gold template for highly sensitive and selective simultaneous sensing of dopamine in the presence of interfering ascorbic and uric acids, Solid State Electrochemistry, 21 (3), 747-758, (2016).
23. M. A. Hines A. Dhirani, A. J. Fisher, O. Ismail, and P. Guyot-Sionnest, Structure of Self-Assembled Decanethiol on Ag(111): A Molecular Resolution Scanning Tunneling Microscopy Study, Langmuir, 11 (7), 2609-2614, (1995).
24. Zutphen Wöhrmann Print Services, The Netherlands, Self-assembled monolayers on metal oxides : applications in nanotechnology, (2010).
25. Christine L.; Diehl McGuiness, Gregory A.; Blasini, Daniel; Smilgies, D. M.; Zhu, M.; Samarth, Nitin; Weidner, Tobias; Ballav, Nirmalya; Zharnikov, Michael; Allara, David L., Molecular self-assembly at bare semiconductor surfaces: Cooperative substrate-molecule effects in octadecanethiolate monolayer assemblies on GaAs(111), (110), and (100), ACS Nano, 4 (6), 3447-3465, (2010).
26. Lara A. Estroff J. Christopher Love, Jennah K. Kriebel, Ralph G. Nuzzo, George M. Whitesides Self-Assembled Monolayers of Thiolates on Metals as a Form of Nanotechnology, Chem. Rev., 105 1103-1169, (2005).
27. P. A. Lewis R. K. Smith, P. S. Weiss, Patterning self-assembled monolayers,
Prog. Surf. Sci, 75 1-68, (2004,).