E =E0
+ RTln [ X ]
(6.3)
X/XnX/Xn
nF [ X n]
E n
0
X/X
là thế điện cực chuẩn, được xác định trong điều kiện [ X ] = 1
Có thể bạn quan tâm!
-
 Giới Thiệu Một Số Chất Chỉ Thị Màu Thông Dụng
Giới Thiệu Một Số Chất Chỉ Thị Màu Thông Dụng -
 Độ Hòa Tan Của Một Chất Phụ Thuộc Vào Những Yếu Tố Nào?thế Nào Là Dung Dịch Bão Hòa Và Dung Dịch Chưa Bão Hòa?
Độ Hòa Tan Của Một Chất Phụ Thuộc Vào Những Yếu Tố Nào?thế Nào Là Dung Dịch Bão Hòa Và Dung Dịch Chưa Bão Hòa? -
 Cân Bằng Phương Trình Phản Ứng Oxi Hoá - Khử
Cân Bằng Phương Trình Phản Ứng Oxi Hoá - Khử -
 Điện Phân Các Chất Nguyên Chất Nóng Chảy
Điện Phân Các Chất Nguyên Chất Nóng Chảy -
 Các Phương Pháp Chống Ăn Mòn Kim Loại Và Hợp Kim
Các Phương Pháp Chống Ăn Mòn Kim Loại Và Hợp Kim -
 Đại Cương Về Các Chất Vô Cơ
Đại Cương Về Các Chất Vô Cơ
Xem toàn bộ 237 trang tài liệu này.
[ X n]
Ví dụ: Điện cực Selen được ký hiệu là Se Se2-
Phản ứng xảy ra ở điện cực như sau: Se + 2e Se2-
d. Điện cực khí
Điện cực khí thường gồm một thanh platin có phủ một lớp platin xốp được hấp thụ khí trên bề mặt và nhúng trong dung dịch chứa ion của chất khí đó.
Ví dụ: Điện cực hiđro
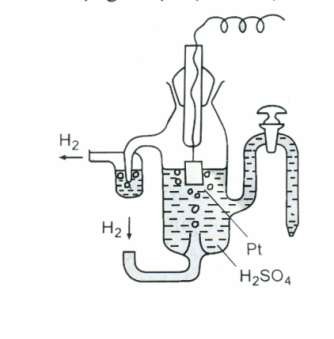
Hình 6.3. Điện cực hiđro Phản ứng ở điện cực như sau:
2H+ + 2e H2
Khi đó trên bề mặt điện cực xuất hiện một thế điện cực EOXH/KH
E =E0
+ RTln [H ]2
2H/H2
2H/H2 nF P
H
2
(6.4)
Khi áp suất của khí hiđro bằng 1at, nhiệt độ 298K, nồng độ H+ trong dung dịch bằng 1mol/ lít ta được điện cực hiđro chuẩn. Thế điện cực hiđro được quy ước bằng 0.
E
0
2H/H2
=0V
6.3.2. Thế điện cực chuẩn
Hiệu điện thế cân bằng xảy ra ở các điện cực (hay được gọi là thế điện cực) được biểu thị bằng Von (V). Để xác định thế điện cực chuẩn của một điện cực người ta thiết lập một pin gồm điện cực chuẩn cần xác định thế điện cực và điện cực hiđro rồi đo hiệu số điện thế lớn nhất giữa hai điện cực. Hiệu số điện thế lớn nhất này là thế cực chuẩn của điện cực cần xác định hay còn gọi là thế khử chuẩn (vì thế của điện cực hiđro chuẩn được quy ước bằng 0,00V) Thế khử chuẩn được kí hiệu là Eo(ox/kh).
Thế điện cực tiêu chuẩn của điện cực nào càng nhỏ trị số đại số thì dạng khử của nó hoạt động càng mạnh còn dạng oxi hoá của nó hoạt động càng kém và ngược lại.
Ví dụ: Thế điện cực tiêu chuẩn của Na rất nhỏ (-2,714V) nên kim loại Na (dạng khử) hoạt động rất mạnh.
Na - 1e → Na+ rất dễ
Nhưng ion Na+ (dạng oxi hoá) thu electron rất khó Na+ + 1e → Na
Cặp oxi hoá - khử nào có thế điện cực tiêu chuẩn lớn thì dạng oxi hoá của nó có thể oxi hoá được dạng khử của cặp có thế điện cực tiêu chuẩn nhỏ hơn.
Ví dụ:
E0Zn2+/Zn = -0,76V; E0Ag+/Ag = -0,779V
Ion Ag+ có thể oxi hoá kẽm kim loại: Zn + Ag+ Zn2+ +Ag
Từ nhận xét này có thể suy ra: Chỉ những kim loại nào có thế điện cực tiêu chuẩn nhỏ hơn không mới đẩy được hiđro ra khỏi dung dịch axit loãng.
Ví dụ: Zn có thể đẩy được hiđro ra khỏi dung dịch axit HCl nhưng Cu không thể đẩy được.
6.3.3. Các yếu tố ảnh hưởng đến thế khử của một cặp oxi hoá - khử
Xét cặp oxi hoá - khử:
aOx + ne b Kh
E
E
0
(Ox/Kh ) Ox/Kh
TR
nF
Oxa
ln Khb
(6.5)
ở 25oC (298K):
E
E
0
Ox/Kh Ox/Kh
0.059
n
Oxa
lg Khb
(6.6)
Công thức (6.5) là công thức Nernst biểu thị ảnh hưởng của nồng độ đến thế khử của một cặp oxi hoá - khử.
Ví dụ: Thế khử của cặp oxi hoá - khử:
Cu2+ + 2e = Cu(tt)
E 2+
= E0 2+
+ 0, 059 lg[Cu2+]
Cu /Cu
Cu / Cu2
Ví dụ: Thế khử của cặp oxi hoá - khử:
MnO4- + 5e + 8H3O+ = Mn2+ + 12H2O(l)
E 2
E0
2
0, 059 lg
8
MnO4H O
3
MnO4 /Mn MnO4 /Mn5
Mn2
6.4. Chiều và hằng số cân bằng của phản ứng Oxi hoá - khử trong dung dịch nước
6.4.1. Chiều của phản ứng
Trong dung dịch nước, chiều của phản ứng oxi hoá - khử dựa vào thế đẳng áp - đẳng nhiệt G:
G = - nFE (6.7)
Trong đó: F: Hằng số Farađay,F = 96500 C/mol.
n: Số electron trao đổi giữa chất khử và chất oxi hoá của phản ứng.
E = EOXH - EKH
Để phản ứng Ox1 + Kh2 Kh1 + Ox2 xảy ra theo chiều thuận thì G < 0 nghĩa là: E > 0
Nếu phản ứng xảy ra trong điều kiện chuẩn, thì G0 =- nFE0 với E0 = E0OXH – E0 KH
Ví dụ 1: Phản ứng dưới đây xảy ra theo chiều nào?
Zn(tt) + Cu2+ → Zn2+ + Cu(tt) E0Zn2+/Zn = -0,76V; E0Cu2+/Cu = 0,34V
Giải: E = E0Cu2+/Cu - E0Zn2+/Zn = 1,1 (V) > 0
G0 < 0 phản ứng xảy ra theo chiều thuận.
Ví dụ 2: Phản ứng dưới đây xảy ra theo chiều nào ở điều kiện chuẩn 250C?
Cu(tt) + Zn2+ → Cu2+ + Zn(tt) Giải: G0 = - 2 . 96500. (- 0,76 - 0,34) > 0.
Vậy phản ứng trên xảy ra theo chiều nghịch.
Chú ý: Nếu phản ứng ở điều kiện khác điều kiện chuẩn, phải dùng công thức (6.11).
Ví dụ 3: Có phản ứng sau:
Fe2+ + Ag+ → Fe3+ + Ag.
a) Cho biết chiều của phản ứng ở điều kiện chuẩn 250C?
b) Một dung dịch có chứa Fe(NO3)30,1M ; Fe(NO3)2 0,01M; AgNO3 0,01M và Ag kim loại dư. Phản ứng xảy ra theo chiều nào?
Giải:
a) G = - 1. 96500 (0,80 - 0.77) < 0 phản ứng theo chiều thuận. b)Áp dụng công thức (6.11)
G = - 1. 96500 [E0Ag+/Ag - E0Fe3+/Fe2+ ] =
0
E (Ag/Ag)
0,80 0,059 lg 0,01 0,68V
1
E0 0,77 0,059 lg
0,1
0,83V
Fe3/ Fe2
1 0,01
E0Ag+/Ag - E0Fe3+/Fe2+ = 0,68 - 0,83 = - 0,15 V
G = - 96500.( - 0,15) > 0 phản ứng xảy ra theo chiều nghịch
6.4.2. Hằng số cân bằng của phản ứng oxi hoá - khử
Từ công thức: G0 = - nFE0 = - RTlnK
n.Eo RT ln K
F
(6.8)
Ở 250C trở thành:
lgK=
nE0 0,059
(6.9)
n là số e trao đổi trong phản ứng, E0 = E0OXH – E0KH Ví dụ: Tính hằng số cân bằng ở 250C của phản ứng:
Fe2+ + Ag+ Fe3+ + Ag
Giải:
lg K 1(0,8 0, 77) 0, 058
0, 059
K = 3,22
6.5. Pin và ăc quy
6.5.1. Khái niệm
Giống nhau: Pin và acquy đều được cấu tạo từ hai điện cực có điện thế khác nhau, được nhúng vào một hay nhiều dung dịch chất điện li. Nếu hai cực nhúng vào hai dung dịch điện li khác nhau thì phải được ngăn bằng miếng xốp hay nối với nhau bằng cầu muối.
Khác nhau: Phản ứng xảy ra trong pin chỉ xảy ra theo một chiều (phóng điện) còn phải ứng xảy ra trong acquy có thể xảy ra theo chiều ngược lại khi có tác động của dòng điện bên ngoài (nạp điện).
Sơ đồ cấu tạo:
- Nếu hai cực được nhúng vào hai dung dịch điện li khác nhau:
(+) ĐC1 dd1 dd2 ĐC2 (-)
Ví dụ pin Zn-Cu: (+) Cu CuSO4 0.5M ZnSO4 0.1M Zn (-)
- Nếu hai điện cực được nhúng vào cùng một dung dịch điện li:
(+) ĐC1 dd ĐC2 (-)
Ví dụ acquy chì: (-) Pb H2SO4 1M PbO2 (+)
6.5.2. Suất điện động của pin điện hoá
a. Định nghĩa
Suất điện động của pin là giá trị (trị tuyệt đối) của hiệu số điện lớn nhất giữa hai điện cực của pin. Công thức tính sức điện động của pin:
E = E+ - E- > 0 (6.10)
E : Sức điện động của pin, (V)
E+ : Thế điện cực của điện cực dương, (V)
E- : Thế điện cực của điện cực âm, (V)
0 0
Nếu pin được cấu tạo bởi 2 điện cực ở điều kiện chuẩn thì suất điện động là chuẩn và được xác định:
E0 = E+ - E - > 0 (6.11)
Ví dụ: Đối với pin Cu - Zn, ở điều kiện tiêu chuẩn là:
E = 0,34 - (- 0,76) = 1,1V
b. Các yếu tố ảnh hưởng đến suất điện động của pin: (Công thức Nernst) Xét một pin sau: (-) Pt Sn4+, Sn2+ Fe2+, Fe3+ Pt (+)
Phản ứng xảy ra trong pin khi làm việc:
Sn2+ + 2Fe3+ Sn4+ + 2Fe2+
Giả sử pin làm việc một cách thuận nghịch, nhiệt động học ở áp suất và nhiệt độ không đổi thì sự biến thiên thế đẳng áp G bằng công có ích lớn nhất (công điện) mà pin có thể thực hiện và được tính bằng biểu thức:
G nFE E G
nF
Trong đó: F: Hằng số Farađay,F = 96500 C/mol.
(6.12)
n: số electron trao đổi giữa chất khử và chất oxi hoá của phản ứng trong pin.
E: Suất điện động của pin (V), E > 0
Nếu pin được cấu tạo bởi hai điện cực ở điều kiện chuẩn thì:
0 0 0
G0
G nFE E
(6.13)
nF
Suất điện động của pin được tính theo công thức:
0
TRSn
2
E E ln
2
Fe
32
nF Sn4Fe2
Một cách tổng quát: Nếu phản ứng xảy ra trong pin như sau: aA + bB cC + dD
A,B, C, D là những chất tan trong dung dịch (có thể dạng ion) thì
E E0
TR ln nF
AaBb
CcDd
(6.14)
Nếu nhiệt độ T = 298K thì:
E E0 0.059
n
AaBb
lg CcDd
(6.15)
Công thức (6.8) là công thức Nernst về ảnh hưởng của nồng độ và nhiệt độ đến suất điện động của pin điện hoá.
Ví dụ: Cho pin thiết lập ở 25o C.
(-) Z n ZnSO4 0,01M Pb(NO3) 0,001M Pb (+)
Viết phương trình hóa học của các quá trình điện cực. Tính sức điện động của pin khi pin làm việc? Biết:
E0Zn2+/Zn = -0,76V ; E0Pb2+/Pb = -0,13V
Giải
Các quá trình điện cực:
ở anot: Zn - 2e Zn2+ ở catot: Pb2+ + 2e Pb
suy ra phản ứng trong pin là: Zn + Pb2+ Zn2+ + Pb
vậy E
(Pb-Zn)
= E+
- E-
= E0
0, 059lg CPb2
2 C
Zn2
0,13 0, 76 0, 059
2
= 0,50 (V)
6.5.3. Giới thiệu một số loại pin và Acquy
a. Pin mangan - kẽm (pin khô)
Là loại pin quen thuộc thông dụng nhất hiện nay. Catot là một lòi than chì(1), bao quanh là hỗn hợp MnO2 và bột than chì (4) (bột than chì làm tăng độ dẫn điện). Tiếp theo là lớp chất điện giải ở dạng hỗn hợp nhão gồm: NH4Cl, ZnCl2, H2O và tinh bột (3). Ngoài cùng được bao bởi anot chế tạo từ kẽm lá (2) (hình 6.4.)
1
3
3
4
Hình 6.4. Sơ đồ cấu tạo pin Mn-Zn Sơ đồ cấu tạo đơn giản của pin:
(-) ZnNH4Cl MnO2,C (+)
Khi pin hoạt động, ở anot xảy ra sự oxi hoá: Zn - 2e Zn2+
ở catot xảy ra sự khử:
2MnO2 + 2NH4+ + 2e Mn2O3 + 2NH3 + H2O
Phản ứng khi pin làm việc là:
Zn + 2MnO2 + 2NH4+ Zn2+ + Mn2O3 + 2NH3 + H2O
Phương trình tính sức điện động của pin là:
E =E0
-E0
+ RT ln
[Zn2+ ]P2
NH
3
[H2O]
pin MnO2 /Mn2O3
Zn2+ /Zn
4
2F [NH+ ]2
Điện thế của pin là 1,5V. Pin được dùng trong rađio, đèn pin, đồ chơi.
Loại pin này có ưu điểm là rẻ, sạch, nhiều kích cỡ. Nhược điểm của pin là NH3 được tạo ra có thể làm ngắt mất dòng, thời gian sống ngắn.
b. Pin kiềm
Pin kiềm cũng là pin khô quan trọng. Cấu tạo cua pin cũng tương tự như pin mangan - kẽm, chỉ khác chất điện giải là KOH.
Khi pin hoạt động ở anot Zn bị oxi hoá:
Zn + 2OH - ZnO + H2O + 2e
ở catot MnO2 bị khử:
MnO2 + 2H2O + 2e Mn(OH)2 + 2OH -
Điện thế của pin là 1,5V. Pin kiềm cũng được sử dụng như pin mangan - kẽm. Ưu điểm của pin là không bị ngắt dòng, thời gian sống lâu hơn, sạch, nhiều kích