DANH SÁCH HÌNH
Trang
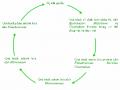
Hình 2.1: Chu trình chuyển hóa nitơ trong tự nhiên 9
Hình 3.1: Hệ thống bể thí nghiệm với tỷ lệ thể tích bể lọc khác nhau 16
Hình 3.2: Cách xác định mật độ vi khuẩn theo phương pháp MPN 21
Hình 4.1: Biến động hàm lượng oxy hòa tan trong hệ thống tuần hoàn 24
Hình 4.2: Biến động hàm lượng oxy hòa tan trong hệ thống thay nước 25
Hình 4.3: Biến động hàm lượng COD trong hệ thống tuần hoàn 26
Hình 4.4: Biến động hàm lượng COD trong hệ thống thay nước 27
Có thể bạn quan tâm!
-
 Đánh giá khả năng cải thiện chất lượng nước của nhóm vi khuẩn chuyển hóa đạm trong hệ thống ương tôm sú (penaeus monodon) - 1
Đánh giá khả năng cải thiện chất lượng nước của nhóm vi khuẩn chuyển hóa đạm trong hệ thống ương tôm sú (penaeus monodon) - 1 -
 Tình Hình Nghiên Cứu Và Sử Dụng Chế Phẩm Sinh Học Trong Nuôi Trồng Thủy Sản
Tình Hình Nghiên Cứu Và Sử Dụng Chế Phẩm Sinh Học Trong Nuôi Trồng Thủy Sản -
 Hệ Thống Bể Thí Nghiệm Với Tỷ Lệ Thể Tích Bể Lọc Khác Nhau
Hệ Thống Bể Thí Nghiệm Với Tỷ Lệ Thể Tích Bể Lọc Khác Nhau -
 Xác Định Khả Năng Chuyển Hóa Đạm Của 3 Dòng Vi Khuẩn Bacillus, Nitrobacter, Nitrosomonas Trong Hệ Thống Ương Tôm Sú
Xác Định Khả Năng Chuyển Hóa Đạm Của 3 Dòng Vi Khuẩn Bacillus, Nitrobacter, Nitrosomonas Trong Hệ Thống Ương Tôm Sú
Xem toàn bộ 88 trang tài liệu này.
Hình 4.5: Biến động hàm lượng TSS trong hệ thống tuần hoàn 28
Hình 4.6: Biến động hàm lượng TSS trong hệ thống thay nước 28

Hình 4.7: Biến động hàm lượng TAN trong hệ thống tuần hoàn 29
Hình 4.8: Biến động hàm lượng TAN trong hệ thống thay nước 29
Hình 4.9: Biến động hàm lượng nitrite trong hệ thống tuần hoàn 31
Hình 4.10: Biến động hàm lượng nitrite trong hệ thống thay nước 32
Hình 4.11: Biến động hàm lượng nitrate trong hệ thống tuần hoàn 33
Hình 4.12: Biến động hàm lượng nitrate trong hệ thống thay nước 33
Hình 4.13: Biến động hàm lượng tổng đạm trong hệ thống tuần hoàn 34
Hình 4.14: Biến động hàm lượng tổng đạm trong hệ thống thay nước 35
Hình 4.15: Biến động mật độ vi khuẩn Vibrio trong hệ thống tuần hoàn 36
Hình 4.16: Biến động mật độ vi khuẩn Vibrio trong hệ thống thay nước 37
Hình 4.17: Biến động mật độ vi khuẩn Bacillus trong hệ thống tuần hoàn 38
Hình 4.18: Biến động mật độ vi khuẩn Bacillus trong hệ thống thay nước 39
Hình 4.19: Biến động mật độ vi khuẩn Ntrosomonas trong hệ thống tuần hoàn ...40 Hình 4.20: Biến động mật độ vi khuẩn Nitrosomonas trong hệ thống thay nước..40 Hình 4.21: Biến động mật độ vi khuẩn Nitrobacter trong hệ thống tuần hoàn 42
Hình 4.22: Biến động mật độ vi khuẩn Nitrobacter trong hệ thống thay nước 42
Hình 4.23: Tỷ lệ sống các giai đoạn ấu trùng trong hệ thống tuần hoàn 43
Hình 4.24: Tỷ lệ sống các giai đoạn ấu trùng trong hệ thống tuần thay nước 44
Hình 4.25: Biến động hàm lượng oxy hòa tan trong thí nghiệm 46
Hình 4.26: Biến động hàm lượng COD trong thí nghiệm 47
Hình 4.27: Biến động hàm lượng TAN trong thí nghiệm 48
Hình 4.28: Biến động hàm lượng nitrite trong thí nghiệm 49
Hình 4.29: Biến động hàm lượng nitrate trong thí nghiệm 49
Hình 4.30: Biến động mật độ vi khuẩn Vibrio trong thí nghiệm 50
Hình 4.31: Biến động mật độ vi khuẩn Bacillus trong thí nghiệm 51
Hình 4.32: Biến động mật độ vi khuẩn Nitrosomonas trong thí nghiệm 51
Hình 4.33: Biến động mật độ vi khuẩn Nitrobacter trong thí nghiệm 52
DANH MỤC CHỮ VIẾT TẮT
NT: Nghiệm thức
ĐC: Đối chứng
HT: Hệ thống
TB: Trung bình
CFU: Colony forming units
AOB: Ammonia oxidizing bacteria NOB: Nitrite oxidizing bacteria
MPN: Most probable number
OD: Optical density
PL: Post larvae
ppm: Parts per million
Phần I GIỚI THIỆU
Những năm qua nghề nuôi tôm sú ở nước ta phát triển rất mạnh không những về qui mô mà còn ở sự đa dạng hóa các mô hình nuôi, khi diện tích nuôi ngày càng mở rộng thì người nuôi phải đối đầu với trở ngại mới, đó là ô nhiễm môi trường và dịch bệnh. Sự phát triển ồ ạt của nghề nuôi tôm ven biển dẫn đến sự bùng nổ dịch bệnh trên diện rộng, gây thiệt hại không nhỏ cho người dân cũng như các ngành kinh tế liên quan. Việc nâng cao mức độ an toàn cho các trang trại nuôi thông qua sự phát triển các mô hình nuôi tôm khép kín đã và đang được khuyến khích áp dụng ở nhiều nơi trên thế giới cũng như ở Việt Nam. Do đó, việc xử lý nước thải bằng phương pháp sinh học và tái sử dụng nguồn nước đóng một vai trò quyết định nhằm giảm lượng hóa chất và thuốc kháng sinh sử dụng trong quá trình sản xuất giống và nuôi thương phẩm, tạo ra sản phẩm sạch đảm bảo an toàn vệ sinh thực phẩm (Bùi Đắc Thuyết, 2004). Theo nghiên cứu của Đặng Đình Kim và ctv (2006) thì khi bổ sung chế phẩm sinh học vào ao nuôi, các chỉ tiêu lý, hóa, sinh được cải thiện rất rò.
Trong lĩnh vực sản xuất giống, để có được nguồn nước đáp ứng được yêu cầu trong sản xuất giống, người ta dùng các loại hóa chất như: Chlorine, thuốc tím... để xử lý, tuy nhiên việc sử dụng hóa chất xử lý nước sẽ không tránh khỏi tình trạng ô nhiễm môi trường, hơn nữa việc sử dụng hóa chất sẽ làm ảnh hưởng đến hệ vi sinh vật trong môi trường nước. Vì vậy, xu hướng hiện nay nhiều nơi sử dụng các vi sinh vật hữu ích nhằm cải thiện chất lượng nước và hạn chế được các nhóm vi khuẩn gây bệnh trong hệ thống ương nuôi. Trong sản xuất giống tôm sú, việc ứng dụng hệ thống lọc sinh học sẽ hạn chế sử dụng kháng sinh trong bể và hạn chế việc thay nước hàng ngày, giảm hiện tượng sốc môi trường và khống chế được một số vi khuẩn gây bệnh (Thạch Thanh và ctv, 1999).
Trên thị trường đã xuất hiện rất nhiều chế phẩm sinh học với thành phần chủ yếu là các dòng vi khuẩn như: Bacillus, Pseudomonas, Lactobacillus, Nitrosomonas, Nitrobacter..., các dòng vi khuẩn này có khả năng phân giải protein thành các polypeptit, axit amin, NH3 (Tăng Thị Chính và Đặng Đình Kim, 2007). Tuy nhiên, hiện nay vẫn chưa có nhiều nghiên cứu về sự tồn tại cũng như hiệu quả của các dòng vi khuẩn được đưa vào trong hệ thống lọc sinh học, đặc
biệt là nhóm vi khuẩn Bacillus, Nitrobacter, Nitrosomonas chuyển hóa nitơ từ dạng có hại cho sinh vật nuôi (NH3, NO2-) thành dạng ít độc hơn (NO3-) (Vũ Thế Trụ, 1994). Do đó, đề tài: “Đánh giá khả năng cải thiện chất lượng nước của nhóm vi khuẩn chuyển hóa đạm trong hệ thống ương tôm sú (Penaeus monodon)” được thực hiện.
Mục tiêu nghiên cứu
Nghiên cứu khả năng phân hủy hữu cơ và chuyển hóa đạm của các dòng vi khuẩn Bacillus, Nitrosomonas, Nitrobacter trong hệ thống ương tôm sú nhằm làm cơ sở cho các nghiên cứu về quản lý và điều khiển vi sinh phát triển theo hướng có lợi cho môi trường và vật nuôi.
Nội dung nghiên cứu
- Đánh giá hiệu quả xử lý nước của vi khuẩn trong hệ thống ương tôm sú tuần hoàn.
- Đánh giá hiệu quả xử lý nước của vi khuẩn trong hệ thống ương tôm sú có thay nước.
- Đánh giá hiệu quả xử lý ở các tỷ lệ thể tích giá thể khác nhau trong hệ thống lọc tuần hoàn.
Phần II
LƯỢC KHẢO TÀI LIỆU
2.1 Tình hình sản xuất giống tôm sú và các nghiên cứu có liên quan
2.1.1 Tình hình sản xuất giống tôm sú ở Việt Nam
Công nghệ sản xuất giống tôm nhân tạo ở nước ta đã có những bước tiến bộ vượt bậc. Từ những năm đầu thập niên 70, Việt Nam đã sản xuất giống nhân tạo thành công ở một số loài tôm biển, tuy nhiên việc ương nuôi gặp nhiều khó khăn. Đến thập niên 80, kỹ thuật sản xuất nhân tạo giống tôm sú du nhập từ Đài Loan, Thái Lan, Nhật Bản được cải tiến và áp dụng thành công tại Việt Nam (Bộ Thủy Sản, 2000).
Miền Trung là nơi sớm nhất phát triển sản xuất giống tôm sú nhân tạo, trong đó nổi bật nhất là tỉnh Khánh Hòa. Từ đây, công nghệ sản xuất giống tôm sú được chuyển giao cho các tỉnh lân cận và các tỉnh phía Nam.
Đến năm 1990, cả nước có 500 trại sản xuất giống, tập trung chủ yếu ở các tỉnh miền trung, năng suất đạt khoảng 1 – 5 triệu PL/năm. Năm 1994 cả nước sản xuất được khoảng 1,4 tỷ tôm PL15 (Bộ Thủy Sản, 2000). Đến năm 1998, số trại sản xuất tôm giống tăng lên 2.086 trại và sản xuất được 6,6 tỷ tôm PL15. Tính đến năm 2003, cả nước có 5.094 trại tôm giống với sản lượng đạt 25,9 tỷ con giống cho nghề nuôi tôm (Bộ Thủy Sản, 2005). Trong đó, số lượng trại tôm giống ở Đồng Bằng Sông Cửu Long cũng phát triển nhanh chóng, đáp ứng 31,9% nhu cầu tôm giống cho toàn vùng (Lê Xuân Sinh, 2004).
2.1.2 Các nghiên cứu liên quan đến sản xuất giống tôm sú
Thạch Thanh và ctv (2004) nghiên cứu sử dụng nước biển nhân tạo trong sản xuất giống tôm sú thay một phần hoặc hoàn toàn cho nước biển và nước ót, tuy nhiên nguồn nước này hiện vẫn chưa được ứng dụng nhiều.
Các nghiên cứu gần đây đã nghiên cứu ứng dụng ozone để xử lý nước và vi khuẩn có hại trong bể ương ấu trùng tôm sú. Nghiên cứu của Trần Thị Kiều Trang và ctv (2006) đã đưa ra các nồng độ xử lý ozone thích hợp cho từng giai đoạn ấu trùng và hậu ấu trùng, tiếp theo là nghiên cứu của Tạ Văn Phương (2006) cho thấy ozone có khả năng cải thiện chất lượng nước trong ương nuôi thủy sản
(Ở nồng độ 0,37 ppm làm kết tủa hoàn toàn sắt, ngăn chặn sự sự tích lũy hữu cơ (30%), làm giảm 67% lượng H2S có trong nước và nitrate hóa hoàn toàn nitrite, nồng độ 0,045 ppm có thể làm giảm mật độ tổng vi khuẩn 91,7% và 81% vi khuẩn Vibrio). Kết quả cho thấy tỷ lệ sống của ấu trùng là rất tốt khi ương ở hệ thống có xử lý ozone với nồng độ thay đổi theo từng giai đoạn (Nguyễn Lê Hoàng Yến, 2008), ngoài ra sử dụng ozone để rửa trứng còn ngăn chặn sự lây lan bệnh đốm trắng từ tôm mẹ sang tôm con (Tăng Minh Khoa, 2008). Những nghiên cứu này góp phần hạn chế việc sử dụng các loại hóa chất, kháng sinh trong quá trình ương tôm giống, giúp nâng cao năng suất chất lượng tôm sú giống và góp phần trong việc quản lý dịch bệnh xảy ra trên tôm giống.
Ngoài vấn đề nguồn nước thì nguồn tôm bố mẹ cũng đang rất được quan tâm. Hiện nay, nguồn tôm bố mẹ ngoài tự nhiên ngày càng cạn kiệt và dễ nhiễm bệnh. Nghiên cứu của Nguyễn Văn Chung và ctv (1997) đã cho tôm bố mẹ từ nguồn tôm trong ao đìa sinh sản thành công, kết quả này đã góp phần giải quyết vấn đề khan hiếm tôm bố mẹ và góp phần chủ động nguồn tôm nuôi.
Bên cạnh đó, việc gia hóa tôm bố mẹ được nghiên cứu và đưa vào sử dụng, tuy sức sinh sản, tỷ lệ thành thục, tỷ lệ nở,…không hiệu quả bằng tôm tự nhiên nhưng có thể được sử dụng để thay thế khi nguồn tôm ngoài tự nhiên khan hiếm và mang nhiều mầm bệnh nguy hiểm (Nguyễn Thanh Phương, 2005).
2.1.3 Các nghiên cứu ứng dụng lọc sinh học trong sản xuất giống
Nghiên cứu ứng dụng lọc sinh học vào sản xuất giống tôm sú của Thạch Thanh và ctv (1999) đã góp phần nâng cao kỹ thuật sản xuất giống tôm sú, với phương pháp này giúp hạn chế thay nước và sử dụng nước ót nên có thể ứng dụng cho sản xuất giống tôm sú trong nội địa.
Một nghiên cứu khác cho thấy, nhóm vi khuẩn nitrate hóa (Nitrosomonas, Nitrobacter) khi cấy vào bể lọc sinh học với giá thể là CaCO3 và hệ thống này nối với các bể nuôi rotifer đã giúp mật độ rotifer tăng lên đến 5.500 cá thể/mL, cao hơn 1,5 – 2,5 lần so với nghiệm thức đối chứng, hơn nữa chất lượng nước trong các bể nuôi cũng được cải thiện (Belgium et al., 1999).
Nghiên cứu của Grommen et al. (2001) cho thấy khi bổ sung 2 nhóm vi khuẩn Nitrosomonas và Nitrobacter vào hệ thống lọc sinh học đã giúp rút ngắn thời gian vận hành các bể lọc xuống còn 40 ngày so với các nghiên cứu trước đó cần khoảng 60 ngày ở điều kiện 21 – 260C.
Theo Nguyễn Tiến Cư và ctv (2004) nghiên cứu các loại chất mang khác nhau cho lọc sinh học thì cho hiệu quả xử lí amon trung bình khác nhau: lô nhựa đạt 47,77%; sỏi nhẹ đạt 75,25%, san hô đạt 70,75%. Kết quả thử nghiệm cho thấy sử dụng sỏi nhẹ làm vật liệu cố định vi sinh vật trong hệ lọc có triển vọng nhất. Hệ lọc sinh học với cột lọc tầng sôi và cột lọc nhỏ giọt cải tiến sử dụng sỏi nhẹ đã
thực hiện quá trình nitrate hóa NO2-, NO3- cao, hàm lượng NO2- trong môi
trường nước ở mức 0,1-0,79 mg/L; NO3- ở mức 0,61-21,2 mg/L.
Bower và Turner (1981 và 1984) trích dẫn bởi Thạch Thanh và ctv, 2004 đã nghiên cứu và nhận thấy nếu sử dụng vật liệu lọc cũ (đã sử dụng trước đó) cho lọc mới thì có ý nghĩa rút ngắn thời gian chuẩn bị lọc (cấy vi khuẩn). Nếu thêm vào 10% vật liệu lọc ngầm của hệ thống lọc ngầm cũ trong môi trường nước mặn thì rút ngắn được 81% thời gian cấy vi khuẩn (4 ngày so với 21 ngày) cho quá trình sử dụng ammonia của vi khuẩn Nitrosomonas và 89% (4 ngày so với 37 ngày) cho sự phát triển của vi khuẩn Nitrobacter
Theo Nguyễn Tiến Cư và ctv (2004) Nitrosomonas và Nitrobacter đã giúp xử lý nước thải trong hệ thống nuôi tôm sú tuần hoàn, hàm lượng ammonia bị oxy hóa khoảng 85 – 98%.
Khi so sánh tỉ lệ sống của tôm ở giai đoạn postlarvae 15 cho thấy ở nghiệm thức nước tuần hoàn là 55,2% cao hơn có ý nghĩa thống kê (p<0,05) so với nghiệm thức thay nước chỉ đạt 43,8% (Châu Tài Tảo, 2005).
2.2 Tình hình nghiên cứu và ứng dụng của vi sinh vật hữu ích trong nuôi trồng thủy sản
2.2.1 Sơ lược về Probiotic
Vào năm 1965, thuật ngữ “Probiotic” đã được biết đến lần đầu tiên do Lilley và Stilluell đề nghị như là “Những chất do một vài sinh vật sản sinh ra, có khả năng kích thích sự tăng trưởng của một loài khác” (Trần Công Bình và Trương Trọng Nghĩa, 2002).
Sau đó Fuller (1989) đã định nghĩa “Probiotic là các sinh vật sống, được cho vào thức ăn, có ảnh hưởng tốt với ký chủ bằng cách cải thiện hệ vi sinh đường ruột.
Đến năm 2000, Verchuere et al. đưa ra một định nghĩa được coi là hoàn chỉnh nhất về probiotics trong nuôi trồng thủy sản “Probiotic là thành phần bổ sung có nguồn gốc vi sinh vật sống, có ảnh hưởng có lợi đối với vật chủ bằng