- Nghiệm thức đối chứng (ĐC): không sử dụng vi khuẩn.
Chuẩn bị 4 bể loại 50 L để làm bể lọc cho mỗi nghiệm thức riêng biệt và 12 bể 100 L để làm bể ương. Nước được pha có nồng độ muối là 30 ‰, tiệt trùng bằng chlorine nồng độ 80 ppm, sục khí mạnh và liên tục trong 48 giờ, sau đó để lắng 2 ngày cuối cùng lọc lại trước khi đưa vào bể ương. Nước chuẩn bị đưa vào bể ương cần phải kiểm tra nồng độ chlorine, pH. Nếu còn chlorine thì trung hòa bằng thiosulfate natri (Na2SiO3).
Giá thể được sử dụng cho lọc sinh học là hạt xốp tròn đường kính 4 mm, các hạt xốp được đựng trong túi bằng lưới cước đặt trong bể lọc, thể tích lọc chiếm 15% thể tích bể ương. Dụng cụ được xử lý với chlorine 80 ppm trước khi sử dụng.
Sau khi vệ sinh và hệ thống lọc được lắp xong vận hành hệ thống lọc cho qua bể ương ở giai đoạn Mysis 2.
Vi khuẩn Nitrobacter, Nitrosomonas được cấy vào bể lọc với mật độ 104 CFU/mL, Bacillus được cho vào bể ương với các mật độ khác nhau ở các nghiệm thức khác nhau.
Ấu trùng tôm ở giai đoạn Nauplii được xử lý bằng formol 25 ppm trong 5 phút, bố trí vào bể ương với mật độ 150 ấu trùng/L. Cho ấu trùng ăn theo chế độ cho ăn ở phụ lục B1.
Mẫu được thu 3 ngày/lần với các chỉ tiêu bao gồm: pH, nhiệt độ, DO, COD, NO2_ , NO3_, TAN, TN, TP, TSS, H2S và mật độ vi khuẩn (thu nước và thu giá thể). Thí nghiệm kết thúc khi ấu trùng chuyển sang giai đoạn PL7.
Thí nghiệm 2: Xác định khả năng chuyển hóa đạm của 3 dòng vi khuẩn Bacillus, Nitrobacter, Nitrosomonas trong hệ thống ương tôm sú thay nước.
Thí nghiệm này gồm 3 nghiệm thức với các mật độ vi khuẩn khác nhau và nghiệm thức đối chứng, mỗi nghiệm thức lặp lại 3 lần.
- Nghiệm thức 1 (NT1): cho vào mỗi bể 104 CFU/mL Nitrosomonas, 104 CFU/mL Nitrobacter và 104 CFU/mL Bacillus.
- Nghiệm thức 2 (NT2): cho vào mỗi bể 104 CFU/mL Nitrosomonas, 104 CFU/mL Nitrobacter và 105 CFU/mL Bacillus.
- Nghiệm thức 3 (NT3): cho vào mỗi bể 104 CFU/mL Nitrosomonas, 104 CFU/mL Nitrobacter và 106 CFU/mL Bacillus.
- Nghiệm thức đối chứng (ĐC): không sử dụng vi khuẩn.
Mức nước ban đầu 50% thể tích bể ương. Trong quá trình ương nuôi không thay nước trong giai đoạn nauplius. Giai đoạn zoea cấp thêm 10% mỗi ngày. Từ giai đoạn mysis trở đi thay nước hàng ngày 20%. Đáy bể được hút cặn hằng ngày trước khi thay nước. Sau khi cấp nước mới vào vi khuẩn sẽ được bổ sung với lượng tương ứng.
Bể loại 100 L được chuẩn bị để ương tôm (12 cái), nước được pha có nồng độ muối là 30‰, tiệt trùng bằng chlorine nồng độ 80 ppm. Trước khi đưa vào bể ương cần phải kiểm tra nồng độ chlorine, pH.
Sử dụng hạt xốp tròn đường kính 4 mm, các hạt xốp này được cho vào túi làm bằng lưới cước đặt vào bể ương để làm giá thể cho vi khuẩn bám, lượng giá thể cho vào chiếm 5% thể tích bể ương.
Vi khuẩn được cấy vào bể ương sau khi bố trí ấu trùng. Vi khuẩn Nitrobacter, Nitrosomonas được cấy vào với mật độ 104 CFU/mL, Bacillus được cho vào bể ương với các mật độ khác nhau ở các nghiệm thức khác nhau.
Ấu trùng tôm ở giai đoạn Nauplii được xử lý bằng formol 25 ppm trong 5 phút, bố trí vào bể ương với mật độ 150 ấu trùng/L. Chế độ cho ấu trùng ăn áp dụng ở phụ lục B1.
Mẫu chất lượng nước và mẫu vi khuẩn được thu tương tự thí nghiệm 1.
Thí nghiệm kết thúc khi ấu trùng chuyển sang giai đoạn PL7.
Thí nghiệm 3: Đánh giá hiệu quả xử lý ở các tỷ lệ thể tích bể lọc khác nhau trong hệ thống lọc tuần hoàn
Ở thí nghiệm này, giá thể là đá mài được bố trí vào bể lọc với các tỷ lệ thể tích khác nhau so với thể tích bể ương, bể lọc được bố trí dạng lọc ướt. Vi khuẩn được cho vào với mật độ như nhau ở các nghiệm thức 1, 2 và 3 gồm: Nitrobacter, Nitrosomonas cấy vào với mật độ 104 CFU/mL, Bacillus 105 CFU/mL, đây là mật độ vi khuẩn cho hiệu quả xử lý nước cao nhất trong thí nghiệm 1. Bể lọc ở
nghiệm thức đối chứng được bổ sung NH4Cl với lượng 0,1 mg/L và vận hành một tuần trước khi cho thông với bể ương. Thức ăn tôm được cho vào theo phụ lục B2 đều nhau ở tất cả các nghiệm thức để tạo nguồn dinh dưỡng cho vi khuẩn sử dụng (không bố trí tôm vào các bể ương). Mỗi nghiệm thức lặp lại 3 lần.
- Nghiệm thức 1 (NT1): thể tích bể lọc bằng 5% thể tích bể ương, bổ sung vi khuẩn.
- Nghiệm thức 2 (NT2): thể tích bể lọc bằng 10% thể tích bể ương, bổ sung vi khuẩn.
- Nghiệm thức 3 (NT3): thể tích bể lọc bằng 15% thể tích bể ương, bổ sung vi khuẩn.
- Nghiệm thức đối chứng (ĐC): thể tích bể lọc bằng 15% thể tích bể ương, không bổ sung vi khuẩn.

Hình 3.1: Hệ thống bể thí nghiệm với tỷ lệ thể tích bể lọc khác nhau
Các chỉ tiêu chất lượng nước như: pH, nhiệt độ đo mỗi ngày; DO, COD, NO3_, NO2-, TAN, TN, thu 2 ngày/lần và mật độ vi khuẩn (thu nước và thu giá thể) thu 3 ngày/ lần. Thí nghiệm kết thúc sau 21 ngày.
3.2.2 Phương pháp nuôi tăng sinh vi khuẩn
Các dòng vi khuẩn Bacillus, Nitrosomonas và Nitrobacter có nguồn gốc phân lập từ bùn đáy ao nuôi tôm sú thâm canh tại Huyện Vĩnh Châu – Tỉnh Sóc Trăng đã được chọn lọc.
* Nuôi tăng sinh vi khuẩn Bacillus
Môi trường nuôi tăng sinh là môi trường Luria Bertani (LB) (phụ lục A6). Vi khuẩn Bacillus được cho vào bình tam giác chứa môi trường LB, các bình tam giác được gắn sục khí, để ở nhiệt độ 300C trong vòng 24 - 48 giờ.
Sau khi nuôi tăng sinh mật độ vi khuẩn được xác định bằng 2 phương
pháp.
- Phương pháp đếm trên đĩa thạch với môi trường chuyên biệt cho giống
Bacillus (phụ lục A5).
- Phương pháp đo OD: sau khi nuôi tăng sinh sử dụng máy đo quang phổ tại bước sóng 600 nm để xác định giá trị OD. Mẫu đối chứng không có vi khuẩn được đo đầu tiên và có giá trị bằng 0. Dung dịch huyền phù vi khuẩn cần đo sẽ có giá trị OD trong khoảng 0,125-1,25. Theo tiêu chuẩn Mac Farland giá trị OD bằng 1 tương ứng mật độ vi khuẩn 1,2x109 CFU/mL.
Mật độ vi khuẩn được tính theo công thức:
Giá Trị OD600 | 0,125 | 0,250 | 0,500 | 0,750 | 1,000 | 1,250 |
Mật Độ Vi Khuẩn (106 CFU/mL) | 150 | 300 | 600 | 900 | 1200 | 1500 |
Có thể bạn quan tâm!
-
 Đánh giá khả năng cải thiện chất lượng nước của nhóm vi khuẩn chuyển hóa đạm trong hệ thống ương tôm sú (penaeus monodon) - 1
Đánh giá khả năng cải thiện chất lượng nước của nhóm vi khuẩn chuyển hóa đạm trong hệ thống ương tôm sú (penaeus monodon) - 1 -
 Đánh giá khả năng cải thiện chất lượng nước của nhóm vi khuẩn chuyển hóa đạm trong hệ thống ương tôm sú (penaeus monodon) - 2
Đánh giá khả năng cải thiện chất lượng nước của nhóm vi khuẩn chuyển hóa đạm trong hệ thống ương tôm sú (penaeus monodon) - 2 -
 Tình Hình Nghiên Cứu Và Sử Dụng Chế Phẩm Sinh Học Trong Nuôi Trồng Thủy Sản
Tình Hình Nghiên Cứu Và Sử Dụng Chế Phẩm Sinh Học Trong Nuôi Trồng Thủy Sản -
 Xác Định Khả Năng Chuyển Hóa Đạm Của 3 Dòng Vi Khuẩn Bacillus, Nitrobacter, Nitrosomonas Trong Hệ Thống Ương Tôm Sú
Xác Định Khả Năng Chuyển Hóa Đạm Của 3 Dòng Vi Khuẩn Bacillus, Nitrobacter, Nitrosomonas Trong Hệ Thống Ương Tôm Sú -
 Biến Động Hàm Lượng Tan Trong Hệ Thống Tuần Hoàn
Biến Động Hàm Lượng Tan Trong Hệ Thống Tuần Hoàn -
 Biến Động Mật Độ Vi Khuẩn Vibrio Trong Hệ Thống Thay Nước
Biến Động Mật Độ Vi Khuẩn Vibrio Trong Hệ Thống Thay Nước
Xem toàn bộ 88 trang tài liệu này.
Mật độ vi khuẩn (CFU/mL) = 1200*106*OD*Độ pha loãng Bảng 3.1: Giá trị OD600nm.
* Nuôi tăng sinh vi khuẩn Nitrosomonas và Nitrobacter
Hai dòng vi khuẩn này được nuôi trong môi trường chuyên biệt ở phụ lục A3 và A4. Các bình tam giác nuôi tăng sinh vi khuẩn Nitrosomonas và Nitrobacter được bọc kín bằng giấy bạc để tránh ánh sáng và được đặt trên máy
lắc khoảng một tuần trước khi bố trí thí nghiệm. Sau đó dùng phương pháp OD để
xác định mật độ vi khuẩn cấy vào bể thí nghiệm.
3.2.3 Phương pháp thu và phân tích mẫu vi khuẩn (Huys, 2002).
3.2.3.1 Chuẩn bị trước khi thu mẫu
- Các ống falcon, ống nghiệm được tiệt trùng để thu mẫu.
- Các ống nghiệm chứa 9 ml nước muối sinh lý 0,85% tiệt trùng ở 1210C trong 15 - 20 phút.
- Môi trường NA + 1,5% muối NaCl, TCBS ((Thiosulphate Citrate Bile Sucrose Agar)) và môi trường chuyên biệt cho Bacillus, Nitrobacter và Nitrosomonas.
3.2.3.2 Phương pháp thu mẫu
- Mẫu nước được thu bằng ống falcon tiệt trùng, thu mẫu cách mặt nước 20 – 30 cm. Sau đó trữ lạnh ngay ở 40C và tiến hành phân tích trong vòng 2 giờ.
- Mẫu giá thể được thu ở trong bể lọc và trong bể ương, mỗi bể thu 10 g hạt xốp (dùng làm giá thể) cho vào ống falcon tiệt trùng và trữ lạnh ngay ở 40C và tiến hành phân tích trong vòng 2 giờ.
3.2.3.3 Phương pháp xác định mật độ vi khuẩn Bacillus và vi khuẩn Vibrio
* Cách pha loãng mẫu:
Các ống nghiệm chứa 9 ml nước muối sinh lý (0,85%) đã tiệt trùng ở
121ºC trong 20 phút được chuẩn bị sẵn để pha loãng mẫu.
Tại phòng thí nghiệm, mẫu nước được lấy ra khỏi tủ mát, để nhiệt độ phòng. Dụng cụ chứa mẫu được mở nắp trong tủ cấy tiệt trùng, chuyển 1ml mẫu nước từ mỗi bể sang các ống nghiệm chứa 9 ml nước muối sinh lý đã tiệt trùng, trộn đều bằng máy 1 phút. Được mẫu có độ pha loãng 10-1. Từ mẫu này chuyển 1 ml dung dịch sang ống nghiệm khác chứa 9 ml nước muối sinh lý được độ pha loãng 10-2. Tiếp tục pha loãng theo cách này đến khi đạt được độ pha loãng thích hợp, bắt đầu từ độ pha loãng 10-2.
* Xác định mật độ vi khuẩn Bacillus:
Tất cả các ống nghiệm vừa pha loãng được sấy ở 800C trong 30 phút rồi lấy ống nghiệm ra để nguội.
Sau đó dùng micropipete hút 100µL dung dịch vi khuẩn cho vào các đĩa chứa môi trường chuyên biệt cho giống Bacillus, rồi dùng que thuỷ tinh tán đều đến khi mẫu khô. Ủ ở 280C trong 24 – 48 giờ. Mỗi mẫu nước cần chọn 2 độ pha loãng khác nhau, mỗi độ pha loãng lập lại 3 lần.
Sau khi ủ kiểm tra môi trường nuôi cấy để xác định số khuẩn lạc dao động từ 20 đến 200. Số khuẩn lạc tổng cộng được đếm trên những đĩa petri có số khuẩn lạc > 20 và < 200 và được tính bằng đơn vị hình thành khuẩn lạc/mL nước.
* Xác định mật độ vi khuẩn Vibrio:
Dùng micropipete hút 100µL dung dịch vi khuẩn cho vào các đĩa chứa môi trường TCBS chuyên biệt cho giống Vibrio, dùng que thuỷ tinh tán đều đến khi mẫu khô. Ủ ở 280C trong 24 – 48 giờ. Mỗi mẫu nước cần chọn 2 độ pha loãng khác nhau, mỗi độ pha loãng lập lại 3 lần.
Sau khi ủ kiểm tra môi trường nuôi cấy để xác định số khuẩn lạc dao động từ 20 đến 200. Số khuẩn lạc tổng cộng được đếm trên những đĩa petri có số khuẩn lạc > 20 và < 200 và được tính bằng đơn vị hình thành khuẩn lạc/mL nước.
* Công thức tính mật độ vi khuẩn:
Số tế bào/mL (CFU/ mL) = số khuẩn lạc × độ pha loãng × 10
3.2.3.4 Phương pháp xác định mật số vi khuẩn Nitrosomonas và Nitrobacter theo phương pháp đếm số lượng có khả năng nhất (MPN) (Pickering, 1975)
* Môi trường ammonium-calcium-carbonate được chuẩn bị cho
Nitrosomonas (Phụ lục A1).
Các ống nghiệm chứa 5 mL môi trường này được autoclave ở 1210C trong 20 phút để nuôi vi khuẩn.
* Môi trường nitrite-calcium-carbonate được chuẩn bị cho Nitrobacter
(Phụ lục A2)
Các ống nghiệm chứa 5 mL môi trường này được autoclave ở 1210C trong 20 phút để nuôi vi khuẩn.
* Pha loãng mẫu giá thể:
Tại phòng thí nghiệm mẫu hạt xốp được lấy ra khỏi tủ mát, để ở nhiệt độ phòng. Mở nắp dụng cụ chứa mẫu trong tủ cấy tiệt trùng, chuyển 1 g mẫu ống nhựa từ ống falcon các ống nghiệm chứa 9ml nước muối sinh lý đã tiệt trùng, trộn đều bằng máy 1 phút. Ta được mẫu có độ pha loãng 10-1. Từ mẫu này để yên cho lắng 30 giây chuyển 1ml dung dịch ở phần giữa ống nghiệm sang ống nghiệm khác chứa 9ml nước muối sinh lý được độ pha loãng 10-2. Tiếp tục pha loãng theo cách này đến khi đạt được độ pha loãng thích hợp, bắt đầu từ độ pha loãng 10-2 chỉ lắc 30 giây và để lắng 15 giây.
Mỗi bể chuẩn bị 9 ống nghiệm chứa môi trường ammonium – carbonate - calcium và 9 ống nghiệm chứa môi trường nitrite – calcium – carbonate, chuyển 1 mL dung dịch huyền phù vi khuẩn ở 3 độ pha loãng thích hợp cho vào các ống nghiệm chứa môi trường trên, mỗi độ pha loãng lặp lại 3 lần.
Mỗi môi trường lấy 3 ống nghiệm, các ống nghiệm này chỉ chứa môi trường nuôi không cho dung dịch vi khuẩn vào để làm đối chứng âm.
Các ống nghiệm chứa dung dịch huyền phù vi khuẩn và các ống đối chứng âm này được ủ ở 280C khoảng 21 ngày.
Sau khi ủ, sự có mặt của NO2- ở các ống nghiệm chứa dung dịch chứa huyền phù vi khuẩn và các ống đối chứng âm được kiểm tra bằng thuốc thử Griess – Ilosway (Phụ lục A7). Trộn lẫn các phần đều nhau của thuốc thử dung dịch A, B, C, sau đó thêm vài giọt huyền phù vi khuẩn từ mỗi ống. Quan sát sự phát triển màu đỏ hồng trong 5 phút.
* Xác định dương tính đối với nhóm AOB (vi khuẩn oxy hóa ammonium):
Các ống chứa dung dịch huyền phù vi khuẩn của môi trường ammonium – calcium – carbonate sẽ xuất hiện màu đỏ hồng trong 5 phút khi có mặt NO2-. Phản ứng màu chứng tỏ có sự hiện diện của nhóm AOB.
Trong trường hợp các ống nghiệm này không xuất hiện màu đỏ hồng trong 5 phút thì cho một lượng nhỏ hỗn hợp Zn – Cu – MnO2, nếu có màu đỏ xuất hiện cho thấy sự có mặt của nhóm AOB bởi vì kết quả âm tính đối với NO2- ở phản
ứng đầu cho thấy NO2- được hình thành bởi nhóm AOB đã bị oxy hóa thành NO3-
bởi nhóm NOB.
* Xác định dương tính đối với nhóm NOB (vi khuẩn oxy hóa nitrite):
Các dung dịch chứa huyền phù vi khuẩn của môi trường nitrite – calcium – carbonat không xuất hiện màu đỏ hồng sau khi phản ứng với thuốc thử Griess – Ilosway chứng tỏ không còn NO2- nữa do đã được chuyển toàn bộ thành NO3- bởi nhóm NOB.
Nếu các ống đối chứng âm cho kết quả dương tính sau khi nhỏ thuốc thử chứng tỏ môi trường đã bị nhiễm.
Số lượng ống nghiệm chứa dung dịch huyền phù vi khuẩn cho phản ứng dương tính được xác định bằng cách kiểm tra 3 độ pha loãng, kết quả từ 3 lần lặp lại của mỗi độ pha loãng được sử dụng để tính MPN. Cách chọn 3 độ pha loãng để xác định chỉ số MPN như sau: độ pha loãng đầu tiên là độ pha loãng cao nhất mà cả 3 lần lặp lại đều cho kết quả dương tính sau khi nhỏ thuốc thử, 2 độ pha loãng sau đó cao hơn.
ủ 28ºC 21 ngày
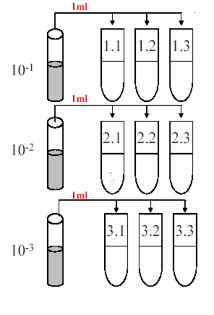
Hình 3.2: Cách xác định mật độ vi khuẩn theo phương pháp MPN
Sau khi kiểm tra ghi nhận các kết quả dương tính và âm tính từ các ống nghiệm. Tra cứu bảng MPN tiêu chuẩn (Phụ lục A8) để xác định số lượng có thể có của nhóm AOB và NOB trong 1 g mẫu giá thể.