- Năm 1922, Kotte (học trò của Haberlandt) và Robbins đã thành công trong việc lặp lại thí nghiệm của Haberlandt với đỉnh sinh trưởng tách từ rễ của một cây hoà thảo trong môi trường lỏng chứa muối khoáng và glucose. Tuy nhiên sự sinh trưởng chỉ tồn tại một thời gian, sau đó chậm dần và ngừng lại mặc dù tác giả chuyển qua môi trường mới.
- Năm 1934, White J.p thông báo nuôi cấy thành công trong một thời gian dài đầu rễ cà chua (Lycopersicum esculentum) trong môi trường lỏng chứa muối khoáng và glucose và nước chiết nấm men. Sau đó cũng chính White chứng minh có thể thay thế nước chiết nấm men bằng hổn hcrp loại vitamin B: Thiamin (Bl), Pyridoxin (B6), Nicotinic acid. Đồng thời trong thời gian này, R.J. Gautheret (ở Pháp) đã tiến hành nuôi cấy môi tượng tầng một số cây gỗ (cây liễu) khi đưa auxin vào môi trường nuôi cấy. Tuy nhiên sự sinh sản các tế bào đầu tiên không vượt quá 8 tháng.
- Năm 1939, Gautheret thông báo kết quả đầu tiên của ông với Viện Hàn Lâm Khoa Học Pháp về việc nuôi cấy các mô vô hạn của cây cà rốt (Daucus carote ).
Sau thế chiến thứ hai, lĩnh vực này đặc biệt phát triển nhanh và nhiều kết quả nghiên cứu quan trọng trong nông nghiệp đươc công bố.
2.2.3.2. Các kỹ thuật nhân giống in vitro
*Nhân giống bằng chồi nách
Chồi nách nhô từ vị trí bình thường trong nách lá mang đỉnh sinh trưởng phụ có khả năng mọc thành chồi giống như thân chính. Khi các mẫu cấy là chồi được giảm ưu thế ngọn sẽ dẫn tới sự tự sản xuất chồi nách ở mỗi lá hay ở cả nách lá.
Trong nhiều loại cây trồng, chồi nách xuất hiện tùy vào sự cung cấp cytokinin, chồi nách thường xuất hiện sớm và phát triển thành chồi bậc hai, bậc ba.......Khi các cụm chồi này phát triển chúng ta có thể phân tách để cấy chuyền trong môi trường mới.
Nói chung kỹ thuật tăng sinh bằng chồi nách được áp dụng cho bất kỳ cây cây trồng sản xuất chồi nách bình thường và phản ứng với cytokinin như: BAP, Zip & Zeatin (Mantell, Mathew & Mackee).
Có thể bạn quan tâm!
-
 Ảnh hưởng của các chất điểu hòa sinh trưởng đến quá trình nuôi cấy In Vitro của hai giống lan Dendrobium và Cymbidium - 1
Ảnh hưởng của các chất điểu hòa sinh trưởng đến quá trình nuôi cấy In Vitro của hai giống lan Dendrobium và Cymbidium - 1 -
 Ảnh hưởng của các chất điểu hòa sinh trưởng đến quá trình nuôi cấy In Vitro của hai giống lan Dendrobium và Cymbidium - 2
Ảnh hưởng của các chất điểu hòa sinh trưởng đến quá trình nuôi cấy In Vitro của hai giống lan Dendrobium và Cymbidium - 2 -
 Nội Dung 1: Trên Giống Lan Cymbidium.
Nội Dung 1: Trên Giống Lan Cymbidium. -
 Thí Nghiệm 1: Ảnh Hưởng Của Ba Và Naa Lên Quá Trình Nuôi Cấy In Vitro Của Giống Lan Cymbìdìum.
Thí Nghiệm 1: Ảnh Hưởng Của Ba Và Naa Lên Quá Trình Nuôi Cấy In Vitro Của Giống Lan Cymbìdìum. -
 Ảnh Hưởng Của Tdz Và Naa Đến Khả Năng Phát Sinh Phôi Soma, Tạo Protocorm Và Hình Thành Chồi
Ảnh Hưởng Của Tdz Và Naa Đến Khả Năng Phát Sinh Phôi Soma, Tạo Protocorm Và Hình Thành Chồi
Xem toàn bộ 88 trang tài liệu này.
*Nhân giống bằng chồi đỉnh
Sự thành công trong nuôi cấy đỉnh chồi thay đổi tùy theo mẫu cấy sử dụng và việc áp dụng kích thích tố riêng biệt. Kích thước đỉnh chồi nhỏ (0.1 mm - 0.5 mm)

thường khó cắt và cho tỉ lệ sống thấp, nhưng nó lại quan trọng trong việc phát triển nguyên liệu gốc sạch bệnh. Những kích thước đỉnh chồi từ 0.5 mm - 2 mm thì thông dụng hon và thích họp trong việc nhân giống (Hartmann & Kester, 1983).
Thường nuôi cấy đỉnh chồi trong môi trường có chứa auxin kết họp với cytokinin, nồng độ cytokinin sẽ tăng lên trong những lần cấy chuyền .
*Nhân giống bằng chồi bất định
Chồi bất định là một cấu trúc thân và lá mọc lên một cách tự nhiên trên mô cây trồng, ở vị trí khác với nách lá bình thường. Một số các nguyên liệu nuôi cấy gồm: lá, vẩy, cuống lá........
Mặc khác các chồi mới có thể phát triển gián tiếp từ callus hình thành trên mặt cắt của mẫu cấy. Chồi nhô lên từ ngoại biên của callus và không liên hệ trực tiếp tới mô mạch của mẫu cấy. Tuy nhiên chồi bất định có thể làm tăng tỉ lệ cây bị biến dị.
*Nhân giống qua nuôi cấy calỉus
Nuôi cấy mô hay tế bào sẽ sinh ra mô sẹo (qua sự cảm ứng phát sinh cơ quan hay phôi) là phương pháp nhân giống in vitro có khuynh hướng cho giá trị thấp. Nuôi cấy callus và tế bào đơn cho tần số biến dị cao hơn so với nuôi cấy chồi đỉnh.
*hân giống bằng các đoạn giả hành
Chọn những cây lan in vitro từ 5-6 tháng tuổi, sau đó cắt giả hành thành những đoạn có chiều dài khoảng 5mm và đem nuôi cấy trên những môi trường có bổ sung các chất điều hoà sinh trưởng.
*Nuôi cấy hạt lai:
Khi đã dự đoán kết quả của một phép lai, người ta mạnh dạn nhân giống hỗn họp giữa vô tính và hữu tính để rút ngắn thời gian và tạo một số lượng cây giống lớn.
*Dung họp tế bào trần:
Việc tạo giống vô tính theo các phương pháp lai tế bào đã được tiến hành ở
một số phòng thí nghiệm, còn gọi là phương pháp dung họp tế bào tràn.
Một hướng khác là gây đột biến trong ống nghiệm bằng các tác nhân vật lý và hóa học. Đây cũng là một hướng tạo giống hiện đại và tốn kém.
Đom giản hom, người ta có thể tạo ra những giống mới nhờ việc nhân cấy đỉnh sinh trưởng và tạo ra những điều kiện để gây ra những thay đổi đặc điểm di truyền của các tế bào cơ thể bình thường (đột biến soma) như: các dạng đột biến sinh lý, đa bội.
Trong việc nhân giống vô tính, nhược điểm lớn nhất là cây mẹ có thể bị
nhiễm các dạng bệnh virus. Nếu không được tuyển chọn và kiểm tra kỹ lưỡng sẽ cho ra đời hàng loạt cây con có chứa mầm bệnh.
2.2.3.3. Tiến trình nhân giống in vừro
Gồm các giai đoạn sau:
*Giai đoạn 1: Thiết lập sự nuôi cấy vô trùng
Giai đoạn này thường kéo dài từ 4 - 6 tuần, mẫu cấy mọc thành cây con cao khoảng lcm.
*Giai đoạn 2: Nhân giống vô tính in vừro
Mau cấy được cắt chia ra và cây mầm được cấy chuyền vào môi trường mới. Sự nhân giống này tuỳ thuộc vào việc tiếp tục sản xuất chồi nách hoặc từ những khối giống như callus ở gốc chồi.
*Giai đoạn 3: Chuyển cây ra vườn ưtfm
Cây con được tái sinh hoàn chỉnh chuẩn bị cho việc cấy trồng và môi trường bên ngoài được thiết lập để thuần hoá cây in vitro.
*Giai đoạn 4: trồng cây in vừro ngoài đồng ruộng
Cây con được tiếp tục nhân giống trên luống ươm và được cấy vào bàu đất rồi chuyển ra ừồng trên đồng ruộng.
2.2.3.4. Các yếu tố ảnh hưởng đến nhân giống in vừro
*Sự lựa chọn mẫu cấy
Mẩu cấy phải cạnh tranh sinh lý để sống sót trong môi trường nuôi cấy sơ khởi và tạo phản ứng thích họp. Mẩu cấy còn non sẽ tái sinh tốt hơn mẫu già.
Mầu thích họp nhất cho nuôi cấy mô phải có tỉ lệ mô phân sinh hiện diện hay những tế bào có khả năng biểu hiện tính toàn năng.
*Môi trường nuôi cấy
Thông thường là môi trường Murashige & Skoog là thích họp cho phần lớn các trường họp. Để hình thành chồi nách yêu cầu nồng độ thấp của auxin và cytokinin, để phát khởi chồi bất định cần nồng độ cao của cytokinin và thêm một lượng auxin cân bằng. Để sản xuất callus cần nồng độ cao của auxin kết họp với nồng độ thấp cytokinin. Ngoài ra đối với vài loại cây trồng còn bổ sung GA3 ngoại sinh o.lmg/l cho
sự phát triển bình thường và nhân giống in vitro.
Sự lựa chọn môi trường agar hay môi trường lỏng là càn thiết, agar làm giá đỡ cho cây nhưng cây trồng khó hấp thu tốt các dưỡng chất.
*Điều kiện nuôi cấy Ánh sáng
Mẩu cấy được đặt trên môi trường nuôi cấy là đường, đường đi vào quang tổng họp cho cây ừồng. Tuy nhiên nhiều nghiên cứu cho thấy ánh sáng hấp thu đóng vai trò trong quá trình tạo hình cây nuôi cấy mô.
Thường nuôi cấy ở 2000-3000 lux là tốt nhất.
Nhiệt độ
Ngoài ánh sáng, yếu tố môi trường khác có ảnh hưởng rõ ràng là nhiệt độ.
Hầu hết nuôi cấy thích họp ở nhiệt độ 20- 25°c.
Môi trường in vừro
Môi trường in vitro là môi trường trên và dưới mặt thạch trong bình nuôi cấy có ảnh hưởng đến sự sinh trưởng và phát triển hình thái của cây. Một số vấn đề thường gặp trong môi trường in vitro như: mức độ quang hợp thấp, không cân bằng
CO2, mức độ hấp thu và vận chuyển các chất dinh dưỡng thấp. Vì vậy cây con in vitro chậm phát triển.
*Chất kích thích sinh trưởng
- Auxin
- Cytokinin
- Gibberellins
- ABA
- Ethylen
2.2.3.5. ứng dụng của kỹ thuật nuôi cấy mô
Nhân giống các loại cây cảnh là ứng dụng phổ biến nhất trong kỹ thuật nuôi cấy mô. Hiện nay tất cả lan thưomg mại đều sản xuất bằng cách này. Ngoài ra còn có:
Dương Xỉ, Cẩm Chướng (Sone, 1968), Cúc (Ever&Holt, 1974), Petunia (Stone, 1968) và Hồng (Hasegana, 1979).
Theo Bajai (1968) một số cây trồng sản xuất qua nuôi cấy mô đã được tiêu thụ
trên thị trường với giá hành triệu dollas. Kỹ thuật nuôi cấy mô thực vật bậc cao để cải thiện cây ừồng bao gồm những ứng dụng:
- Nhân giống vô tính với tốc độ nhanh.
- Tạo cây trồng sạch bệnh và kháng bệnh.
- Cảm ứng và tuyển lựa dòng đột biến.
- Sản xuất cây đơn bội qua nuôi cấy túi phấn.
- Lai xa qua môi trường nuôi cấy phôi và noãn.
- Tạo dòng lai xa soma và lai tế bào trần (protoplast).
- Cố định nitrogen.
- Cải thiện hiệu quả quang tổng họp.
- Bảo quản các nguồn gen (Trần Thị Dung, 2001).
2.3. Vai trò các chất điều hoà sinh trưởng
Những hoá chất có khả năng điều khiển được sinh trưởng và phát dục của cây trồng được gọi là chất kích thích sinh trưởng hay chất điều hòa sinh trưởng.
Với một lượng cực kỳ nhỏ nhưng hiệu quả vô cùng to lớn trong các giai đoạn khác nhau như: sự phát sinh cơ thể, sự kích dục....Các chất điều hòa sinh trưởng là một trong những hoá chất không thể thiếu được trong đời sống thực vật mặc dù cho đến nay cơ chế tác dụng của nó vẫn chưa được lý giải rõ ràng.
2.3.1. Auxin
2.3.1.1. Lịch sử phát hiện ra auxỉn
Năm 1880, Darwin phát hiện ra rằng bao lá mầm (coleoptyl) của cây họ lúa rất nhậy cảm với ánh sáng và ông cho rằng đỉnh ngọn bao lá mầm là nơi tiếp nhận kích thích của ánh sáng.
Paal (1919) đã cắt đỉnh bao lá mầm và đặt trở lại trên chỗ cắt nhưng lệch qua một bên và để trong tối. Hiện tượng uốn cong (hướng động) xảy ra như một trường họp chiếu sáng một chiều. Ông kết luận rằng đỉnh ngọn đã hình thành một chất kích thích sinh trưởng nào đó và ánh sáng xác định sự phân bố của chất đó về hai phía của bao lá mầm.
Went (1928) đã đặt đỉnh ngọn tách ròi của bao lá mầm đó lên các bản agar để các chất sinh trưởng nào đấy khuyếch đại xuống agar, thì cũng gây ra hiện tượng sinh
trưởng uốn cong như thí nghiệm của Paal. Rõ ràng một chất sinh trưởng nào đấy được tổng họp trong bao lá mầm và đã khuyếch tán xuống agar và gây ra sự sinh trưởng hướng động đó. Went gọi chất đó là chất điều hòa sinh trưởng hiện nay là auxin.
Năm 1934, Kogl và ctv đã tách một chất từ dịch chiết nấm men có hoạt chất như chất sinh trưởng và Thimann (1935) cũng tách được chất này từ nấm Rhysopus. Người ta gọi chất đỏ là p - axit indolaxetic (AIA).
Tiếp đó Wightman (1977) đã phát hiện ra một họp chất auxin là axit phenyaxetic (APA).
Ngày nay bằng con đường hoá học người ta đã tổng họp được nhiều họp chất auxin khác nhau bao gồm: IAA (Indolacetic acid), IBA (Indolbultyric acid), NAA (Napthtalene acetic acid), 2,4D (Dichlophenoxy acetic acid) (Vũ Văn Vụ, 2000)
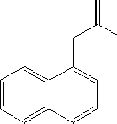
2.3.I.2. Giới thiệu về NAA
Tên khoa học: Naphthaleneacetic acid; Alpha-naphthaleneacetic acid; a- naphthaleneacetic acid; Naphthalene acetic acid; NAA; NAA; Naphthalene-l-acetic acid; 1-Naphthalene acetic acid; 1-Naphthylacetic acid.
Trọng lượng phân tử: 186.21.
Công thức cấu tạo: Ci2H10O2.
□
2.3.1.3. Vai trò của auxins
- Kích thích sự giãn tế bào.
- Kích thích tế bào phân chia (kết họp với cytokinin).
- Kích thích sự phân hoá của libe và mô gỗ.
- Kích thích sự phát triển của rễ.
- Auxin gây ra tính hướng động của cây.
- ức chế sự lớn lên của chồi bên.
Trì hoãn sự hoá già của lá.
- Làm chậm sự chín của trái.
- Kích thích sự lớn lên các phần của hoa.
2.3.2. Cytokinin
2.3.2.1. Lịch sử phát hiện ra cytokinin
Năm 1913, Haberlandt trích từ tế bào nhu mô cây cà, tế bào nhu mô khoai tây một chất có thể làm tăng sự phân chia tế bào nhu mô lõi.
Năm 1938, Bonner trích từ trái đậu một chất làm tăng trưởng tế bào của trái này và được gọi là cytokinin.
Năm 1941, Van Overbeek cấy phôi cà rốt Ratura ừong một môi trường nuôi phôi như nước dừa và có ảnh hưởng quan trọng để nuôi mô và tạo bướu.
Năm 1954, Steward và Shantz phân tích được trong nước dừa một chất quan trọng là diphenylurea.
Năm 1955, Skoog ghi nhận khi nuôi cấy mô thuốc lá và đã chứng tỏ rằng nước dừa cỏ sự phân bào.
Tiếp đó Miller (1959) đã chiết tách chất này. Đây cũng là chất kích thích chủ yếu trong môi trường nuôi cấy mô ở lan.
Ngày nay bằng con đường hoá học người ta đã tổng họp nhiều loại cytokinin, cytokinin thường gặp nhất là: Kinetin (6 Furfưril aminopurin), BA (6-Benzyl aminopurine). Tuy nhiên hiện nay nhiều nghiên cứu sử dụng TDZ, chất điều hoà tăng trưởng thuộc nhóm cytokinin, có hoạt tính mạnh nhằm mục đích cảm ứng tạo phôi vô tính (Mai Trần Ngọc Tiếng, 2001).
2.3.2.2. Giới thiệu BA
Tên khoa học: N-benzyl-Adenine, N6-Benzyladenine, benzylaminopurine, N- (phenylmethyl)-lH-purin-6-amine, Benzyladenine, Cytokinin B, Purin-6-amine, N- (phenylmethyl), Verdan senescence inhibitor, 6BA.
Trọng lượng phân tử: 225.25. Công thức cấu tạo: Ci2HnN5.
HN- -ự ^ N
7 =/
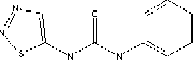
23.23. Giới thiệu về TDZ
Tên khoa học: 5-Phenylcarbamoylamino-l,2,3-thiadiazole, Phenyl-3-(l,2,3- thiadiazol-5-yl)urea, N-phenyl-N'-l,2,3-thiadiazol-5-yl-urea, Dropp Trọng lượng phân tử: 220.25.
Công thức cấu tạo: C9H8N4OS.
H H
2.3.2.4. Vai trò của cytokỉnỉn
- Kích thích sự phân chia tế bào.
- Kích thích sự hình thành hoa.
- Phá vỡ trạng thái ngủ nghỉ của hạt và một số cơ quan khác.
- Kích thích sự tăng cường tống họp ADN và ARN trong tế bào.
- Điều tiết quá trình sinh tổng họp protein trong tế bào.
2.4. Những nghiên cứu về nuôi cấy in vừro trên 2 giống lan
Dendrobium và Cymbidìum
2.4.1. Giống lan Cymbidium
Cymbidium ở Việt Nam được trồng và nghiên cứu chủ yếu trên Đà Lạt, người
ta đã tạo ra hàng loạt loại
Cymbidium lai khác nhau như:
Cymbidium aloiýoliưm
Swartz (lan lô hội), Cymbidium cyperiýolium (thanh lan), Cymbidium dayanum Reichb. f (xích ngọc),......................và đã mang lại lợi nhuận kinh tế cao.
Việc lai tạo giống không ngừng ở việc thụ phấn, gieo hạt đơn giản mà còn dùng những kỹ thuật sinh học hiện đại để tạo ngiều giống đa bội. Cymbidium cũng là chi





