Tổng hàm lượng flavonoid là được tính theo đường cong chuẩn và được biểu thị bằng mg rutin đương lượng trên mỗi g dịch chiết hoặc phần (mg RE / g chiết xuất). [15]
Tính chất chống oxy hóa:
- Phương pháp 2,2-Diphenyl-1-picrylhydrazyl (DPPH)
Hoạt tính chống oxy hóa của chiết xuất và các phân đoạn cô lập được ước tính bởi phương pháp DPPH. [15]
Trộn hỗn hợp chứa 0,5 mL mỗi mẫu, 0,25 mL 0,5 nM DPPH, và 0,5 mL dung dịch đệm axetat 0,1 M (pH 5,5) được chuẩn bị và đặt trong bóng tối trong 30 phút ở điều kiện môi trường xung quanh.
Độ hấp thụ của phản ứng được ghi lại ở bước sóng 517 nm bằng cách sử dụng đầu đọc vi tấm (Máy quang phổ MultiskanTM Microplate, Thermo Fisher Scientific, Osaka, Nhật Bản).
Khả năng chống oxy hóa của các mẫu thử nghiệm được tính theo công thức sau:
Hoạt động chống gốc tự do DPPH (%) = [(C – S) / C] × 100 (trong đó S và C là độ hấp thụ tương ứng của phản ứng có mẫu và phản ứng không có mẫu.) Kết quả là được biểu thị bằng giá trị IC50, xác định nồng độ của mẫu cần thiết để quét 50% của DPPH. [15]
- Phương pháp 2,20-Azinobis (3-Ethylbenzothiazoline -6-sulfonic acid) (ABTS) Phương pháp ABTS được sử dụng để đánh giá đặc tính chống oxy hóa của C. hindsii.
- Thử nghiệm tẩy trắng β-Caroten
Có thể bạn quan tâm!
-
 Tổng quan về một số cây thuốc có tác dụng hỗ trợ điều trị bệnh ung thư - 1
Tổng quan về một số cây thuốc có tác dụng hỗ trợ điều trị bệnh ung thư - 1 -
 Tổng quan về một số cây thuốc có tác dụng hỗ trợ điều trị bệnh ung thư - 2
Tổng quan về một số cây thuốc có tác dụng hỗ trợ điều trị bệnh ung thư - 2 -
 Sản Phẩm Chứa Dược Liệu Trên (Nếu Có) Trong Nước:
Sản Phẩm Chứa Dược Liệu Trên (Nếu Có) Trong Nước: -
 Cây Thuốc Hỗ Trợ Điều Trị Bệnh Ung Thư Dạ Dày
Cây Thuốc Hỗ Trợ Điều Trị Bệnh Ung Thư Dạ Dày -
 Tác Dụng Dược Lý Đã Được Nghiên Cứu
Tác Dụng Dược Lý Đã Được Nghiên Cứu
Xem toàn bộ 133 trang tài liệu này.
Phương pháp tẩy trắng β-caroten được sử dụng để đánh giá hoạt tính chống oxy hóa của C. hindsii.
Xác định các thành phần hóa học bằng phương pháp sắc ký khí-khối phổ (GC-MS):
Các thành phần hóa học của các phân đoạn hoạt động được xác định bằng cách sử dụng hệ thống GC-MS (JMS-T100 GVC, JEOL Ltd., Tokyo, Japan), theo các phương pháp trước đây. [3,4]
Phân tích được tiến hành trong cột DB-5MS (30 m × 0,25 mm, dày 0,25
µm) sử dụng heli làm khí mang, được thực hiện với tỷ lệ phân chia 5: 1.
Nhiệt độ kim phun và đầu dò được duy trì ở 300 ◦C và 320 ◦C.
Nhiệt độ lò được thiết lập như sau: nhiệt độ bạn đầu 50 ◦C , tăng 10 ◦C / phút đến 300 ◦C, với thời gian giữ 20 phút.
Các mẫu được pha loãng trong MeOH, và thể tích tiêm của mỗi mẫu là 1
µL. Phạm vi khối lượng quét từ 29 amu đến 800 amu. [15]
Phân tích khối phổ-ion hóa tia điện tử (ESI-MS):
Các mẫu được phân tích bằng ESI-MS ở cả chế độ ion âm và dương.
Mao mạch nhiệt độ được đặt ở 140 ◦C (120 ◦C đối với S2) và điện áp phun là 3.0 KV (2.7 Kv đối với S2).
Bên trong chế độ tích cực, các phân tích hợp chất được thực hiện trong điện áp phun ion 3000 V và mao quản nhiệt độ 350 ◦C.
Các đỉnh được quét từ 280 đến 1000 m / z. [5]
Phân tích thống kê: Phân tích thống kê được thực hiện bằng cách sử dụng ANOVA một chiều, sự khác biệt đáng kể (p <0,05) trong số các mẫu thử nghiệm. Kết quả được biểu thị dưới dạng giá trị trung bình ± sai số tiêu chuẩn
Kết quả:
Hoạt động chống oxy hóa, Tổng hàm lượng Phenolic (TPC) và Tổng hàm lượng Flavonoid (TFC) của C. hindsii:
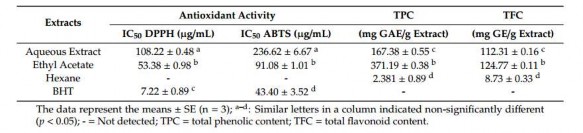
Dịch chiết EtOAC thu được lượng TPC và TFC tối đa lần lượt là 371,19 và 124,011 mg GE / g chiết xuất. Kết quả cho thấy TPC, TFC và hoạt tính chống oxy hóa của các chất chiết xuất được thử nghiệm đa dạng. Trong số các chất
chiết xuất, EtOAc có TPC cao nhất (371,19 mg GAE/g chiết xuất) và TFC (124,77 mg RE/g trích).
Tương tự, hoạt động chống oxy hóa của chiết xuất này cũng mạnh nhất (IC50 DPPH và ABTS tương ứng là 53,38 và 91,08 µg / mL) so với các chất chiết xuất khác, trong khi hexan chiết xuất không cho thấy bất kỳ hoạt động chống oxy hóa. Do hoạt động chống oxy hóa mạnh nhất của nó, EtOAc dịch chiết sau đó được tách bằng sắc ký cột bằng kỹ thuật rửa giải gradient. [15]
Bảng 1. Hoạt động chống oxy hóa, tổng hàm lượng phenolic và tổng hàm lượng flavonoid của các chất chiết
Tổng số Phenolic (TPC) và Tổng hàm lượng Flavonoid (TFC), và Hoạt động chống oxy hóa của các phần được phân tách từ EtOAc:
Nói chung, ngoại trừ P14, các phân số từ P9 – P13 cho thấy TPC và TFC lớn hơn đáng kể so với phân số P1-P8. Trong số này, TPC và TPC tối đa là quan sát thấy trên các phân đoạn P12-P12, trong đó độ pha loãng giữa chloroform và methanol nằm trong khoảng từ 50–70%. Khi tỷ lệ methanol <30% và> 90%, TPC và TFC đều giảm. Khả năng chống oxy hóa của các phần tỷ lệ tương ứng với lượng TPC và TFC. [15]
Bảng 2. Hàm lượng TPC, TFC và hoạt động chống oxy hóa của mười bốn phần được tách ra từ Chiết etOAc bằng sắc ký cột.
Kết quả chỉ ra rằng, độ pha loãng giữa chloroform và methanol mạnh ảnh hưởng đến tiềm năng chống oxy hóa của C. hindsii, được phản ánh bởi cả hoạt động chống oxy hóa của ABTS và DPPH qua các giá trị IC50.
Trong số các mẫu này, IC50 thấp hơn cho thấy chất chống oxy hóa mạnh hơn hoạt động. Các phân đoạn P1 – P4, P6 và P8 không cho thấy bất kỳ hoạt động chống oxy hóa nào và khi pha loãng methanol là 5%, chỉ quan sát thấy khả năng chống oxy hóa không đáng kể. Tuy nhiên, khi pha loãng methanol tăng lên> 10%, các hoạt động thu gom gốc ABTS và DPPH được tăng lên nhanh chóng.
Điện thế ABTS và DPPH tối đa được tìm thấy trong các phân đoạn P12 – P13, trong đó phần trăm methanol đã được tăng lên 50-70%. Tuy nhiên, khi độ pha loãng methanol vượt quá 70%, khả năng chống oxy hóa ngược lại đã giảm (Bảng 2). So sánh với BHT tiêu chuẩn, các phân số P12 – P13 có tiềm năng nhất, có thể chứa các thành phần hoạt động trong hoạt động chống oxy hóa, trong đó chất chống oxy hóa mức độ của các hợp chất riêng lẻ cần phân tích thêm.
Kết quả của thử nghiệm này cho thấy sự pha loãng methanol ở 50–70% kết hợp với cloroform cung cấp tiềm năng chống oxy hóa tối đa trong cả hoạt động thu dọn gốc ABTS và DPPH của cây thuốc C. hindsii. Ngược lại, khi metanol chiếm 90% dung dịch, cả hoạt động loại bỏ gốc DPPH và ABTS đều giảm nhanh chóng (Bảng 2).
Khả năng chống oxy hóa của C. hindsii cũng được đo bằng β-caroten phương pháp tẩy trắng, như trong Bảng 2. Hoạt tính chống oxy hóa được biểu thị bằng giá trị% LPI so với quá trình oxy hóa β-caroten. Hầu hết các phân đoạn từ dịch chiết etyl axetat đều có hoạt tính chống oxy hóa.
Giá trị LPI phần trăm của các phân đoạn EtOAc nằm trong khoảng từ 57% đến 90% (Bảng 2). Nó đã được quan sát rằng tất cả các dịch chiết được điều chế từ C. hindsii đều làm giảm quá trình oxy hóa của β-caroten, mặc dù mức độ sự ức chế khác nhau giữa các phân đoạn.
Trong số các phần cô lập, quá trình oxy hóa axit linoleic có hiệu quả bị ức chế bởi phân đoạn P12 (C: M = 1: 1; LPI = 90%), tiếp theo là phân đoạn P13 (98%) và P9 (87%). Những Các phân đoạn thể hiện mức độ chống oxy hóa gần với mức BHT tiêu chuẩn (Bảng 2). Kết quả này cho thấy C. hindsii có khả năng chống oxy hóa mạnh. [15]
Mối tương quan giữa hàm lượng phenolic và các hoạt động chống oxy
hóa:
Các mối quan hệ của hoạt động chống oxy hóa được chỉ ra bởi xét nghiệm DPPH hoặc ABTS với tổng số phenol của C. hindsii lần lượt được trình bày trong Hình 2.
H nh 2. Mối quan hệ giữa hoạt động chống oxy hóa và tổng số phenol
Kết quả cho thấy tổng số phenol tỷ lệ với hoạt động thu dọn gốc DPPH (r2 = 0,80) hoặc quét gốc ABTS (r2 = 0,62). Các phân đoạn có tổng hàm lượng phenolic cao có khả năng chống oxy hóa cao trong cả hai xét nghiệm DPPH và ABTS.
Xác định các hợp chất hoạt tính sinh học bằng GC-MS và ESI-MS:
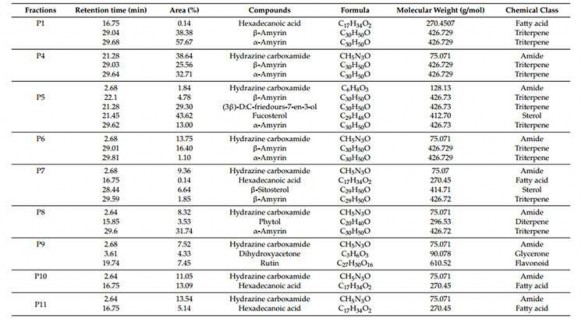
Các phân đoạn hoạt tính sinh học bao gồm P1, P4 – P14 được phân tích bởi GC-MS và ESI-MS để tiết lộ sự hiện diện của các hợp chất chính, bao gồm axit hexadecanoic, α-amyrin, β-amyrin, hydrazine carboxamide, (3β) -D: C- Friedours-7-en-3-ol, fucosterol, β-sitosterol, phytol, dihydroxyacetone, rutin, glycerin, 2′-hydroxyacetophenone và 2-hydroxy-1-ethyl ester (Bảng 3).
Diện tích đỉnh (%) được sử dụng để so sánh nồng độ của các hợp chất được phát hiện trong mỗi phần. Người ta thấy rằng sự hiện diện và nồng độ của các thành phần được xác định là khác nhau giữa các phần P1 và P4–P14.
Trong số các phân đoạn này, cả α-amyrin và β-amyrin đều cho thấy nồng độ tối đa trong P1 và P4 (25,56–57,67%). β-amyrin trong P5 và P7 chiếm số lượng lớn hơn α-amyrin, tuy nhiên, α-amyrin chiếm 31,74% trong P8, trong khi không có dấu vết của β-amyrin được quan sát thấy trong phân số. Tuy nhiên, cả α-amyrin và β-amyrin đều không được phát hiện trong các phân đoạn P9 – P14 (Bảng 3).
Với ngoại trừ P1, hợp chất hydrazine carboxamide được tìm thấy trong tất cả các phân đoạn P4–14. Phân số P4 cho thấy nồng độ tối đa (38,64%), tiếp theo là P13 (21,43%), trong khi các phân đoạn khác cho thấy số lượng thấp hơn (1,84–13,75%) (Bảng 3).
Axit hexadecenoic chỉ được xác định trong P1, P10 và P11, trong đó P10 có số lượng nhiều hơn (13,09%). Các hợp chất chính khác bao gồm fucosterol
(43,62%, P5), (3β) -D: C-Friedours-7-en-3-ol (29,3%, P5), rutin (7,45%, 12,46%
và 7,43% trong P9, P10, và P13, tương ứng), và 2-hydroxy-1-etyl este (20,22%, P13) (Bảng 3). Các hóa chất được xác định khác chiếm số lượng thấp hơn nhiều (<5%).
Bảng 3. Thành phần hóa học trong các phân đoạn P1-P14
Trích dẫn từ: “ Phân đoạn toàn diện các chất chống oxy hóa và bằng phương pháp GC-MS và ESI-MS trong lá loài Celastrus hindsii”. Tran Duc Viet, Tran Dang Xuan, Truong Mai Van, Yusuf Andriana, Ramin Rayee, Hoang-Dung Tran (2019), Comprehensive Fractionation of Antioxidants and GC-MS and ESI-MS Fingerprints of Celastrus hindsii Leaves, Medicines, 6, pp. 64.
1.1.3. Về tác dụng sinh học
1.1.3.1. Tác dụng dược lý đã được nghiên cứu
Tác dụng chống khối u: Các hoạt chất Flavonoids, Triterpenoids, Polyphenols có tác dụng chống hình thành khối u, ức chế sự phát triển của tế bào ung thư và hạn chế sự di căn ung thư.
Tác dụng chống oxy hóa: Các hoạt chất của xạ đen đều có tác dụng chống gốc tự do và làm giảm tác hại của gốc tự do với các tế bào.
Hỗ trợ điều trị chữa bệnh xơ gan, viêm gan: Khoa học đã chứng minh cây xạ đen chữa bệnh viêm gan, xơ gan hoặc những người mắc các bệnh về gan rất tốt.
Hỗ trợ điều trị chứng mất ngủ: Người ta còn dùng xạ đen khô để giải nhiệt cơ thể, loại bỏ các loại độc tố ra khỏi cơ thể, tốt cho gan, giúp điều an thần, giảm đau và tăng cường sức đề kháng của cơ thể.
Hỗ trợ điều trị bệnh mụn nhọt, lở ngứa: Cây xạ đen có vị đắng chát, tính hàn, có tác dụng hữu hiệu trong hỗ trợ điều trị mụn nhọt, lở ngứa hiệu quả.
Hỗ trợ điều trị huyết áp cao
Hỗ trợ điều trị các bệnh viêm nhiễm Hỗ trợ điều trị tiểu đường
Hỗ trợ điều trị máu nhiễm mỡ [19]
1.1.3.2. Độc tính
C. hindsii chứa một số lượng lớn các chất chuyển hóa thứ cấp thể hiện một loạt các hoạt tính sinh học, được xác nhận là có độc tế bào mạnh chống lại nhiều tế bào ung thư. Việc nghiên cứu độc tính của chiết xuất lá C. hindsii được tiến hành trên chuột bạch với nhiều liều bắt đầu từ 1000, 3000, 5000 đến 15000 mg kgG1b.wt.





