- Kết hợp phương pháp nghiên định tính để làm rõ kết quả nghiên cứu định lượng : Thảo luận nhóm với 3 nhóm đối tượng, mỗi nhóm gồm 8 người.
Nhóm dân cư là CBCNV.
Nhóm dân cư làm nghề nông
Nhóm CB Bệnh viện Lao và Bệnh phổi
- Phỏng vấn sâu: Cán bộ xã sở tại và nhân viên y tế Bệnh viện Lao và Bệnh phổi.
2.2.4. .Các bước tiến hành một số kỹ thuật dùng trong nghiên cứu.
2.2.4.1. Phương pháp soi kính trực tiếp.
Chuẩn bị tiêu bản:
- Nhỏ một giọt dung dịch bệnh phẩm đã xử lý trên tiêu bản, sau đó dàn mỏng tiêu bản.
Có thể bạn quan tâm!
-
 Đường Xâm Nhập Của Vi Khuẩn Vào Cơ Thể.
Đường Xâm Nhập Của Vi Khuẩn Vào Cơ Thể. -
 Kiểm Soát Hành Chính Nhằm Làm Giảm Phơi Nhiễm Cho Nhân Viên, Bao Gồm:
Kiểm Soát Hành Chính Nhằm Làm Giảm Phơi Nhiễm Cho Nhân Viên, Bao Gồm: -
 Chọn Nhóm Nghiên Cứu: Chọn Mẫu Có Mục Đích Nhằm Xác Định Nguy Cơ Nhiễm Lao Của Cán Bộ Bệnh Viện Lao Và Bệnh Phổi Và Dân Cư Sống Xung Quanh Bệnh
Chọn Nhóm Nghiên Cứu: Chọn Mẫu Có Mục Đích Nhằm Xác Định Nguy Cơ Nhiễm Lao Của Cán Bộ Bệnh Viện Lao Và Bệnh Phổi Và Dân Cư Sống Xung Quanh Bệnh -
 Đặc Điểm Của Đối Tượng Nghiên Cứu Là Cán Bộ Bệnh Viện Lao Và Bệnh Phổi Thái Bình, Bệnh Viện Tâm Thần Thái Bình.
Đặc Điểm Của Đối Tượng Nghiên Cứu Là Cán Bộ Bệnh Viện Lao Và Bệnh Phổi Thái Bình, Bệnh Viện Tâm Thần Thái Bình. -
 Đặc Điểm Về Nghề Nghiệp Và Trình Độ Văn Hóa Của Dân Cư Hai Xã
Đặc Điểm Về Nghề Nghiệp Và Trình Độ Văn Hóa Của Dân Cư Hai Xã -
 Mối Liên Hệ Giữa Đường Kính Mantoux Và Năm Công Tác Của Cán Bộ Bệnh Viện Tâm Thần
Mối Liên Hệ Giữa Đường Kính Mantoux Và Năm Công Tác Của Cán Bộ Bệnh Viện Tâm Thần
Xem toàn bộ 126 trang tài liệu này.
- Hơ tiêu bản trên ngọn lửa đèn cồn ba lần khoảng từ 3 đến 5 giây để cố định tiêu bản.
Kỹ thuật nhuộm Ziehl - Neelsen
- Nhuộm: phủ dung dịch fuchsin phenic đã lọc trước lên đầy tiêu bản, hơ nóng
đến khi bốc hơi, để 5 phút. Rửa bằng nước đến khi thuốc nhuộm trôi hết
- Tẩy màu:
+ Tẩy lần 1: nhỏ dung dịch cồn acid lên đầy tiêu bản, để trong 3 phút, rửa nước cho sạch hết cồn.
+ Tẩy lần 2: nhỏ dung dịch cồn tẩy lên đầy tiêu bản, để 1-3 phút, đến khi không nhìn thấy màu, rử nước cho sạch hết cồn tẩy.
- Nhuộm nền:
+ Nhỏ dung dịch Xanh Methylen 0,3% (đã lọc) lên đầy tiêu bản, để
trong 60 giây
+ Rửa nước cho đến khi trôi hết thuốc nhuộm.
+ Để khô tiêu bản ở nhiệt độ phòng thí nghiệm.
Cách đọc kết quả khi soi kính:
- Soi kính hiển vi thường (vật kính dầu x 100, thị kính x 8)
- Đánh giá kết quả:
Số lượng AFB soi thấy Đọc kết quả
0/100 vi trường Âm
1-9/100 vi trường Ghi số lượng AFB 10-99/100 vi trường 1+
1-10/1 vi trường 2+
> 10/1 vi trường 3+
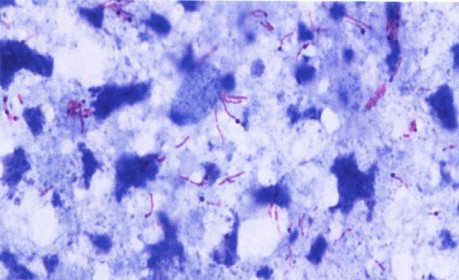
Ảnh 2.1: Vi khuẩn lao nhuộm Ziehl - Neelsen
2.2.4.2. Phương pháp nuôi cấy (tiến hành tại khoa Vi sinh, Bệnh viện Phổi Trung ương)
Dụng cụ và hóa chất
- Dung dịch Natri hydroxit (NaOH) 4%
- Nước muối sinh lý 0,9%
- Chất dinh dưỡng ODAC: Bovine abumin, Dextroza, Catalaza, acid oleic
- Hỗn hợp kháng sinh PANTA: Polymixin B, Amphotericin B, acid nalidixic, Trimethoprim, Azlocillin
- Dung dịch fuchsin phenic o,3%
- Dung dịch cồn acid 25%
- Dung dịch XanhMethylen
- Ống ly tâm 50ml
- Eppendorf 1,5ml
- Môi trường
Chuẩn bị bệnh phẩm
- Mẫu không khí (gelatin): cho mẫu vào một ống 50ml có nắp xoáy, thêm 03ml nước muối sinh lý, ngâm trong 15 phút, sau đó lắc cho đến khi tan hoàn toàn.
- Mẫu tăm bông: cho vào ống chứa mẫu 03ml nước muối sinh lý, ngâm 15 phút, lắc thật kỹ, sau đó dung pipette Pasteur hút hết dung dịch mẫu sang 1 ống 50ml vô khuẩn.
- Nước thải: cho 2,5ml nước muối sinh lý, 500µl nước thải sau xử lý vào 1 ống 50ml có nắp xoáy, ngâm 15 phút, lắc kỹ.
Xử lý bệnh phẩm
- Thêm 1 thể tích NaOH 4% bằng với thể tích bệnh phẩm đựng trong
ống nghiệm.
- Lắc trên máy lắc cho đến khi bệnh phẩm tan ra hoàn toàn. Để ống nghiệm đứng thẳng 15 phút ở 370C để khử tạp khuẩn.
- Thêm 40ml nước muối sinh lý, ly tâm 15 phút (3000 vòng/phút)
- Hút bỏ nước nổi, thu cặn.
- Thêm 01ml nước muối sinh lý, lắc kỹ. Dung dịch này để cấy vào môi trường Loeweinstein – Jensen, môi trường MGIT và nhuộm Ziehl – Neelsen để tìm vi khuẩn lao.
Nuôi cấy trên môi trường Loeweinstein – Jensen:
- Cấy vào môi trường:
+ Cấy vào môi trường Loeweinstein – Jensen mỗi ống 5 giọt cặn đã trung hòa, láng đều trên bề mặt của mỗi ống môi trường.
+ Để ống môi trường nằm nghiêng trên giá nằm.
+ Giữ ở nhiệt độ 35 – 370C (mở lỏng nắp 1 tuần để làm khô và cung cấp đủ
không khí cho nuôi cấy vì vi khuẩn lao là vi khuẩn hiếu khí).
+ Khi bề mặt môi trường đã khô, đóng chặt nắp tiếp tục ủ ấm từ 4-8 tuần.
- Đọc kết quả: sau 3 ngày, 7 ngày, 4 tuần và 8 tuần. Đọc sau 3 ngày để bỏ đi những ống nuôi cấy bị nhiễm trùng, sau 7 ngày để phát hiện khuẩn lạc mọc nhanh, sau 4 tuần để phát hiện khuẩn lạc mọc chậm, sau 8 tuần không thấy có khuẩn lạc mọc trên môi trường thì mẫu âm tính.
- Ghi kết quả:
+ Âm : không có khuẩn lạc.
+ 1+ : 1 – 200 khuẩn lạc, ghi số khuẩn lạc (ví dụ +12).
+ 2+ : ½ môi trường khuẩn lạc mọc dày không đếm được, tương ứng 200 – 500 khuẩn lạc.
+ 3+ : 3/4 môi trường khuẩn lạc mọc dày không đếm được, xấp xỉ 500 –
2000 khuẩn lạc.
+ 4+ : khuẩn lạc mọc dầy đặc toàn bộ ống môi trường, xấp xỉ 2000 khuẩn lạc.
- Khi nuôi cấy có khuẩn lạc mọc, làm phản ứng sinh vật hóa học để định danh vi khuẩn mọc trên môi trường (Niacin)
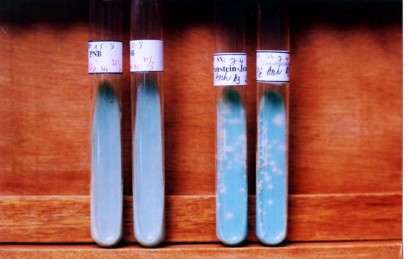
Ảnh 2.2: Nuôi cấy vi khuẩn lao trên môi trường Loeweinstein - Jensen
Nuôi cấy trên môi trường MGIT
+ Thêm 0,5ml ODAC (chất dinh dưỡng) và 0,1ml PANTA (hỗn hợp kháng sinh) vào ống môi trường MGIT.
+ Lấy 0,5ml bệnh phẩm đã xử lý cấy vào ống môi trường MGIT.
+ Đóng chặt nút, lắc trộn đều, giữ ở tủ ấm 370C.
Đọc và ghi kết quả:
+ Đọc kết quả hàng ngày bằng đèn cực tím có bước song 365 nm, bắt đầu từ ngày thứ 2 sau nuôi cấy.
+ Kết quả âm tính: ánh sáng huỳnh quang yếu hoặc không có (tiêp tục kiểm tra hàng ngày cho tới 8 tuần mới được kết luận âm tính).
+ Kết quả dương tính: ánh sáng có màu vàng da cam hoặc được phát hiện bởi
độ đục không đồng nhất hay những hạt nhỏ trong môi trường nuôi cấy.
+ Các mẫu dương tính được tiếp tục làm phản ứng vi sinh vật hóa học để định danh vi khuẩn (Niacin).

Ảnh 2.3: Nuôi cấy vi khuẩn lao trên môi trường MGIT
2.2.4.3. Thử nghiệm tích luỹ niacin để định danh vi khuẩn lao.
Nguyên lý: Tất cả các vi khuẩn đều có khả năng tổng hợp niacin, nhưng chúng cũng có enzyme chuyển hóa niacin thành niacin ribonucleotide, vi khuẩn lao không có enzyme chuyển hóa, nên sản phẩm này được tích lũy trong môi trường nuôi cấy và có thể phát hiện bằng phản ứng hóa học với cyanogienbromur khi có mặt của aniline sẽ tạo phức hợp màu vàng hoàng yến nhận biết được bằng mắt thường. Vì vậy xác định niacin tích lũy trong môi trường nuôi cấy là một thử nghiệm rất có giá trị để nhận biết vi khuẩn lao.
Dụng cụ và hóa chất:
- Anilin tinh khiết.
- Cyanogien bromide 10%.
- Dụng cụ vô khuẩn: ống nghiệm cỡ 12, Pipette Pasteur.
Các bước thực hiện:
- Nhỏ vào ống nuôi cấy dương tính (42 ngày) 1ml nước cất vô trùng. Để nước ở
một độ nghiêng sao cho nước phủ kín bề mặt nuôi cấy, giữ ở 370C trong 20 phút.
- Hút hết huyền dịch này cho vào một ống nghiệm vô trùng.
- Cho 5 giọt Anilin vào các ống phản ứng và ống chứng.
- Thêm 01ml cyanogiens bromide 10%, để 5 phút ở nhiệt độ phòng thí nghiệm.
Đọc kết quả:
- Phản ứng dương tính: có màu hoàng yến.
- Phản ứng âm tính: không có sự đổi màu.
- Chứng dương tính: chủng H37Rv.
- Chứng âm tính: chủng Mycobacteria avium.
2.2.4.4. Kỹ thuật PCR phát hiện vi khuẩn lao (thực hiện tại phòng Miễn dịch, Viện Vệ sinh Dịch tễ Trung ương)
Tách ADN của vi khuẩn lao trong mẫu (theo phương pháp Boom) Nguyên tắc: Phương pháp này dựa trên nguyên tắc dung Guanidin thiocyant (GuSCN) để ly giải hoạt tính nucleaza, các ADN trong mẫu sẽ bám vào các
hạt Silica, nhờ đó phá vỡ tế bào và tinh khiết được ADN từ mẫu bệnh phẩm.
Hóa chất phản ứng:
- Huyền dịch silica.
- Dung dịch ly giải L6: 5M GuSCN; 50mM Tris-HCL, pH6,4; 20mM EDTA, pH8; 0,1% Triston X-100.
- Dung dịch rửa L2: 5M GuSCN; 50 mM Tris-HCL.
- Dung dịch rửa etanol 70%.
- Dung dịch acetone.
- Dung dịch TE: 10mM Tris-HCL và 1mM EDTA pH8,3.
- ProK-Prep: protein K/detergient.
Chuẩn bị bệnh phẩm:
- Mẫu không khí (gelatin): hòa mỗi mẫu với 3ml nước siêu sạch, lắc kỹ cho đến khi tan hoàn toàn.
- Mẫu tăm bông gelatin: cho 600µl nước siêu sạch vào các eppendorf đựng các mẫu tăm bông, lắc kỹ cho gelatin cố định vi khuẩn được bọc ngoài các tăm bông tan hoàn toàn.
- Mẫu nước thải: lấy nước thải sau xử lý.
- Chứng dương: chủng H37Rv.
- Chứng âm: nước siêu sạch.
Các bước tiến hành:
- Cho 100 µl mẫu, 10 µl ProK-prep vào một eppedorf vô khuẩn, ủ 560C trong 2 giờ.
- Trong 1 tube Eppedorf nắp khóa 1,5ml, cho vào 900 µl L6, 30 µl Silica và 100 µl bệnh phẩm đã được xử lý với ProK-prep. Voltex hỗn dịch này và sau đó lắc ngang 100rpm hay lắc tay úp ngửa trong 10 phút. Voltex lần nữa trong 5 giây và ly tâm 13.000 rpm trong 15 giây.
- Dùng máy hút chân không hút bỏ phần nước nổi. Để tránh mất Silica, chừa lại khoảng 10 µl trên lớp Silica.
- Rửa 2 lần, mỗi lần với 01ml đễm rửa L2.
- Rửa tiếp 2 lần, mỗi lần với 01ml etanol 70%, sau đó 1 lần với 01ml acetone.
- Hút bỏ phần nước nổi sau đó làm khô Silica ở 560C trong khoảng 10 phút trong máy ủ nhiệt.
- Thêm 60µl đệm TE. Voltex cho đến khi Silica tan hoàn toàn. Ủ ở 560C
trong khoảng 10 phút. Ly tâm 13.000rpm trong 2 phút, hút cẩn thận 40-50µl dịch nổi vào một tube Eppedorf mới.
- Thêm 40µl TE vào cặn Silica. Voltex, ủ 10 phút ở 560C, ly tâm
13.000rpm trong 2 phút, hút cẩn thận 20 – 30 µl dịch nổi vào tube trước đó để có dung dịch cuối cùng.
Tiến hành phản ứng PCR (theo phương pháp của A.H.J.Kolk)
Nguyên tắc:
Phương pháp dựa trên sự khuyếch đại một đoạn ADN kích thước 249bp nằm trên đoạn chèn IS 6110 của Vi khuẩn lao, cặp đoạn mồi INS2/Pt18.
Hỗn hợp phản ứng:






