Sử dụng bộ kít chuẩn TB PCR kít (Nam Khoa, Việt Nam) gồm các thành phần: PCR buffer, Tag polymerase, dNTP, cặp đoạn mồi INS2/Pt18 đặc hiệu cho IS 6110 của Vi khuẩn lao (cho sản phẩm khuyếch đại 249bp), UDG và dUTP (giữ ở -200C cho đến khi dùng).
Cho mẫu vào ống phản ứng:
- Cho 10 µl dịch tinh khiết ADN từ bệnh phẩm vào ống PCR chứa 40 µl hỗn hợp phản ứng.
- Chứng dương: chủng H37Rv.
- Chứng âm: dung dịch TE.
Chạy chương trình luân nhiệt gồm:
- Bước 1: 400C trong 10 phút.
- Bước 2: lặp lại 40 lần chu kỳ sau: 940C trong 1,5 phút; 650C trong 2 phút; 720C trong 3 phút.
- Bước 3: 720C trong 30 phút.
Phát hiện sản phẩm PCR qua điện di:
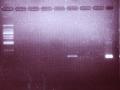
Đun agaroza 2% (dung dịch TBE 10X: 2,5ml; nước siêu sạch: 50ml; agaroza: 1g) bằng lò vi song. Để hạ nhiệt độ đến 560C, cho 2 µl Ethidium bromide nồng độ 10mg/ml, lắc đều, đổ vào khuôn, đợi cho nguội và đặt tấm gel vào trong máy điện di, ngập trong 300ml dung dịch TBE 0,5. Chạy điện di bằng dòng điện một chiều với hiệu điện thế 94V, cho đến khi loading buffer chạy cách giếng 3cm. Quan sát trên máy soi gel và chụp ảnh.
Do PCR có độ nhạy cao (có thể phát hiện được 10fg tương đương 1-3 vi khuẩn trở lên) nên kết quả cần được phân tích, đánh giá so với chứng âm (chỉ có dung dịch phản ứng) và chứng dương (ADN của Vi khuẩn lao).
Bệnh phẩm có kết quả PCR dương tính nếu vạch đặc hiệu của đoạn ADN có độ dài là 249bp.
2.4.4.5. Kỹ thuật RT – PCR khuyếch đại trình tự 16S rARN, ELISA phát hiện vi khuẩn lao sống.
Nguyên tắc:
Phương pháp dựa trên sự phiên mã ngược một đoạn ARN từ rARN của Mycobacterium thành cDNA rồi sau đó dung PCR khuyếch đại cDNA thành các sản phẩm có kích thước 208bp (cặp mồi thứ 1) và 461bp (cặp mồi thứ 2). Trong nghiên cứu này chúng tôi sử dụng hai cặp mồi khác nhau để khuyeesch đại 16S rARN của vi khuẩn nói chung (sử dụng cho các mẫu thu thập trước can thiệp) và của Vi khuẩn lao complex nói riêng (dùng cho các mẫu thu thập sau can thiệp).
Mồi và mẫu dò (probe) dùng cho phản ứng PCR-ELISA:
1) 16SF: GRG RTA CTC GAG TGG CGA AC 16SR: GGC CGG CTA CCC GTC GTC
Mồi được thiết kế dựa trên trình tự mã hóa cho gien 16S rARN của vi khuẩn cho sản phẩm PCR có kích thước 208bp
2)16Sf: 5’TAATACCGGATAGGACCACGG 3’
16Sr: 5’ GCGACGCTCACAGTTAAGCCGTG 3’
Mồi được thiết kế dựa trên trình tự mã hóa gien 16S rARN ở vùng đặc hiệu cho M.complex, cho sản phẩm PCR có kích thước 461bp.
Probe: Biotinated-ACC ACA AGA CAT GCA TCC CG, dặc hiệu cho Vi khuẩn lao 16S rARN.
.Tách chiết ARN của vi khuẩn lao:
- Hóa chất phản ứng: sử dụng kít tách chiết ARN của Qiagien-Mỹ
Bộ Kít gồm: đệm TE, pH8.0; đệm RLT; đệm RPE; đệm RW1; Ethanol (96 – 100%); nước RNase-free.
- Các bước tiến hành:
+ Ly tâm 12.000rpm trong 10 phút ở 40C, loại nước nổi.
+ Cho 100µl đệm TE chứa lysozym (3mg/ml) vào mẫu, để 10 phút ở nhiệt độ phòng.
+ Bổ sung 350µl đệm RLT, trộn mẫu. Ly tâm 12.000rpm trong 2 phút, lấy nước nổi cho vào tuýp mới.
+ Cho vào 50µl ethanol để hòa tan, trộn đều bằng pipette.
+ Lấy 700µl mẫu thu được cho vào tuýt 2ml. Ly tâm 10.000rpm trong 15 giây, loại nước.
+ Cho vào 700µl đệm RW1, ly tâm 10.000rpm trong 15 giây, loại nước.
+ Tiếp tục bổ sung 500µl đệm RPE, ly tâm 10.000rpm trong 15 giây, loại nước.
+ Cho vào 500µl đệm RPE, ly tâm 10.000rpm trong 2 phút, loại nước
+ Bổ sung 50µl nước RNase-free, ly tâm 10.000rpm trong 1 phút.
Xử lý ADN còn lẫn trong ARN
+ 10µl đệm DNA, 5µl RNase inhibitor, 10µl DNase; ủ ở 370C trong 30 phút.
+ Bổ sung 6µl EDTA (25µM) ủ ở 700C trong 10 phút, nhằm phá hủy DNase còn lại.
Phản ứng RT-PCR:
- Phản ứng RT: cho vào mỗi ống PCR 10µl dung dịch ARN, 4µl đệm PCR, 10pmol mồi đặc hiệu cho phiên mã ngược trình tự mARN của Vi khuẩn lao, 1µl dNTP (40µM), 0.5µM BSA, 1µM RNase inhibitor, 2.5U reverse trancriptaza trên tổng số 20µl dung dịch phản ứng; ủ 420C trong 1 giờ.
- Phản ứng PCR: phương pháp PCR sử dụng digoxigienin dUTP. Thành phần phản ứng bao gồm 1,5mM MgCl2 , 0,2µM mồi 16S R, 200µM dNTP (dATP, dTTP, dGTP, dCTP), 1,5 đơn vị tag polymerase, 5µl dịch cADN mẫu, 2,4nmol diogoxigienin-dUTP, bổ xung nước cất vô trùng vừa đủ 50µl dung dịch phản ứng.
+ Chứng dương: chủng H37rv
+ Chứng âm: nước DEPC (nước đã được xử lý RNase)
+ Chương trình PCR
Bước 1: 940C trong 10 phút
Bước 2: lặp lại 35 chu kỳ sau: 940C trong 1,5 phút, 660C trong 2 phút, 720C trong 3 phút
Bước 3: 720C trong 20 phút
Cặp mồi 16Sf-16Sr được thiết kế để nhân bản trình tự ADN có kích thước 461bp nằm trong vùng trình tự mã hóa cho gien 16S rARN của vi khuẩn. Qua tính toán, dựa trên nhiệt độ biến tính (Tm) của cặp mồi, chúng tôi sử dụng nhiệt độ lai trong phản ứng PCR là 660C.
Phát hiện sản phẩm PCR qua điện di:
- Đun agaroza 2% trong dung dịch đệm TBE 0,5X.
- Để nguội thạch đến nhiệt độ khoảng 560C, cho 2µl ẹthidium bromide nồng độ 10mg/ml, lắc đều, sau đó đổ thạch agaroza vào khuôn và tạo giếng bằng tấm lược nhựa.
- Khi thạch đông, cho ít nước lên mặt thạch sau đó nhẹ nhàng rút lược ra và
đặt thạch vào hộp điện di.
- Đổ đệm TBE 0,5X vào hộp điện di cho ngập trên mặt thạch khoảng 1mm.
- Trộn đều 10µl sản phẩm PCR trong 3ml loading buffer và cho vào các giếng của bản gel.
- Nối hộp điện di với bộ nguồn sao cho ADN di động theo chiều dòng điện từ cực âm đến cực dương, với hiệu điện thế 94V.
- Điện di kết thúc, quan sát kết quả trên máy soi thạch và chụp ảnh.
Bệnh phẩm có kết quả PCR dương tính nếu vạch đặc hiệu của đoạn ADN có
độ dài là 461bp.
Phản ứng lai bằng ELISA:
Để khẳng định chắc chắn mẫu thí nghiệm là dương tính với chủng M.tuberculosis, chúng tôi đem các sản phẩm PCR dương tính chạy ELISA được lai với probe đặc hiệu của M.tuberculosis.
2.2.5. Xử lý số liệu
Số liệu sau khi thu thập được xử lý bằng phần mềm EPI – INFO 6.04, phần mềm GraphPad Prism và áp dụng phương pháp thống kê y sinh học.
2.2.6. Hạn chế sai số trong nghiên cứu.
- Chọn điều tra viên là những nhân viên y tế có kinh nghiệm, được tập huấn kỹ.
- Chọn các bác sỹ chuyên khoa lao, có nhiều năm kinh nghiệm trong chẩn
đoán và điều trị bệnh lao phụ trách khám lâm sàng.
- Các kỹ thuật chẩn đoán bệnh lao dùng trong nghiên cứu theo đúng tiêu chuẩn của Chương trình Chống lao Quốc gia quy định.
- Giai đoạn trước và sau nghiên cứu đều dùng một loại Tuberculin tiêu chuẩn là Tuberculin PPD RT23+Tween80 2TU do Viện Huyết thanh quốc gia Copenhagien, Đan Mạch sản xuất.
- Kỹ thuật viên thử phản ứng Mantoux và đọc kết quả là kỹ thuật viên chuyên khoa, được đào tạo, tập huấn theo chương trình chống lao quốc gia và có kinh nghiệm lâu năm trong lĩnh vực này.
- Xử lý chống nhiễm kỹ thuật PCR theo đúng quy trình.
2.3. Khía cạnh đạo đức trong nghiên cứu
- Đề tài được Lãnh đạo Bệnh viện Lao và Bệnh phổi Thái Bình, Bệnh viện Tâm thần Thái Bình đồng ý cho thực hiện.
- Các đối tượng tham gia nghiên cứu hoàn toàn tự nguyện, cam kết.
- Đề tài nghiên cứu được thông qua Hội đồng khoa học và đạo đức của Viện Vệ sinh Dịch tễ Trung ương.
2.4. Hạn chế của đề tài:
- Do điều kiện các nguồn lực có hạn, ở đề tài này, chúng tôi chỉ tập trung nghiên cứu và can thiệp nhằm cải thiện môi trường bệnh viện, làm giảm nguy cơ phơi nhiễm nghề nghiệp cho nhân viên y tế.
- Thực hiện các kỹ thuật (nuôi cấy, PCR, RT-PCR) đòi hỏi nguồn kinh phí lớn nên trong khuôn khổ đề tài, giai đoạn sau can thiệp chúng tôi chỉ tập trung vào việc phát hiện vi khuẩn lao sống là nguy cơ lây nhiễm lao cho nhân viên bệnh viện và số lượng mẫu môi trường cũng tập trung thu thập ở những khu vực liên quan trực tiếp đến sự có mặt của bệnh nhân lao trong quá trình làm việc của nhân viên bệnh viện. dựa trên phân tích kết quả mẫu môi trường giai đoạn trước nghiên cứu.
CHƯƠNG 3: KẾT QUẢ NGHIÊN CỨU
3.1. ĐẶC ĐIỂM ĐỐI TƯỢNG NGHIÊN CỨU
3.1.1. Đặc điểm của đối tượng nghiên cứu là cán bộ Bệnh viện Lao và Bệnh phổi Thái Bình, Bệnh viện Tâm thần Thái Bình.
Bảng 3.1: Mô tả đối tượng nghiên cứu là cán bộ 2 bệnh viện.
CHỈ SỐ | BV LAO VÀ BP | BV TÂM THẦN | ||||
Tần số | Tỷ lệ % | Tần số | Tỷ lệ % | p | ||
Tổng số | 68 | 100,0 | 72 | 100,0 | ||
Giới | Nam Nữ | 34 34 | 50,0 50,0 | 29 43 | 40,3 59,7 | >0,05 |
15 – 24 | 03 | 4,4 | 05 | 6,9 | ||
25 – 34 | 14 | 20,6 | 18 | 25,0 | ||
Tuổi | 35 – 44 | 19 | 27,9 | 16 | 22,2 | >0,05 |
45 – 54 | 30 | 44,1 | 29 | 40,3 | ||
>= 55 | 02 | 2,9 | 04 | 5,6 | ||
Bác sỹ | 22 | 32,4 | 21 | 29,2 | ||
Y sỹ | 2 | 2,9 | 1 | 1,4 | ||
Y tá | 16 | 23,5 | 25 | 34,7 | ||
Nghề nghiệp | Kế toán Hộ lý Hành chính | 3 9 10 | 4,4 13,2 14,7 | 7 9 5 | 9,7 12,5 6,9 | >0,05 |
Dược sỹ | 2 | 2,9 | 1 | 1,4 | ||
Dược tá | 0 | 0,0 | 3 | 4,2 | ||
KTV XN | 4 | 5,9 | 0 | 0,0 | ||
Cấp 1 | 0 | 0,0 | 0 | 0,0 | ||
Cấp 2 | 3 | 4,4 | 7 | 9,7 | ||
Trình độ văn hoá | Cấp 3 Sơ, trung cấp Cao đẳng | 12 28 1 | 17,6 41,2 1,5 | 9 31 2 | 12,5 43,1 2,8 | >0,05 |
Đại học | 18 | 26,5 | 23 | 31,9 | ||
Trên đại học | 6 | 8,8 | 0 | 0,0 |
Có thể bạn quan tâm!
-
 Kiểm Soát Hành Chính Nhằm Làm Giảm Phơi Nhiễm Cho Nhân Viên, Bao Gồm:
Kiểm Soát Hành Chính Nhằm Làm Giảm Phơi Nhiễm Cho Nhân Viên, Bao Gồm: -
 Chọn Nhóm Nghiên Cứu: Chọn Mẫu Có Mục Đích Nhằm Xác Định Nguy Cơ Nhiễm Lao Của Cán Bộ Bệnh Viện Lao Và Bệnh Phổi Và Dân Cư Sống Xung Quanh Bệnh
Chọn Nhóm Nghiên Cứu: Chọn Mẫu Có Mục Đích Nhằm Xác Định Nguy Cơ Nhiễm Lao Của Cán Bộ Bệnh Viện Lao Và Bệnh Phổi Và Dân Cư Sống Xung Quanh Bệnh -
 Các Bước Tiến Hành Một Số Kỹ Thuật Dùng Trong Nghiên Cứu.
Các Bước Tiến Hành Một Số Kỹ Thuật Dùng Trong Nghiên Cứu. -
 Đặc Điểm Về Nghề Nghiệp Và Trình Độ Văn Hóa Của Dân Cư Hai Xã
Đặc Điểm Về Nghề Nghiệp Và Trình Độ Văn Hóa Của Dân Cư Hai Xã -
 Mối Liên Hệ Giữa Đường Kính Mantoux Và Năm Công Tác Của Cán Bộ Bệnh Viện Tâm Thần
Mối Liên Hệ Giữa Đường Kính Mantoux Và Năm Công Tác Của Cán Bộ Bệnh Viện Tâm Thần -
 Kết Quả Xét Nghiệm Vi Khuẩn Lao Trong Các Mẫu Theo Thời Tiết
Kết Quả Xét Nghiệm Vi Khuẩn Lao Trong Các Mẫu Theo Thời Tiết
Xem toàn bộ 126 trang tài liệu này.

Tổng số 140 cán bộ, nhân viên đang làm việc tại hai bệnh viện đã được tiến hành làm phản ứng Mantoux và khám lâm sàng, trong đó nữ là 63 người (45%), 126 người trong độ tuổi từ 25 – 54 (90%), 97 người có trình độ chuyên môn y, dược (69,3%), trình độ học vấn từ trung cấp trở lên là 107 người (76,4%). Các đặc điểm về tuổi, giới, nghề nghiệp, trình độ văn hóa tương đối giống nhau ở hai nhóm đối tượng thuộc hai bệnh viện (p > 0,05). Điều này chứng tỏ rằng hai nhóm cán bộ có điều kiện khá tương đồng để so sánh.
3.1.2. Đặc điểm đối tượng nghiên cứu là dân cư sống xung quanh Bệnh viện Lao và Bệnh phổi Thái Bình (Xã Vũ Chính) và dân cư xã Phú Xuân.
Bảng 3.2. Đặc điểm về giới và tuổi của dân cư hai xã.
CHỈ SỐ | VŨ CHÍNH | PHÚ XUÂN | p | |||
Tần số | Tỷ lệ % | Tần số | Tỷ lệ % | |||
Tổng số | 300 | 100,0 | 300 | 100,0 | ||
Giới | Nam Nữ | 142 158 | 47,3 52,7 | 129 171 | 43,0 57,0 | >0,05 |
Tuổi | 0 – 14 15 – 24 25 – 34 35 – 44 45 – 54 55 – 64 >= 65 | 95 39 56 39 41 13 17 | 31,7 13,0 18,6 13,0 13,7 4,3 5,7 | 104 13 43 50 24 13 53 | 34,7 4,3 14,3 16,7 8,0 4,3 17,7 | >0,05 <0,05 >0,05 >0,05 >0,05 >0,05 <0,05 |