Đơn vị | Nyanza (Rwanda) | Ouled Fayet (Algeria) | Jebel Chakir (Tunisia) | |
BOD5 | mg/l | 674 | 388 | 500 |
BOD5/COD | mg/l | 0,28 | 0,11 | 0,1 |
SS | mg/l | 1.150 | - | - |
TSS | mg/l | - | 10,4 | - |
+ NH4 | mg/l | 36,5 | 3.159 | - |
- NO3 | mg/l | 20 | 0,81 | - |
- NO2 | mg/l | - | 0,75 | - |
N-tổng | mg/l | 1.207 | 5.236 | - |
3- PO4 | mg/l | 42,6 | - | - |
P-tổng | mg/l | - | 37,3 | 8,79 |
2- SO4 | mg/l | 2.599 | 995 | 76 |
- HCO3 | mg/l | - | - | 21.750 |
Cl- | mg/l | - | 2,8 | 4.870 |
Cu | mg/l | - | - | 0,14 |
Cd | mg/l | - | 1,7 | - |
Zn | mg/l | - | 1,5 | 0,94 |
Cr | mg/l | - | - | 2,24 |
Pb | mg/l | - | - | - |
Mn | mg/l | - | - | - |
Fe | mg/l | - | 21,5 | - |
Nguồn trích dẫn | [28] | [33] | [90] | |
Có thể bạn quan tâm!
-
 Nghiên cứu xử lý nước rỉ rác bãi chôn lấp bằng phương pháp ozon hóa - 1
Nghiên cứu xử lý nước rỉ rác bãi chôn lấp bằng phương pháp ozon hóa - 1 -
 Nghiên cứu xử lý nước rỉ rác bãi chôn lấp bằng phương pháp ozon hóa - 2
Nghiên cứu xử lý nước rỉ rác bãi chôn lấp bằng phương pháp ozon hóa - 2 -
 Tổ Ng Quan Về Nướ C Rỉ Rác Và Công Nghệ Xử Lý Nước Rỉ Rác
Tổ Ng Quan Về Nướ C Rỉ Rác Và Công Nghệ Xử Lý Nước Rỉ Rác -
 Ưu Và Nhược Điểm Của Ozon Hoá Trong Xử Lý Nước Và Nước Thải Ưu Điểm:
Ưu Và Nhược Điểm Của Ozon Hoá Trong Xử Lý Nước Và Nước Thải Ưu Điểm: -
 Nghiên cứu xử lý nước rỉ rác bãi chôn lấp bằng phương pháp ozon hóa - 6
Nghiên cứu xử lý nước rỉ rác bãi chôn lấp bằng phương pháp ozon hóa - 6 -
 Các Nghiên Cứu Xử Lý Nướ C Rỉ Rá C Bằng Ozon Ở Viêṭ Nam
Các Nghiên Cứu Xử Lý Nướ C Rỉ Rá C Bằng Ozon Ở Viêṭ Nam
Xem toàn bộ 224 trang tài liệu này.
1.2.2. Thành phần nướ c rỉ rá c ở Viêṭ Nam
Viêṭ Nam vân
chưa áp duṇ g biên
pháp phân loaị rác taị nguồn nên thành phần
của nước rỉ rác rất phức tạp . Nước rỉ rác không chỉ chứ a các chất hữu cơ mà còn chứ a
các chất vô cơ hoà tan , kim loai
năṇ g, các chất hữu cơ độc hại . Vì vậy, vấn đề vướng
mắc hiên
nay mà hầu hết các bai
chôn lấp ở Viêṭ Nam găp
phải nhưng chưa có phương
hướng giải quyết tối ưu đó là vấn đề xử lý nước rỉ rác.
Các thành phần nước rỉ rác có thể biến động rất lớn, tùy thuộc vào tuổi bãi chôn lấp, thời gian lấy mẫu – mùa mưa hay mùa khô và theo những xu hướng khác nhau. Vì vậy, việc khảo sát các đặc trưng của nước rỉ rác t ại các bãi chôn lấp suốt một thời gian dài, ngay từ khi mới đi vào hoạt động, có thể cung cấp những thông tin quan trọng làm cơ sở để chọn lựa công nghệ xử lý phù hợp.
Ngoài ra, thiết kế và thực tế vận hành của các bãi chôn lấp cũng có nh ững ảnh hưởng quan trọng đến đặc trưng của nước rỉ rác . Chẳng hạn, mặc dù các bãi chôn lấp
Gò Cát và Phước Hiệp (Tam Tân), Thành phố Hồ Chí Minh đều xử lý một nguồn rác thải vào cùng một thời điểm nhưng do có độ sâu của bãi chôn lấp lớn hơn và có quay vòng nước rỉ rác , quá trình phân hủy hữu cơ ở bãi chôn lấp Phước Hiệp diễn ra tương đối nhanh, chỉ trong vòng 5 – 6 tháng kể từ khi bãi chôn lấp đi vào vận hành [5].
Kết quả phân tích nước rỉ rác đư ợc tổng hợp từ các nguồn [5, 10, 13, 14] ở bảng 1.5, pH trong khoảng 6,5 – 8,5. Giá trị COD tại ô chôn lấp cao : 327 – 22.783 mg/l. Nồng đô ̣nitơ dao đ ộng lớn 62 – 2.427 mg/l. Có thể thấy đ ặc trưng nhất của nước rỉ rác là hàm lượng TDS, BOD5, COD, tổng nitơ cao và dao động rất lớn theo thời gian.
Như vậy, các đặc trưng hóa lý nước rỉ rác được phân chia thành hai loại: nước rỉ rác mới (2 – 3 năm sau khi bãi chôn lấp đi vào hoạt động) và nước rỉ rác cũ (từ năm thứ 4 – 5 trở đi), có thể nhận thấy nước rỉ rác mới cũng chia thành hai lo ại khác nhau: trong giai đoạn 3 – 6 tháng đầu, nước rỉ rác mới mang tính a xít, với nồng độ COD, BOD, các kim loại nặng đều từ cao đến rất cao, pH và NH4+ tương đối thấp. Giai đoạn tiếp theo, nồng độ các ion tự do giảm nhiều, pH trung tính, NH4+ bắt đầu tăng, nhưng
COD và BOD vẫn còn rất cao.
Nhận xét:
Nhìn chung, nước rỉ rác ở một số bãi chôn lấp ở nước ta cũng có thành phần chất hữu cơ dao động trong khoảng lớn, COD từ vài trăm đến trên mười nghìn mg/l, thậm chí cao hơn một số bãi chôn lấp ở Đài Loan và Indonesia. Tỉ lệ BOD5/COD ở một số bãi chôn lấp ở nước ta cao hơn một số bãi chôn lấp ở châu Âu, châu Mỹ và châu Phi. Hàm lượng chất rắn lơ lửng được trình bày ở bảng 1.5 cao hơn một số bãi chôn lấp trên thế giới.
Ở nhiều nước trên thế giới, nhiều bãi chôn lấp đã áp dụng việc phân loại rác tại nguồn và áp dụng các công nghệ thu hồi, tái chế chất thải rắn nên thành phần và tính chất nước rỉ rác ít phức tạp hơn các bãi chôn lấp ở Việt Nam. Hầu hết chất thải rắn ở nước ta không được phân loại. Vì thế, thành phần nước rỉ rác ở Việt Nam không những thay đổi theo thời gian mà còn phức tạp hơn so với một số nước khác. Thành phần nước rỉ rác ở nước ta cao và phức tạp cũng do ảnh hưởng của việc vận hành bãi chôn lấp chưa đảm bảo một bãi chôn lấp hợp vệ sinh và điều kiện khí hậu ẩm ướt, mưa nhiều. Vì thế, việc lựa chọn công nghệ xử lý nước rỉ rác phù hợp ở nước ta cũng gặp nhiều khó khăn.
14
Bảng 1.5. Đặc trưng thành phần nước rỉ rác ở một số thành phố Việt Nam
Đơn vị | BCL Nam Sơn (Hà Nội) | BCL Gò Cát (Hồ Chí Minh) | BCL Thủy Phương (Huế) | BCL Tràng Cát (Hải Phòng) | BCL Xuân Sơn (Hà Nội) | |
pH | - | 6,81 – 7,98 | 7,4 – 7,6 | 7,7 – 8,5 | 6,5 – 8,22 | 7,7 |
TDS | mg/l | 6.913 – 19.875 | - | - | 4,47 – 9,24 | - |
TSS | mg/l | 120 – 2.240 | 700 – 2.020 | 42 – 84 | 21 – 78 | 986 |
COD | mg/l | 1.020 – 22.783 | 13.655 – 16.814 | 623 – 2.442 | 327 – 1.001 | 3.540 |
BOD5 | mg/l | 495 – 12.302 | 6.272 – 9.200 | 148 – 398 | 120 – 465 | 2.150 |
BOD5/ COD | - | 0,485 – 0,540 | 0,459 – 0,547 | 0,234 – 0,163 | 0,370 – 0,465 | 0,607 |
Tổng N | mg/l | 423 – 2.253 | 1.821 – 2.427 | - | 179 – 507 | 62 |
+ N – NH4 | mg/l | - | 1.680 – 2.887 | 184 – 543 | - | 17,2 |
- N – NO3 | mg/l | - | 0 – 6,2 | - | - | 12,5 |
Tổng P | mg/l | 6,51 – 24,80 | 10,3 – 19,8 | - | 3,92 – 8,562 | 4,31 |
Độ cứng CaCO3 | mg/l | - | - | 1.419 – 4.874 | - | - |
Cl- | mg/l | - | - | 518 – 1.199 | - | - |
As | mg/l | 0,001 – 0,003 | - | - | 0,047 – 0,086 | 0,2 |
Pb | mg/l | 0,050 – 0,086 | - | - | < 0,05 | 0,34 |
Cd | mg/l | 0,010 – 0,025 | - | - | < 0,01 | 0,14 |
Hg | mg/l | 0,0001 – 0,0009 | - | - | 0,0001 | - |
Tuổi BCL | năm | 7 | 7 | 9 | 2 | 10 |
Nguồn trích dẫn | [5] | [13] | [14] | [5] | [10] | |
1.3. CÁC PHƯƠNG PHÁP XỬ LÝ NƯỚC RỈ RÁC
Công nghệ xử lý nước thải rất phong phú, có tới hàng chục loại hình công nghệ đang được sử dụng trong thực tiễn trên nền của các quá trình công nghệ cơ bản theo từng cấp.
Hai nhóm phương pháp xử lý cơ bản áp dụng trong xử lý nước rỉ rác là phương pháp hóa lý và sinh học [1, 5]. Phương pháp hóa học, hóa lý gồm: Keo tụ, hấp phụ, trao đổi ion, oxi hóa, kết tủa, màng lọc và lắng. Phương pháp sinh học: Xử lý vi sinh yếm khí, hiếu khí, thiếu khí và các tổ hợp của chúng.
Mỗi phương pháp nhằm một mục tiêu xử lý cho một đối tượng, nhưng một phương pháp cũng có thể áp dụng xử lý đồng thời cho nhiều đối tượng và để xử lý một đối tượng cũng có thể sử dụng nhiều phương pháp khác nhau. Tuy nhiên, trong thực tế một phương pháp hay một tổ hợp thường chỉ nhằm vào một đối tượng chính.
Một số công nghệ xử lý nước rỉ rác được áp dụng phổ biến hiện nay [7]:
- Xử lý vi sinh kỵ khí → xử lý vi sinh hiếu khí → ao hồ ổn định → xả ra nguồn tiếp nhận.
- Xử lý vi sinh kỵ khí → xử lý vi sinh hiếu khí → oxi hóa bằng hóa chất → ao hồ ổn định → xả ra nguồn tiếp nhận.
- Xử lý sinh học → đưa về nhà máy xử lý chung với nước thải sinh hoạt.
- Xử lý sinh học → lọc thẩm thấu ngược (RO).
- Keo tụ → lắng (hoặc tuyển nổi) → xử lý vi sinh kỵ khí → xử lý vi sinh hiếu khí → ao hồ ổn đinh → xả nguồn tiếp nhân.
- Oxi hóa bằng hóa chất → lắng → xử lý vi sinh kỵ khí → xử lý vi sinh hiếu khí → ao hồ ổn đinh → xả nguồn tiếp nhân.
- Keo tụ → lắng (hoặc tuyển nổi) → xử lý vi sinh kỵ khí → xử lý vi sinh hiếu khí → hấp phụ xử lý màu → ao hồ ổn định → xả nguồn tiếp nhân.
Như vậy, các công nghệ xử lý nước rỉ rác vẫn phổ biến là xử lý bằng nhiều công đoạn, trong đó công nghệ sinh học được áp dụng ở hầu hết các dây chuyền. Các công nghệ hóa lý cũng được áp dụng phổ biến như keo tụ, oxi hóa….
Hiệu quả của một số phương pháp xử lý nước rỉ rác được đánh giá bởi Abbas và cộng sự (2009) [17], cụ thể như sau:
- Phương pháp kết hợp xử lý nước rỉ rác với nước thải sinh hoạt có hiệu quả cao với xử lý nước rác mới và trung bình nhưng phương pháp này có nhược điểm là tồn dư sinh khối và chất ding dưỡng.
- Quá trình hiếu khí thích hợp xử lý nước rỉ rác mới và trung bình, nhược điểm là bị ức chế bởi các chất khó phân hủy sinh học và tồn dư sinh khối.
- Quá trình kỵ khí thích hợp xử lý nước rỉ rác mới và trung bình, nhược điểm là bị ức chế bởi các chất khó phân hủy sinh học, rất chậm và tạo khí sinh học.
- Keo tụ thích hợp nước rỉ rác cũ và trung bình để loại bỏ kim loại nặng và chất rắn lơ lửn. Tuy nhiên, phương pháp này tạo ra nhiều bùn thải chôn lấp.
- Oxi hóa hóa học xử lý tốt với nước rỉ rác cũ và trung bình để loại bỏ các chất hữu cơ. Phương pháp này có nhược điểm là sinh khí ozon dư, tạo bùn thải có nhiều sắt (quá trình Fenton).
- Stripping thích hợp với nước rỉ rác cũ và trung bình nhằm xử lý amoni, phương pháp này đòi hỏi bổ sung thiết bị để kiểm soát ô nhiễm không khí.
- Trao đổi ion thích hợp với tất cả các loại nước rỉ rác để xử lý các hợp chất hòa tan, các cation/anion nhưng chi phí lớn.
- Phương pháp siêu lọc thích hợp để loại bỏ các chất có phân tử lượng cao nhưng chi phí rất cao và hạn chế áp dụng do thường xuyên phải thay màng lọc.
- Lọc nano áp dụng tốt cho tất cả các loại nước rỉ rác xử lý muốn sunphat.
Phương pháp này cũng có chi phí rất cao.
- Lọc màng thẩm thấu ngược có thể có hiệu quả tốt trong xử lý nước rỉ rác để loại bỏ các hợp chất vô cơ và hữu cơ nhưng chi phí rất cao và yêu cầu tiền xử lý.
Trong nhiều năm, phương pháp sinh học và hóa lý là công nghệ phổ biến trong xử lý nước rỉ rác. Một số phương pháp lọc màng có hiệu quả tốt nhưng tốn kém. Phương pháp oxi hóa áp dụng xử lý nước rỉ rác phù hợp với nước rỉ rác có tuổi trung bình và cũ.
1.4. CÁC QUÁ TRÌNH OXI HOÁ BẰNG TÁC NHÂN OZON
1.4.1. Tính chất hóa lý của ozon
Ozon (O3) là một tác nhân oxi hoá mạnh v ới thế oxi hoá là 2,07V [44], ozon có thể xảy ra phản ứng oxi hoá với nhiều chất hữu cơ, các chất vô cơ trong nước, có
thể làm sạch nước thải khỏi phenol, sản phẩm dầu mỏ, H2S, các hợp chất của asen, chất hoạt động bề mặt, xyanua, thuốc nhuộm, hidrocacbon thơm, thuốc sát trùng. Ozon có công thứ c phân tử là O3, ở nồng đô ̣cao có màu xanh.
Bảng 1.6. Đặc tính hóa lý của O3 phân tử [44]
48 | |
Điểm sôi ở điều kiêṇ áp suất khí quyển | -119 ± 0,30C |
Nhiêṭ đô ̣tới haṇ | -12,1 ± 0,10C |
H (entapi) ở điều kiện 2980K, 1atm | 34220 ± 240 cal |
Áp suất tới hạn | 55,3x105 Pa |
Mâṭ đô ̣tương đối trong khí quyển | 1,657 kg.N/m3 |
Mâṭ đô ̣tuyêṭ đối ở điều kiêṇ chuẩn | 2,143 kg.N/m3 |
1.4.2. Cơ chế oxi hóa của ozon
Trong điều kiện nhiệt độ và áp suất tiêu chuẩn, ozon là khí màu xanh nhạt, nặng hơn không khí. Ozon không bền, dễ bị phân hủy thành oxy nguyên tử và oxy phân tử. Ozon có thể hòa tan trong nhiều dung môi khác nhau, ở điều kiện thường, độ hòa tan của ozon vào trong nước gấp 14 lần oxy, tuy nhiên, tính ổn định phụ thuộc vào nhiều yếu tố môi trường như các cation, kim loại, các oxít kim loại nặng, nhiệt độ, độ ẩm và áp suất.
Ozon có thể oxi hóa các hợp chất hữu cơ trong nước theo hai con đường:
Oxi hóa trực tiếp bằng phân tử ozon hòa tan trong nước.
Oxi hóa gián tiếp qua gốc hydroxyl ( OH ) khi phân hủy O3 trong nước.
Quá trình oxi hoá trực tiếp bằng phân tử O3 xảy ra tương đối chậm so với oxi hoá gián tiếp qua gốc hydroxyl ( OH ) do sự phân huỷ ozon tạo ra [11, 41, 59, 98].
Hai con đường oxi hoá trưc tiêṕ và giań tiêṕ của O3với cać chât́ hữu cơ cũng
đươc
Gottschalk và côṇ g sư ̣ (2010) [46] mô tả ở hình 1.2.
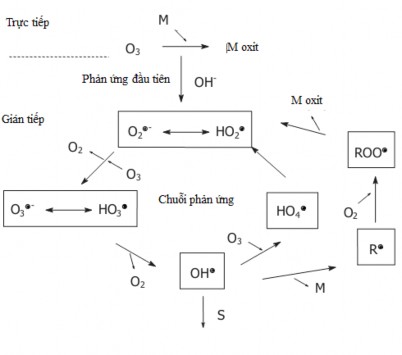
(S: chất cản trở, M: chất ô nhiêm có nồng độ thấp khá c, R: sản phẩm phản ứng)
Hình 1.2. Mô hình ozon hóa gián tiếp và trực tiếp
Trong môi trường axít, con đường oxi hoá trực tiếp bằng phân tử O3 là chủ yếu. O3 phản ứng với các hợp chất hữu cơ chứa liên kết đôi C=C hoặc các liên kết vòng thơm và phân hủy chúng thành axit cacboxylic và andehit [63, 102]. Phân tử O3 phản ứng dễ dàng với các chất hữu cơ như amin, phenol và các hợp chất vòng thơm nhưng phản ứng chậm với axit cacboxylic, andehit và rượu [53]. Trong môi trường kiềm, với sự có mặt của ion OH- , O3 bị phân hủy nhanh và hình thành gốc
hydroxyl linh động ( OH ) và gốc này oxi hóa các chất hữu cơ trong nước và nước thải[53]. Phản ứng của phân tử O3 (E0 = 2,07V) chậm và hạn chế trong khi gốc OH (E0 = 2,80V) phản ứng với hầu hết các chất hữu cơ trong nước và nước thải [34, 47, 104].
Phản ứng của O3
và ion OH- hình thành gốc
O và gốc
HO . Phản ứng
2
2
giữa gốc O3 và gốc O2
lại hình thành gốc ozonit
O3 , gốc này bị phân hủy ngay
lập tức và hình thành gốc hydroxyl linh động OH . Tóm lại, phản ứng của ba phân
2
tử O3 hình thành hai gốc hydroxyl linh động OH [70]
3O3
OH H 2OH 4O
(1.1)
Do đó, thay vì sử dụng Ozon đơn, nhiều công trình nghiên cứu đã phát triển theo hướng tìm kiếm các tác nhân phối hợp với ozon hoặc chất xúc tác nhằm tạo ra
gốc
OH
để nâng cao hiệu quả oxi hoá của ozon khi cần xử lý những hợp chất bền
vững, khó phân huỷ trong nước và nước thải. Những tác nhân đưa thêm vào được nghiên cứu nhiều nhất là H2O2, chất xúc tác là các muối Ni(II), Co(II), oxit kim loại TiO2, MnO2...
Quá trình ozon hóa nước thải đồng thời diễn ra oxi hóa các tạp chất mang
màu, khử trùng, hủy độc, làm bão hòa nước bằng oxy. Oxi hóa các hợp chất hữu cơ bằng ozon có thể tạo thành các sản phẩm trung gian: rượu, andehit, xeton, axít và do khả năng oxi hóa mạnh nên nó có thể oxi hóa sâu hơn để tạo ra CO2 và H2O.
1.4.3. Quá trình kết hợp Ozon với các tác nhân khác
a. Quá trình Perozon
Khác biệt cơ bản giữa quá trình Ozon đơn và Perozon là quá trình Ozon đơn thực hiện sự oxi hóa các chất ô nhiễm chủ yếu trực tiếp bằng tính oxi hóa mạnh của bản thân phân tử O3 trong nước. Trong khi đó, quá trình Perozon thực hiện sự oxi hóa chất ô nhiễm chủ yếu là gián tiếp qua gốc hydroxyl ( OH ) được tạo thành từ
kết hơp
ozon và hydro peroxyt (O3/H2O2).
Khi kết hợp H2O2 với O3 sẽ bắt đầu chu kỳ phân hủy O3 để hình thành gốc
hydroxyl linh động OH [70]:
H
2O2
HO H
(1.2)
2
HO O HO O
(1.3)
2 3 2 3
2
Phản ứng tiếp tục diễn ra theo con đường gián tiếp và hình thành gốc hydroxyl linh động OH .
3
2O H
2O2
2HO 3O
(1.4)
Ở quá trình Perozon , do sự có mặt hydro peroxyt gia tăng đáng kể quá trình tiêu thụ và phân huỷ ozon đã tăng cường chuyển ozon từ pha khí sang pha lỏng .
Phản ứng hình thành gốc hydroxyl ( OH ) ở phản ứng 1.4 cho thấy gốc
OH
sinh ra
ở phản ứng hệ Perozon nhiều hơn (2 mol O3 sẽ sinh ra 2 gốc OH ) so với phản ứng
ở hệ Ozon đơn (3 mol O3 mới sinh ra 2 gốc OH ). Vì quá trình oxi hoá thông qua






