gốc hydroxyl ( OH ) hiệu quả hơn quá trình oxi hoá trực tiếp bằng phân tử O3 nên quá trình Perozon được sử dụng rất phổ biến và phát triển mạnh trong những năm gần đây để xử lý các chất hữu cơ khó phân hủy trong nước và nước thải.
b. Quá trình Catazon
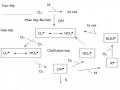
Hoạt tính oxi hoá của ozon có thể được nâng cao ngoài việc đưa thêm vào hệ H2O2 làm chất khơi mào cho sự phân huỷ ozon , còn có thể b ổ sung các chất xúc tác
đồng thể hoăc di ̣thể. Quá trình này được gọi chung là quá trình Catazon [11].
Quá trình Catazon đồng thể:
*. Chất xú c tá c kiềm:
Thưc
hiên
phản ứng ozon hoá với pH cao s ẽ nâng cao đáng kể năng lưc
Có thể bạn quan tâm!
-
 Nghiên cứu xử lý nước rỉ rác bãi chôn lấp bằng phương pháp ozon hóa - 2
Nghiên cứu xử lý nước rỉ rác bãi chôn lấp bằng phương pháp ozon hóa - 2 -
 Tổ Ng Quan Về Nướ C Rỉ Rác Và Công Nghệ Xử Lý Nước Rỉ Rác
Tổ Ng Quan Về Nướ C Rỉ Rác Và Công Nghệ Xử Lý Nước Rỉ Rác -
 Đặc Trưng Thành Phần Nước Rỉ Rác Ở Một Số Thành Phố Việt Nam
Đặc Trưng Thành Phần Nước Rỉ Rác Ở Một Số Thành Phố Việt Nam -
 Nghiên cứu xử lý nước rỉ rác bãi chôn lấp bằng phương pháp ozon hóa - 6
Nghiên cứu xử lý nước rỉ rác bãi chôn lấp bằng phương pháp ozon hóa - 6 -
 Các Nghiên Cứu Xử Lý Nướ C Rỉ Rá C Bằng Ozon Ở Viêṭ Nam
Các Nghiên Cứu Xử Lý Nướ C Rỉ Rá C Bằng Ozon Ở Viêṭ Nam -
 Sơ Đồ Thí Nghiệm Xử Lý Nước Rỉ Rác Bằng Ozon Đơn Hoặc Perozon
Sơ Đồ Thí Nghiệm Xử Lý Nước Rỉ Rác Bằng Ozon Đơn Hoặc Perozon
Xem toàn bộ 224 trang tài liệu này.
oxi
hoá của ozon . Nguyên nhân do ở pH cao, phản ứng giữa ion hydroxyt và ozon hình

thành gốc anion superoxyt
O và gốc hydro peroxyt HO 2•-
2
O OH HO O
(1.5)
3 2 2
O
3
Bằng phản ứ ng giữa ozon và gốc anion superoxyt O 2-, gốc anion ozonit
đươc
hình thành, sau đó lâp
tứ c bị phân huỷ khi có măṭ O3 và tạo ra gốc
OH [12]:
3O3
OH H 2OH 4O
(1.6)
2
*. Chất xú c tá c ion kim loaị :
Xử lý nước thải bằng ozon với các chất xúc tác đồ ng thể Ni (II), Co(II), Cd(II), Cu(II), Ag(I), Cr(III), Zn(II)… có tác dụng loại bỏ chất ô nhiễm hữu cơ cao hơn so với sử duṇ g Ozon đơn.
Quá trình Catazon dị thể [7]:
Quá trình ozon hoá xúc tác dị thể có thể diễn ra theo ba cơ chế :
- Hấp phu ̣hoá hoc
ozon trên bề măt
chất xúc tác tạo thành các chất hoạt
đôṇ g, các chất này phản ứ ng với các chất hữu cơ trên bề măṭ chất xúc tác.
- Hấp phu ̣hoá hoc cać chât́ hữu cơ (liên kêt́ đôi hay phân chia ) trên bề măt
chất xúc tác và chúng phản ứ ng với ozon ở pha khí hoăc pha lỏng .
- Hấp phu ̣hoá hoc đồng thời của cả ozon và cać phân tử chât́ hữu cơ .
Các chất xúc tác dị thể chính cho quá trình ozon là các oxit kim loại như MnO2, TiO2, Al2O3, SiO2… và các kim loại hoặc oxit kim loại kết hợp như Cu-
Al2O3, Cu-TiO2, Ru-CeO2, V-O/TiO2, V-O/silicagel và TiO2/Al2O3, Fe2O3/Al2O3… hay các dạng oxit kim loại khác như FeOOH, MnOOH…
Oxit sắt (III)hoà tan:
Oxit mangan:
FeOOH 3H Fe(III )(aq) 2H O
2
2
FeOOH e 3H Fe(II )(aq) 2H O
(1.7)
(1.8)
- Chất xúc tác rắn MnO2hấp phu ̣ các phân tử chất hữu cơ trên bề măṭ theo cơ chế hấp phu.̣
- Mn4+ (s) lấy 2 điên
tử của phân tử chất hữu cơ chuyển hoá thành Mn 2+ (aq)
tan trong nước và phân huỷ chất hữu cơ.
MnO2
2e 4H Mn2(aq) 2H O
(1.9)
2
2
MnOOH(s) e 3H Mn2 2H O (1.10)
H 2CO(aq) 2MnO2
(s) 4H 2Mn2(aq) CO
(aq) 3H 2O
(1.11)
2
- O3 oxi hoá Mn2+(aq) thành Mn4+ và hình thành gốc tự do hydroxyl ( OH ):
3
Mn2(aq) 2O
Mn4(s) 2O
(1.12)
3
2O 2H 2HO
(1.13)
3 3
2HO 2HO 2O
(1.14)
3 2
---------------------------------------------------------------------------
3
2
và cơ chế:
Mn2(aq) 2O
2H Mn4(s) 2OH 2O
(1.15)
3Mn2(aq) 4O 3MnO (s) 2O
(1.16)
3 2 3
2O 2H 2HO
(1.17)
3 3
2HO 2HO 2O
(1.18)
3 2
---------------------------------------------------------------------------
3Mn2(aq) 4O 2H 3MnO (s) 2OH 2O
(1.19)
3 2 2
Quá trình trên hoàn nguyên chất xúc tác rắn MnO 2 tạo ra gốc hydroxyl gốc này và ozon hoà tan trong nước O3(aq) phản ứng và phân huỷ chất hữu cơ.
OH ,
c. Các quá trình kết hợp ozon với UV
2
2
Ozon hấp thụ tia UV và phân ly rất nhanh trong nước. Quá trình quang phân O3 dưới tác dụng của UV tạo ra H2O2, từ H2O2 lại bị quang phân tiếp tục tạo gốc OH . Quá trình xảy ra như sau [12]:
O3 H
O hv2OH O
(1.20)
( = 253,7 nm)
Nếu đưa thêm H2O2 vào hệ O3/UV trở thành O3/UV/H2O2 sự hình thành gốc
OH sẽ tăng và hiệu quả quá trình cao hơn O3/UV và H2O2/UV:
1.4.4. Các yếu tố ảnh hưởng tới quá trình ozon hoá
a. Nồng độ ozon
- Quá trình ozon hoá trực tiếp bằng phân tử ozon:
Tốc độ phản ứng trực tiếp tỉ l ệ với nồng độ ozon trong pha lỏng có nghĩa hiệu suất quá trình ozon hoá tăng. Tuy nhiên, nếu tiếp tục tăng nồng độ ozon đến khi các chất ô nhiễm đã bị ozon hoá hoàn toàn và không còn chất ô nhiễm trong nước nữa thì ozon sẽ tự phân huỷ trong nước.
- Quá trình ozon hoá gián tiếp bằng các gốc OH• [44]:
+ Nếu chỉ dùng ozon đơn:
2O3 + 2OH- 2OH• + 3O2 (1.21)
Dựa trên phương trình phản ứng ta thấy:
O3
OH
1,5
+ Dùng ozon kết hợp với hydro peroxyt (O3/H2O2):
2O3 + H2O2 2OH• + 3O2 (1.22)
O3 1
OH
+ Dùng ozon kết hợp với tia UV (O3/UV): (phản ứng 1.20)
Các phương trình trên cho thấy mối quan hệ giữa nồng độ ozon trong pha lỏng và nồng độ gốc OH . Trong khi đó, dựa trên các phản ứng giữa gốc OH với các chất ô nhiễm ta xác định được mối quan hệ giữa nồng độ OH với tốc độ phản ứng hay hiệu suất quá trình.
b. Ảnh hưởng của anion vô cơ
Cl- là một trong các chất phân hủy gốc OH làm giảm hiệu quả xử lý [46].
Cl OH ClOH (1.24)
Do phản ứ ng caṇ h tranh giữa OH • với chất hữu cơ có hằng số tốc đô ̣phản
ứng cao hơn so với hằng số tốc đô ̣phản ứ ng của
OH
với Cl-nên vân
xử lý đươc
chất hữu cơ trong nước thải nhưng hiêu
quả giảm so với đã loai
bỏ clo trước.
CO32- và HCO3- cũng có ảnh hưởng không nhỏ đến hiệu suất phản ứng . Nếu trong nước và nước thải chứ a các anion bicacbonat và cacbonat ở môi trường pH
cao, cân bằng cacbonat/bicacbonat sẽ nhanh chóng chuyển sang ta o cacbonat, đây là
môt
chất phân hủy mạnh gốc OH .
Gốc OH• bị tiêu hao do độ kiềm cao trong nước thải theo phản ứng [46]:
3
2
HCO OH H
O CO
(1.25)
3
2
CO3 OH OH CO3
(1.26)
Khả năng phản ứng của CO32- với gốc của HCO3- và gốc OH .
OH
mạnh hơn khả năng phản ứng
Qua các phương phình phản ứ ng 1.24–1.26 cho thấy , sư ̣ có măṭ các anion
trên sẽ làm giảm hiêu suât́ xử lý nước thaỉ .
c. Ảnh hưởng của pH
Hydro peroxyt phản ứ ng châm
với ozon , nhưng sản phẩm phân huỷ của
hydro peroxyt là ion HO 2- lại phản ứng rất mạng với ozon. Vì vậy, trong môi trường
pH cao rất thuân
lơi
cho phản ứ ng giữa ozon và hydro peroxyt x ảy ra làm tăng tốc
đô ̣ quá trình phản huỷ ozon và tạo gốc
OH . Nếu tăng pH lên môt
đơn vị, có thể
tăng tốc đô ̣hình thành gốc OH lên 10 lâǹ [11].
trưc
Nhìn chung , ở điều kiện môi trường axít mạnh (pH <4), quá trình o xi hoá tiếp chiếm ư u thế, nhưng ở môi trường ki ềm mạnh (pH ≥10), quá trình oxi hoá
gián tiếp chiếm ưu thế . Ở môi trường trung tính (pH ≈ 7) cả hai quá trình oxi hoá
trưc̣ nhiêm
tiếp và gián tiếp đều đóng vai trò quan troṇ g , phụ thuôc có măṭ trong môi trường [46].
nhiều vào các chất ô
d. Ảnh hưởng của thời gian phản ứng
Thời gian phản ứng có ảnh hưởng lớn đến hiệu suất của quá trình xử lý các chất hữu cơ . Sự tính toán thời gian cần thiết để phân huỷ như mong muốn sẽ dựa vào hai yếu tố[44]:
- Hằng số tốc độ phản ứng:
kOX
.OX kd
.O3kid
.OH
- Chế độ thuỷ động học của cột phản ứng. Tốc độ phản ứng tổng:
rM kOX .OX .M
Hiệu suất chuyển hoá của các chất vi ô nhiễm sẽ được tính:
M /M o exp kOX .OX .tđối với các thiết bị phản ứng kiểu phít tông.
M /M o
1 k
1
OX .OX .t
với các thiết bị phản ứng khuấy trộn tốt.
M /M o
(1 k
1
OX .OX .t).n
với thiết bị có n bình phản ứng khuấy trộn.
1.4.5. Ưu và nhược điểm của ozon hoá trong xử lý nước và nước thải Ưu điểm:
Phương pháp oxi hóa nâng cao với tác nhân oxi hóa là ozon và ozon kết hợp H2O2 hay các chất xúc tác khác có các ưu đi ểm sau:
- Thân thiện với môi trường do không tạo ra các sản phẩm phụ độc hại.
- Khả năng oxi hóa cực mạnh nên xử lý các chất hữu cơ ô nhiễm với hiệu suất cao và cả những chất cực độc mà phần lớn các phương pháp khác không hoặc khó xử lý được.
- Quá trình ozon hóa xử lý chất hữu cơ, màu và khử trùng nước.
- Ozon oxi hoá các chất hữu cơ bền vững để tăng cường khả năng loaị bỏ chúng bằng các quá trình sinh học.
Nhược điểm:
- Ozon là hợp chất không bền, thời gian tồn tại chỉ vài phút.
- O3 phải được sản xuất tại chỗ, ngay trong dây chuyền xử lý nên đòi hỏi chi phí kỹ thuật và vận hành cao.
- Các chất phân hủy gốc OH làm giảm hiệu quả phân huỷ chất ô nhiễm .
1.5. NGHIÊN CỨU XỬ LÝ NƯỚC RỈ RÁC BẰNG OZON
1.5.1. Ứng dụng ozon trong xử lý nước và nước thải
Trong những năm gần đây, trên thế giới đã có nhiều nghiên cứu và ứng dụng các quá trình ozon trong xử lý nước và nước thải, bao gồm: O3/UV, O3/H2O2, O3/TiO2, O3/xúc tác… Các quá trình trên được ứng dụng để xử lý các hợp chất hữu cơ dễ bay hơi (VOC), các hợp chất hữu cơ khó bay hơi (SVOC), polyclo biphenyl, các hóa chất bảo vệ thực vật (thuốc trừ sâu, trừ cỏ), Dioxin và Furan, thuốc nổ và các sản phẩn phân hủy của chúng, các hợp chất humic, fulvic, các chất vô cơ, thuốc nhuộm, nước thải giấy… Các quá trình oxi hóa bằng ozon cũng được ứng dụng trong xử lý các chất hữu cơ khó phân hủy trong nước cấp sinh hoạt.
Khả năng xử lý các chất ô nhiễm và khử trùng nước và nước thải bằng ozon đã có hiệu quả cao hơn các công nghệ thông thường. Một số chất ô nhiễm trong nước và nước thải mà ozon có thể xử lý đạt yêu cầu mà các công nghệ thông thường khó hoặc không xử lý được là:
- Các amino axit, thuốc kháng sinh, coliform.
- Các sản phẩm phụ khi khử trùng bằng clo.
- Nước thải chưng cất cồn, rượu, nước thải sản xuất sợi thủy tinh.
- Nước thải bệnh viện, nước thải sản xuất giấy và bột giấy.
- Nước thải chứa phenol, nước thải ngành in, nước thải dệt nhuộm, nước thải chế biến cao su.
- Nước thải thuộc da, nước thải sản xuất hóa chất bảo vệ thực vật
- Nước thải sản xuất hóa chất, nước thải mạ, xyanua.
- Các hợp chất humic và fulvic.
Trong xử lý nước thải công nghiệp, nước uống, việc ứng dụng ozon rất phổ biến. Tuy nhiên, do giá thành đầu tư và vận hành cao nên đối với nước thải công nghiệp dệt nhuộm, nước rỉ rác, hiện nay việc ứng dụng công nghệ ozon còn đang ở giai đoạn thử nghiệm và sản xuất với quy mô nhỏ. Đến năm 1997, nước Đức mới có 32 nhà máy xử lý nước rỉ rác, và 6 nhà máy xử lý nước thải dệt nhuộm bằng công nghệ ozon. Nước Anh có một số nhà máy xử lý nước rỉ rác bằng công nghệ ozon với công suất nhỏ, khoảng 200 m3/ngày [7].
Các quá trình xử lý bằng ozon vẫn đang được nghiên cứu với các quy mô khác nhau và vẫn tiếp tục được nghiên cứu thử nghiệm để mở rộng phạm vi ứng dụng của công nghệ đầy tiềm năng này.
Ở Việt Nam, hiện nay, Ozon và Perozon đang được nghiên cứu ở quy mô phòng thí nghiệm, trong đó có trường Đại học Bách khoa Hà Nội, nghiên cứu xử lý các loại nước thải khó phân hủy sinh học và xử lý tinh chế cồn. Viện Công nghệ Môi trường - Viện Hàn lâm Khoa học và Công nghệ Việt Nam cũng đã trang bị một số pilot của Nhật và Hàn Quốc cho nghiên cứu xử lý một số loại nước thải khó phân hủy sinh học. Trên thực tế, công nghệ ozon ở nước ta được ứng dụng nhiều trong xử lý hoa quả, thực phẩm, thanh trùng bằng các thiết bị ozon có công suất nhỏ.
1.5.2. Các nghiên cứu xử lý nước rỉ rác bằng ozon trên thế giớ i
Trên thế giới , vấn đề xử lý nước rỉ rác đã được nghiên cứu và được công bố trên các tạp chí hoặc các hội nghị khoa học. Đa số các nghiên cứu dựa vào các quá trình phân hủy sinh học và xử lý hóa lý, và dựa vào các quá trình phân hủy hóa học, chủ yếu là các quá trình oxi hóa nâng cao (Advanced Oxydation Processes – AOPs)
như Ozon, Perozon và Fenton.
Hầu hết các quá trình oxi hóa nâng cao trong x ử lý nước rỉ rác đều dưa
trên
các phản ứng oxi hoá trực tiếp (nhất là O 3) các chất ô nhiễm hoặ c thông qua gốc hydroxyl linh đôṇ g ( OH ). Quá trình này có thể cho phép phân huỷ chất hữu cơ mạch dài, mạch vòng thành các chất hữu cơ mạch ngắn hơn hoặc thành CO 2 và
H2O [41]. Môt
số nghiên cứ u điển hình đươc
trình bày dưới đây :
* Các nghiên cứu xử lý bằng Ozon hoặc Perozon:
Bilaa và công sự (2005) [32] đã đánh giá hiệu quả xử lý nước rỉ rác bãi chôn lấp chất thải rắn đô thị Gramacho ở Rio de Janeiro, Brazil. Nước rỉ rác có tỉ lệ BOD5/COD thấp 0,05. Ozon được sử dụng để nâng cao khả năng xử lý sinh học nước rỉ rác sau quá trình keo tụ. Sau keo tụ bằng Al2(SO4)3 ở giai đoạn 1, COD và DOC giảm tương ứng 40 và 25%. Quá trình xử lý bằng ozon sau đó đã làm tăng tỉ lệ BOD5/COD từ 0,05 lên 0,3 và đã xử lý được tương ứng 73% COD và 63% DOC với lượng O3 tiêu tốn là 3 g/l nước rỉ rác.
Ntampou và côṇ g sư ̣ (2006) [73] đã sử duṇ g ozon và keo tu ̣để xử lý nước ri
rác từ bãi chôn l ấp chất thải rắn Thessaloniki (Hy Lap
). Tác giả đã sử duṇ g hai quá
trình (ozon/keo tu ̣và keo tu ̣ /ozon) để xử lý nước rỉ rác . Kết quả ch o thấy , xử ly
bằng ozon/keo tu ̣không đaṭ đươc
hiêu
suất cao mà hiêu
suất cao chỉ đaṭ đươc
ở hê
keo tụ/ozon, COD giảm từ 1.000 mg/l xuống dư ới 180 mg/l. Tuy nhiên , thời gian phản ứng và hàm lượng oz on tiêu tốn lớn tương ứ ng 240 phút và 2 g/h cho 500 ml nước rỉ rác với hàm lượng COD nước rỉ rác là 1.000 mg/l.
Tizaoui và côṇ g s ự (2007) [96] đã xử lý nước rỉ rác từ bãi chôn l ấp Jebel Chakir (Tunisia) bằng O3 và O3/H2O2. Với nồng độ khí ozon đầu vào 80 g/m3, COD
ban đầu 5.230 mg/l. Hiêu
suất xử lý nước rỉ rác tăng gấp đôi (từ 25% lên 48%) khi
kết hơp
O 3/H2O2với nồng đô ̣ 2g H2O2/l, thời gian phản ứ ng 60 phút, tỉ lệ
BOD5/COD tăng từ 0,1 lên 0,7 ở hệ thí nghiệm O 3/H2O2. Các tác giả cũng tính chi phí để xử lý là 2,3 USD/kg COD.
Năm 2008, Frontistis và côṇ g sư ̣ [ 43] đã nghiên cứ u ảnh hưởng của các yếu tố: tải lượng chất hữu cơ (COD: 550 – 5.500 mg/l), thời gi an phản ứ ng (60 - 360 phút), nồng đô ̣O 3(19 - 38 mg/l) đến hiệu quả xử lý nước rỉ rác từ bãi chôn l ấp
Chania, Hy Lạp. Kết quả cho thấy , khi tăng tải lương COD và nồng độ O 3 đến mức
tối đa (38 mg/l khí) thì COD là yếu tố quan trọ ng nhất ảnh hưởng đến hiêu
suất xư
lý cả COD và phenol. Với COD đầu vào 5.500 mg/l trong 360 phút, nồng đô ̣khí O3
38 mg/l đã xử lý đươc
50% COD, khử đươc
màu, phenol và đôc
tố .
Nghiên cứ u xử lý nước rỉ rác (Bãi chôn lấp Tehran, Iran) với kết hơp keo tu ̣và
ozon đươc
thưc
hiên
bởi Jamali và côṇ g sư ̣ (2009) [57]. COD nước rỉ rác trư ớc xư
lý 130.000 mg/l. Kết quả nghiên cứ u cho thấy , hiêu suât́ xử lý COD và độ màu
tương ứ ng là 41% và 81%, tỉ lệ BOD5/COD tăng từ 0,36 lên 0,45, hiêu suât́ xử lý độ
màu đaṭ cao nhất là 81% ở mức hàm lượng O 3 là 180 g O3/l nước rỉ rác . Tác giả
cũng khẳng điṇ h viêc
kết hơp
keo tu ̣và ozon xử lý nước rỉ rác không mang laị hiêu
quả cao và cần được xử lý tiếp bằng than hoaṭ tính hay loc maǹ g .
Theo nghiên cứ u của Cortez và côṇ g sư ̣ (2010) [37], việc kết hơp O 3/H2O2để
xử lý nước rỉ rác (COD: 743 mg/l ở bãi chôn l ấp phía Bắc , Bồ Đào Nha , hoạt
đôṇ g từ 1998) cho hiêu suât́ xử lý các chất hữu cơ cao hơn so v ới sử duṇ g ozon