(IC50 = 9,24 µM) trong 6 dẫn xuất tiềm năng nhất. Tuy nhiên, không tạo được phức hợp bậc ba CPT-TopI-DNA như CPT thông qua liên kết hydro với dt10, làm cho 5 dẫn xuất benzimidazole và indole còn lại có hoạt tính kém hơn so với CPT. Như vậy, phát hiện của nghiên cứu này về các dẫn xuất có hoạt tính ức chế tế bào tốt có tương tác giữa ligand với các amino acid quan trọng Asp533 và Asn722 trong khoang gắn kết, cũng như việc tạo được phức hợp bậc 3 tương tự như CPT với phức hợp TopI- DNA có tính tương đồng với kết quả của các công trình đã công bố [43, 101, 116].
KẾT LUẬN VÀ KIẾN NGHỊ
KẾT LUẬN
Đã tổng hợp thành công 64 dẫn xuất benzimidazole và 14 dẫn xuất indole, trong đó, các dẫn xuất benzimidazole được tổng hợp bằng phương pháp ngưng tụ các o-phenylenediamine với các benzaldehyde trong hệ dung môi ethanol:nước (9:1), sử dụng chất oxy hóa Na2S2O5 ở điều kiện êm dịu, với hiệu suất từ 32% đến 98%; các dẫn xuất indole đã được tổng hợp thành công bằng phản ứng Mannich đa hợp phần sử dụng methanol và EG ở điều kiện phản ứng êm dịu, với hiệu suất từ 53% đến 98%.
Cấu trúc của 64 dẫn xuất benzimidazole và 14 indole đã được làm sáng tỏ bằng các phương pháp phân tích phổ như FTIR, HRMS và 1D, 2D-NMR. Trong đó có:
+ 16 hợp chất benzimidazole hoàn toàn mới, đã được tác giả công bố: 2-iodo- 6-methoxy-4-(5(6)-methyl-1H-benzoimidazol-2-yl)-phenol (2IV), [2-(3-Hydroxy- phenyl)-1H-benzoimidazol-5-yl]-phenyl-methanone (53H), [2-(4-Hydroxy-phenyl)- 1H-benzoimidazol-5-yl]-phenyl-methanone (54H), phenyl-[2-(3,4,5-trimethoxy- phenyl)-1H-benzoimidazol-5-yl]-methanone (5TM), [2-(2-Nitrophenyl)-1H- benzoimidazol-5-yl](phenyl)methanone (52N), Phenyl(2-(2- (trifluoromethyl)phenyl)-1H-benzoimidazol-5-yl)methanone (5TF), (2-(4-Hydroxy- 3-iodo-5-methoxyphenyl)-1H-benzoimidazol-5-yl)(phenyl)methanone (5IV), 2-(5-
(hydroxy(phenyl)methyl)-1H-benzoimidazol-2-yl)phenol (62H), 3-(5-
(hydroxy(phenyl)methyl)-1H-benzo[d]imidazol-2-yl)phenol (63H), 4-(5- (hydroxy(phenyl)methyl)-1H-benzo[d]imidazol-2-yl)phenol (64H), [2-(4-Methoxy- phenyl)-1H-benzoimidazol-5-yl]-phenyl-methanol (6MM), Phenyl-[2-(3,4,5- trimethoxy-phenyl)-1H-benzoimidazol-5-yl]-methanol (6TM), [2-(4- Dimethylamino-phenyl)-1H-benzoimidazol-5-yl]-phenyl-methanol (6DA), phenyl(2-(2-(trifluoromethyl)phenyl)-1H-benzo[d]imidazol-5-yl)methanol (6TF), 4- [5-(Hydroxy-phenyl-methyl)-1H-benzoimidazol-2-yl]-2-iodo-6-methoxy-phenol (6IV), [2-(4-Benzyloxy-phenyl)-1H-benzoimidazol-5-yl]-phenyl-methanol (6BO).
Có thể bạn quan tâm!
-
![Bromo-3-[(4-Methoxy-Phenyl)-Pyrrolidin-1-Yl-Methyl]-1H-Indole (Bpm)](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Bromo-3-[(4-Methoxy-Phenyl)-Pyrrolidin-1-Yl-Methyl]-1H-Indole (Bpm)
Bromo-3-[(4-Methoxy-Phenyl)-Pyrrolidin-1-Yl-Methyl]-1H-Indole (Bpm) -
 Mối Quan Hệ Giữa Cấu Trúc Của Các Dẫn Xuất Benzimidazole Tổng Hợp Và Hoạt Tính Ức Chế Tế Bào Ung Thư
Mối Quan Hệ Giữa Cấu Trúc Của Các Dẫn Xuất Benzimidazole Tổng Hợp Và Hoạt Tính Ức Chế Tế Bào Ung Thư -
 Các Mô Hình Gắn Kết Phân Tử Docking Của Các Dẫn Xuất Benzimidazole Và Indole
Các Mô Hình Gắn Kết Phân Tử Docking Của Các Dẫn Xuất Benzimidazole Và Indole -
 Nghiên cứu tổng hợp và đánh giá hoạt tính gây độc tế bào các dẫn xuất của benzimidazole và indole - 22
Nghiên cứu tổng hợp và đánh giá hoạt tính gây độc tế bào các dẫn xuất của benzimidazole và indole - 22 -
 Nghiên cứu tổng hợp và đánh giá hoạt tính gây độc tế bào các dẫn xuất của benzimidazole và indole - 23
Nghiên cứu tổng hợp và đánh giá hoạt tính gây độc tế bào các dẫn xuất của benzimidazole và indole - 23
Xem toàn bộ 186 trang tài liệu này.
+ 5 hợp chất indole hoàn toàn mới: 3-(piperidin-1-ylmethyl)-1H-indole-2- carboxylic acid (CIF), 3-[(4-Methoxy-phenyl)-pyrrolidin-1-yl-methyl]-1H-indole-2- carboxylic acid (CPM), 3-[(4-Methoxy-phenyl)-morpholin-4-yl-methyl]-1H-indole- 2-carboxylic acid (CMM), 3-[(4-Methoxy-phenyl)-piperidin-1-yl-methyl]-1H-

indole-2-carboxylic acid (CIM), 3-[(4-Methoxy-phenyl)-pyrrolidin-1-yl-methyl]-2- phenyl-1H-indole (PPM) (theo SciFinder, tháng 08 năm 2021).
Đã đánh giá hoạt tính ức chế tế bào ung thư của 64 dẫn xuất benzimidazole và 14 dẫn xuất indole trên ba dòng A549 (ung thư phổi), MDA-MB-231 (ung thư vú) và PC3 (ung thư tuyến tiền liệt). Giá trị IC50 của các dẫn xuất thu được trong khoảng 8,83 đến lớn hơn 100 µM, dẫn xuất benzimidazole có hoạt tính tốt nhất là 53H với IC50 từ 14,24 – 17,52 µM và dẫn xuất indole có hoạt tính tốt nhất là BPM với IC50 từ 8,83 – 9,24 µM trên cả ba dòng tế bào thử nghiệm.
Các kết quả thu được đã được thảo luận để rút ra một số mối tương quan giữa cấu trúc và hoạt tính gây độc tế bào trong nghiên cứu như sau:
(i) Các dẫn xuất 2-phenylbenzimidazole có xu hướng ức chế tốt dòng tế bào MDA-MB-231 hơn hai dòng tế bào A549 và PC3. Một nguyên tử chloro được gắn vị trí số 5 trên khung benzimidazole, cùng với sự hiện diện của các nhóm thế đẩy điện tử (OH, -OCH3, -N(CH3)2, -O-CH2-Ph) trên vòng benzene ở vị trí số 2 đã dẫn đến việc gia tăng hoạt tính ức chế tế bào ung thư, hai nguyên tử chloro cùng hiện diện ở vị trí 5 và 6 lại làm giảm hoạt tính gây độc tế bào của dẫn xuất. Nhóm thế benzoyl ở vị trí số 5 làm tăng hoạt tính kháng ung thư. Nhóm thế rút điện tử (-NO2 và CF3) ở vị trí 2’ trên vòng benzene ở vị trí số 2 trên khung benzimidazole hầu như làm giảm hoạt tính gây độc tế bào của các dẫn xuất chứa chúng, không mang lại hiệu quả trong việc cải thiện hoạt tính ức chế tế bào ung thư.
(ii) Các dẫn xuất 3-aminoalkylated indole không có khả năng ức chế tốt dòng tế bào ung thư tuyến tiền liệt PC3. Ngoài ra, các dẫn xuất indole này còn thể hiện một đặc điểm chung đó là khả năng ức chế đồng đều trên cả 3 dòng tế bào ung thư thử nghiệm, giá trị IC50 của chúng tương đồng nhau: hoặc đều lớn hơn 100 µM, hoặc xấp xỉ bằng nhau. Sự có mặt của nhóm carboxyl ở vị trí số 2 không cần thiết cho hoạt tính ức chế tế bào ung thư của các dẫn xuất 3-aminoalkylated indole, ngược lại, nguyên tử bromo làm tăng hoạt tính của dẫn xuất. Nhóm thế đẩy điện tử (methoxy) trên vòng benzene trong hợp phần benzaldehyde đã đóng góp vào việc làm tăng hoạt tính chung của dẫn xuất 3-aminoalkylated indole và đóng góp này lớn hơn so với nhóm thế rút điện tử (chloro). Khi kết hợp với sự hiện diện của hợp phần 4-methoxybenzaldehyde, các dẫn xuất indole chứa pyrrolidine (ngoại trừ CPM) đã thể hiện sự vượt trội về hoạt
tính ức chế tế bào ung thư hơn, so với các dẫn xuất indole chứa amine vòng no khác (morpholine, 1-methylpiperazine hoặc piperidine).
Bốn dẫn xuất 53H, 5MM, IPM và BPM có hoạt tính gây độc tế bào ung thư tốt nhất, thể hiện khả năng ức chế tế bào HEK 293 (tế bào thận gốc phôi ở người) với giá trị IC50 từ 17,94 đến 89,87 µM, đều cao hơn so với chứng dương camptothecin IC50 = 1,41 µM. Điều này cho thấy các dẫn xuất benzimidazole và indole này có tiềm năng cao trở thành các tác nhân chống ung thư mới, độc tính trên tế bào thường thấp hơn 12 đến 63 lần so với tác nhân chống ung thư đang có camptothecin.
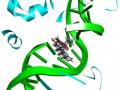
Mô hình mô tả phân tử docking được thực hiện giữa phức hợp TopI-DNA (PDB ID: 1T8I) và các các dẫn xuất benzimidazole và indole có hoạt tính tốt nhất, để đề xuất cơ chế ức chế tế bào ung thư của các dẫn xuất này. Đặc điểm chung của các dẫn xuất có hoạt tính ức chế tế bào ung thư tốt nhất 5MM, 53H, BPM là chúng đều tạo liên kết hydro với amino acid Asp533 và Asn722 trong khoang gắn kết, và gắn kết xen kẽ vào phức hợp TopI-DNA, tương tự như cách thức gắn kết của CPT vào phức hợp này.
KIẾN NGHỊ
Tiếp tục nghiên cứu phản ứng alkyl hóa các benzimidazole có hoạt tính ức chế tế bào ung thư tốt, ảnh hưởng của mạch carbon tới hoạt tính sinh học, xác định đồng phân quang học của các chất mới và có hoạt tính sinh học tốt. Mở rộng sử dụng phản ứng Mannich ghép 3 hợp phần trên khung benzimidazole ở vị trí số 1. Tiếp tục nghiên cứu phản ứng Mannich ba hợp phần trên phản ứng với indole, sử dụng các benzaldehyde khác khác nhau và các indole có tính acid cao hơn để nghiên cứu khả năng phản ứng của chúng, kết hợp với tổng hợp các bisindole tương ứng để so sánh ảnh hưởng của amin đến hoạt tính ức chế tế bào ung thư trên các sản phẩm Mannich indole ba hợp phần.
Nghiên cứu tiếp các hoạt tính gây độc trên các dòng tế bào ung thư khác, kháng nấm, kháng khuẩn và kháng virus trên các dẫn xuất benzimidazole và indole đã tổng hợp; khả năng tạo phức của chúng với các kim loại nhằm chế tạo sensor chọn lọc kim loại.
151
Tiếp tục nghiên cứu mở rộng xây dựng mô hình docking để có thể sàng lọc in silico các dẫn xuất benzimidazole, indole, cũng như các cấu trúc thuốc khác, với đích tác động là phức hợp TopI-DNA nhằm tìm kiếm các tác nhân điều trị ung thư mới.
DANH MỤC CÁC CÔNG TRÌNH ĐÃ CÔNG BỐ
Trong nước
1. Huynh Thi Kim Chi, Nguyen Thi Hong An, Ly Thi Chanh Tri, Le Anh Thy, Ngo Ngoc Dung, Do Thi Hong Tuoi, Hoang Thi Kim Dung, Rapid and green synthesis of some benzimidazole and indole derivatives as novel anticancer agents, Tạp chí Hóa học, 2018, 56(6E1), 336-341.
2. Huynh Thi Kim Chi, Nguyen Thi Hong An, Tran Ngoc Hoang Son, Hoang Thi Kim Dung, Convenient synthesis, characterization and tyrosinase inhibitory property of 2-phenyl-1H-benzimidazoles, Tạp chí Hóa học, 2019, 57(4e3,4), 350- 354.
Quốc tế
1. Thi-Kim-Chi Huynh, Thi-Hong-An Nguyen, Ngoc-Hoang-Son Tran, Thanh- Danh Nguyen, Thi-Kim-Dung Hoang, A facile and efficient synthesis of benzimidazole as potential anticancer agents, Journal of Chemical Sciences, 2020, 132 (84), 1-9 (Q3, IF = 1,573)
2. Thi-Kim-Chi Huynh, Thi-Hong-An Nguyen, Thi-Cam-Thu Nguyen, Thi-Kim- Dung Hoang, Synthesis and insight into the structure–activity relationships of 2- phenylbenzimidazoles as prospective anticancer agents, RSC Advances, 2020, 10, 20543–20551 (Q1, IF = 3,361)
3. Thi-Kim-Chi Huynh, Kim-Khanh-Huy Ngo, Hoang-Phuc Nguyen, Hoai-Khanh Dang, Van-Trung Phung, Khac-Minh Thai, Thi-Kim-Dung Hoang, Catalyst-free and multicomponent synthesis of 3-aminoalkylated indoles via Mannich-type reaction: multitargeted anticancer, tyrosinase and α-glucosidase inhibitory activities, New Journal of Chemistry, 2021, 45, 18183-18191 (Q1, IF = 3,591)
TÀI LIỆU THAM KHẢO
1. D. G. Brown and H. J. Wobst, A Decade of FDA-Approved Drugs (2010– 2019): Trends and Future Directions, J. Med. Chem., 2021, 64 (5), 2312– 2338.
2. B. W. Stewart and P. Kleihues, World cancer report, 2003,
3. D. Basile, V. Pelizzari, M. Vitale and F. Puglisi, Most frequent toxicity and new side effects of novel drugs and treatments in breast cancer, VI European conference on cured and chronic cancer patients, 2016.
4. D. V. LaBarbera and E. B. Skibo, Synthesis of imidazo [1, 5, 4-de] quinoxalin- 9-ones, benzimidazole analogues of pyrroloiminoquinone marine natural products, Bioorg. Med. Chem., 2005, 13 (2), 387-395.
5. S. Yadav, D. Sinha, S. K. Singh and V. K. Singh, Novel benzimidazole analogs as inhibitors of EGFR tyrosine kinase, Chem. Biol. Drug. Des., 2012, 80 (4), 625-630.
6. P. Luder, B. Siffert, F. Witassek, F. Meister and J. Bircher, Treatment of hydatid disease with high oral doses of mebendazole, Eur. J. Clin. Pharmacol., 1986, 31 (4), 443-448.
7. G. Sathaiah, A. R. Kumar, A. C. Shekhar, K. Raju, P. S. Rao, B. Narsaiah, A.
R. Reddy, D. Lakshmi and B. Sridhar, Design and synthesis of positional isomers of 1-alkyl-2-trifluoromethyl-5 or 6-substituted benzimidazoles and their antimicrobial activity, Med. Chem. Res., 2013, 22 (3), 1229-1237.
8. P. A. Willumsen, J. E. Johansen, U. Karlson and B. M. Hansen, Isolation and taxonomic affiliation of N-heterocyclic aromatic hydrocarbon-transforming bacteria, Appl. Microbiol. Biotechnol., 2005, 67 (3), 420-428.
9. M. Tonelli, M. Simone, B. Tasso, F. Novelli, V. Boido, F. Sparatore, G. Paglietti, S. Pricl, G. Giliberti and S. Blois, Antiviral activity of benzimidazole derivatives. II. Antiviral activity of 2-phenylbenzimidazole derivatives, Bioorg. Med. Chem., 2010, 18 (8), 2937-2953.
10. S. N. Young, How to increase serotonin in the human brain without drugs, J. Psychiatry Neurosci., 2007, 32 (6), 394-399.
11. C. G. Varricchio, T. B. Ades and P. S. Hinds, A cancer source book for nurses, Jones & Bartlett Learning, 2004.
12. Cancer Facts & Figures 2020, Report, A. C. Society, 2020.
13. C. H. Nguyễn, Cẩm nang phòng trị ung thư, NXB Tổng hợp Thành phố Hồ Chí Minh, Thành phố Hồ Chí Minh, 2021.
14. Đ. S. Lê, Bách khoa Y học - Bệnh học ung thư, Đại học Y khoa Hà Nội, 2010.
15. Y. T. Lee, Y. J. Tan and C. E. Oon, Molecular targeted therapy: treating cancer with specificity, Eur. J. Pharmacol., 2018, 834 188-196.
16. L. Zhong, Y. Li, L. Xiong, W. Wang, M. Wu, T. Yuan, W. Yang, C. Tian, Z. Miao and T. Wang, Small molecules in targeted cancer therapy: advances, challenges, and future perspectives, Signal Transduct. Target. Ther., 2021, 6 (1), 1-48.
17. S. Hoelder, P. A. Clarke and P. Workman, Discovery of small molecule cancer drugs: successes, challenges and opportunities, Mol. Oncol., 2012, 6 (2), 155- 176.
18. T. Hideshima, J. Qi, R. M. Paranal, W. Tang, E. Greenberg, N. West, M. E. Colling, G. Estiu, R. Mazitschek and J. A. Perry, Discovery of selective small- molecule HDAC6 inhibitor for overcoming proteasome inhibitor resistance in multiple myeloma, Proc. Natl. Acad. Sci., 2016, 113 (46), 13162-13167.
19. F. Breedveld, Therapeutic monoclonal antibodies, The Lancet, 2000, 355 (9205), 735-740.
20. P. Khongorzul, C. J. Ling, F. U. Khan, A. U. Ihsan and J. Zhang, Antibody– drug conjugates: a comprehensive review, Mol. Cancer Res., 2020, 18 (1), 3- 19.
21. M. Saxena, S. H. van der Burg, C. J. Melief and N. Bhardwaj, Therapeutic cancer vaccines, Nat. Rev. Cancer., 2021, 21 (6), 360-378.
22. M. Montađo-Samaniego, D. M. Bravo-Estupiđan, O. Méndez-Guerrero, E. Alarcón-Hernández and M. Ibáđez-Hernández, Strategies for Targeting Gene Therapy in Cancer Cells With Tumor-Specific Promoters, Front. Oncol., 2020, 10 2671.
23. J. B. Wright, The chemistry of the benzimidazoles, Chem. Rev., 1951, 48 (3), 397-541.
24. N. Srestha, J. Banerjee and S. Srivastava, A review on chemistry and biological significance of benzimidazole nucleus, IOSR J. Pharm., 2014, 4 (12), 28-41.

![Bromo-3-[(4-Methoxy-Phenyl)-Pyrrolidin-1-Yl-Methyl]-1H-Indole (Bpm)](https://tailieuthamkhao.com/uploads/2022/09/02/nghien-cuu-tong-hop-va-danh-gia-hoat-tinh-gay-doc-te-bao-cac-dan-xuat-18-120x90.jpg)