199,11 7 ,60 | 18,74 0,07 | |
Dihydromyricetin | _ | 374,47 2,69 |
Cynaroside | 83,30 3,28 | 21,52 2,33 |
Vernonioside E | _ | 351,26 6,21 |
Có thể bạn quan tâm!
-
 Đường Huyết Của Chuột Đtđ Type 2 Sau 21 Ngày Điều Trị Bằng Cao Chiết Thực Vật
Đường Huyết Của Chuột Đtđ Type 2 Sau 21 Ngày Điều Trị Bằng Cao Chiết Thực Vật -
 Cấu Trúc Của Dihydromyricetin (Cde2)
Cấu Trúc Của Dihydromyricetin (Cde2) -
 Phần Trăm Hàm Lượng Cao Của Các Cao Chiết Phân Đoạn Lá Đắng
Phần Trăm Hàm Lượng Cao Của Các Cao Chiết Phân Đoạn Lá Đắng -
 Kết Quả Cao Hỗn Hợp Nguồn Gốc Từ Thực Vật Có Khả Năng Hạ Đường Huyết
Kết Quả Cao Hỗn Hợp Nguồn Gốc Từ Thực Vật Có Khả Năng Hạ Đường Huyết -
 Kết Quả Đánh Giá Số Chuột Chết Ở Các Nhóm Thử Nghiệm Sau Khi Uống Cao Hỗn Hợp
Kết Quả Đánh Giá Số Chuột Chết Ở Các Nhóm Thử Nghiệm Sau Khi Uống Cao Hỗn Hợp -
 Nghiên cứu phân lập và tác dụng điều trị bệnh đái tháo đường type 2 của các hoạt chất sinh học từ một số loài thực vật thu hái tại miền Trung - 18
Nghiên cứu phân lập và tác dụng điều trị bệnh đái tháo đường type 2 của các hoạt chất sinh học từ một số loài thực vật thu hái tại miền Trung - 18
Xem toàn bộ 205 trang tài liệu này.
Kết quả ở bảng 3.11 cho thấy sự ức chế enzyme α-amylase và glucosidase từ 7 hợp chất được phân lập từ cây chè dây và lá đắng, trong đó có 5 hợp chất thể hiện hoạt tính ức chế 2 enzyme này khá tốt. Khả năng ức chế của các hợp chất với enzyme α-amylase và α-glucosidase được xác định bằng nồng độ ức chế 50% (IC50). Cả 5 hợp chất: Myricitrin; quercetin; myricetin; phloretin; cynaroside đều thể hiện hoạt tính ức chế 2 enzyme này khá mạnh khi so với thuốc Acarbose. Kết quả về giá trị IC50 đối với enzyme α-amylase cho thấy myricitrin có giá trị IC50 nhỏ nhất (IC50 = 9,64 µM ), tiếp đến là cynaroside; myricetin; quercetin và phloretin với giá trị IC50 lần lượt là: 83,30; 86,31; 136,58 và 199,11 µM. Tương tự, kết quả về về khả năng ức chế enzyme α-glucosidase theo thứ tự lần lượt là myricitrin (8.92 µM), myricetin (9.20 µM), quercetin (10.64 µM ), phloretin (18.74 µM) và cynaroside (21,52 µM). Riêng đối với dihydromyricetin và vernonioside E thể hiện khả năng ức chế yếu đối với hoạt động của enzyme α-glucosidase và không có tác dụng ức chế enzyme α-amylase. Một số chất phân lập được đã có các báo cáo cho thấy khả năng ức chế enzyme α-amylase và α-glucosidase [103]. Trong đó khả năng ức chế enzyme α-amylase và α- glucosidase của myricitrin và cynaroside là phù hợp với các nghiên cứu trước đây [103], [96].
Đây là một trong những điểm mới mà đề tài luận án đã thực hiện được khi nghiên cứu về cơ chế hạ đường huyết trên hai đối tượng chè dây và lá đắng. So với các số liệu IC50 của các hợp chất trong bảng tổng hợp 1.6 và IC50 của acarbose, chúng tôi nhận thấy IC50 của các chất tinh sạch này là tương đối thấp, điều này khẳng định hoạt tính ức chế enzym α-amylase và α-glucosidase của các chất tinh sạch là khá mạnh. Từ các kết quả trình bày trên cho thấy, các hợp chất phân lập từ chè dây và lá đắng có khả năng điều trị ĐTĐ theo cơ chế ức chế hoạt động của enzyme thủy phân
tinh bột là α-amylase và α-glucosidase, góp phần giải thích cho hoạt tính hạ đường huyết của cao cồn tổng cũng như các cao chiết phân đoạn của chè dây và lá đắng.
3.4.5. Hoạt động chống viêm và cải thiện tính kháng insulin của các hợp chất phân lập từ chè dây và lá đắng
3.4.5.1. Kết quả ảnh hưởng của các hợp chất phân lập từ chè dây và lá đắng lên khả năng sống sót của dòng tế bào Raw 264.7 và 3T3-L1
Kết quả thử hoạt tính gây độc lên dòng tế bào Raw 264.7 và 3T3-L1 của các hợp chất phân lập được từ chè dây (myricetin; dihydromyricetin; phloretin; myricitrin và quercetin) và lá đắng (cynaroside và vernonioside E) được trình bày ở hình 3.19 và 3.20. Từ kết quả cho thấy, các hợp chất myricetin; dihydromyricetin; phloretin; myricitrin; quercetin; cynaroside và vernonioside E không có khả năng gây độc với tế bào Raw 264.7 và 3T3-L1 ở các nồng độ 5-40 µg/mL.
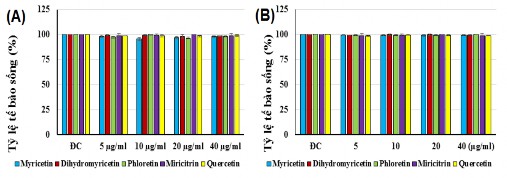
Hình 3.19. Đánh giá khả năng gây độc của các hợp chất chè dây đối với Raw 264.7
(A) và 3T3-L1 (B)
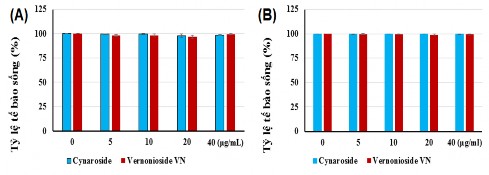
Hình 3.20. Đánh giá khả năng gây độc của các hợp chất lá đắng đối với Raw 264.7
(A) và 3T3-L1 (B)
3.4.5.2. Khả năng kháng viêm của các hợp chất phân lập từ chè dây và lá đắng LPS kích hoạt thụ thể trong các đại thực bào để tạo ra sự biểu hiện của các chất trung gian gây viêm như các cytokine tiền viêm (IL-1β, IL-6 và TNF-α) và các cytokine chống viêm (IL-10) [164]. Trong số 7 hợp chất phân lập được từ cây chè dây và lá đắng hợp chất phloretin (chè dây) và vernonioside E (lá đắng) có khả năng ức chế hiệu quả đến quá trình sinh các cytokine tiền viêm TNF-α, IL-6, IL-8 so với các hợp chất myricetin; dihydromyricetin; quercetin; myricitrin và cynaroside. Tất cả các hợp chất phân lập không ức chế cytokine kháng viêm IL-10, kết quả thí nghiệm
được trình bày ở hình 3.21 và 3.22.
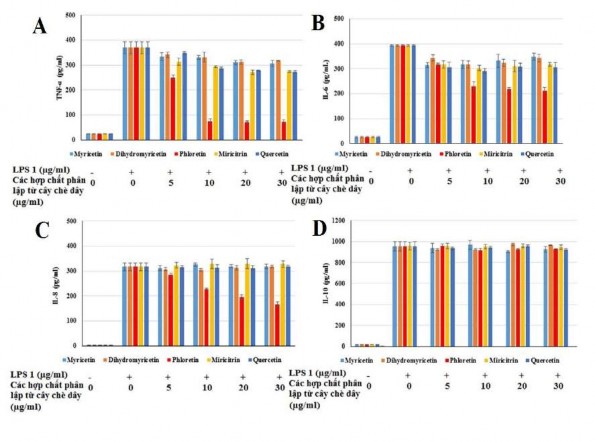
Hình 3.21. Ảnh hưởng của các hợp chất phân lập từ cây chè dây lên quá trình sản xuất TNF-α (A), IL-6 (B), IL-8 (C) và IL-10 (D) trong tế bào Raw 264.7 được kích thích bằng LPS
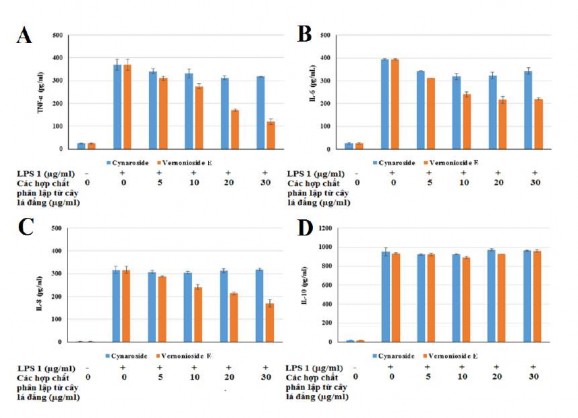
Hình 3.22. Ảnh hưởng của các hợp chất phân lập từ cây lá đắng lên quá trình sản xuất TNF-α (A), IL-6 (B), IL-8 (C) và IL-10 (D) trong tế bào Raw 264.7 được kích thích bằng LPS
Tế bào đã được ủ với LPS sẽ làm tăng đáng kể hàm lượng cytokine (IL-6, IL-8, TNF-α và IL-10) khi so với tế bào không được xử lý bởi LPS. Điều trị các tế bào với nồng độ khác nhau (5-30 µg/mL) của phloretin và vernonioside E làm giảm đáng kể nồng độ IL-6, IL-8, TNF-α). Mức độ sản sinh TNF-α trong các tế bào sau khi được điều trị bằng hợp chất phloretin và vernonioside E từ 250,63 và 310,49 pg/ml ở nồng độ 5 μg/ml giảm xuống còn 72,89 và 119,56 pg/ml ở nồng độ 30 μg/ml. Sau khi điều trị phloretin và vernonioside E, quá trình sinh IL-6 giảm xuống còn 211,53 và 219,86 pg/ml ở nồng độ 30 μg/ml và cũng cho thấy tác dụng ức chế tế bào sản sinh IL-8 ở nồng độ 30 μg/ml (166,58 và 170,18 pg/ml). Ngược lại, phloretin và vernonioside E không ức chế cytokine kháng viêm IL-10. Trong khi đó, các hợp chất myricetin; dihydromyricetin; quercetin; myricitrin và cynaroside cho thấy hiệu quả ức chế các cytokine yếu và không ức chế cytokine kháng viêm IL-10. Kết quả thực
nghiệm cho thấy phloretin và vernonioside E thể hiện rò khả năng ức chế tế bào miễn dịch sản sinh TNF-α, IL-6 và IL-8 ở nồng độ 30 µg/ml. Như vậy, có thể khẳng định phloretin và vernonioside E là hoạt chất chính trong cao chiết cồn 700 của chè dây và lá đắng gây ức chế các cytokine tiền viêm TNF- α, IL-6 và IL-8. Tác dụng chống viêm của phloretin đã được nghiên cứu trên thế giới, với liều 10 μM phloretin ức chế đáng kể nồng độ NO, PGE2, IL-6, TNF-α, iNOS và COX-2 [53], trong khi đó vernonioside E là lần đầu tiên được báo cáo về hoạt tính chống viêm. Myricetin; quercetin; dihydromyricetin đã được công bố về hoạt tính chống viêm với khả năng làm giảm đáng kể nồng độ TNF-α và IL-6 [56], [94], [95]. Tuy nhiên kết quả nghiên cứu của chúng tôi cho thấy sự không đồng nhất với các kết quả nghiên cứu trước đó, vì vậy vai trò thật sự của các hợp chất này đối với ức chế các cytokine tiền viêm cần được làm rò hơn trong các nghiên cứu sâu hơn.
3.4.5.3. Hiệu quả của phloretin và vernonioside E trong giảm tính kháng insulin
ở tế bào 3T3-L1 gây ra bởi TNF-α
Để gây kháng insulin, tế bào sẽ được bất hoạt insulin bởi TNF-α, từ đó để kiểm tra tác dụng của phloretin đối với độ nhạy insulin trong tế bào 3T3-L1. Quá trình kháng insulin trong các tế bào mô mỡ đã được chỉ ra có mối liên hệ với đáp ứng viêm, đặc biệt là với TNF-α đã ngăn chặn biểu hiện của nhiều protein trong tế bào mỡ như IR, IRS và GLUT4 dẫn tới giảm hấp thu glucose khi kích thích bằng insulin [51], [107]. Trong số hai hợp chất thử nghiệm phloretin và vernonioside E, chỉ có phloretin có khả năng giảm tính kháng insulin trong tế bào mô mỡ 3T3-L1 thông qua khả năng hấp thụ lượng đường và kết quả được trình bày ở hình 3.23. Tế bào mô mỡ kháng insulin được xử lý bằng phloretin (40 µg/ml) có khả năng hấp thụ lượng đường tăng (85,22 %) so với khi tế bào bị kháng insulin không được xử lý bằng phloretin (39,45
%). Do đó, phloretin đã cải thiện khả năng hấp thu đường đáng kể trong các tế bào 3T3-L1 kháng insulin. Hợp chất phloretin lần đầu tiên được nghiên cứu về tác dụng giảm tính kháng insulin ở tế bào 3T3-L1 gây ra bởi TNF-α.
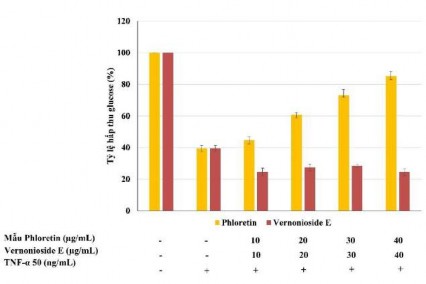
Hình 3.23. Hoạt động giảm tính kháng insulin của hợp chất phloretin và vernonioside E trong tế bào 3T3-L1 được xử lý với TNF-α
3.4.5.4. Tác động của phloretin đối với biểu hiện p-IRS1 và Y20 trong con
đường tín hiệu hoạt động insulin
Kết quả tác động của phloretin đối với biểu hiện p-IRS1 và Y20 trong con đường tín hiệu hoạt động insulin được trình bày ở hình 3.24.
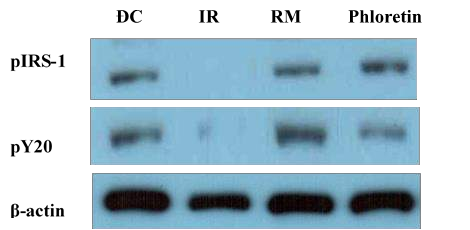
Hình 3.24. Ảnh hưởng của phloretin lên mức độ biểu hiện của hai protein IRS1
và pY20
Ghi chú: Các mức độ biểu hiện khác nhau của quá trình phosphoryl hóa thụ thể p-IRS1 và phosphoryl hóa tyrosin pY20. IR: tế bào bị bất hoạt insulin; RM: nhóm tế bào được ủ với thuốc rosiglitazone; ĐC: nhóm tế bào bình thường; Phloretin: nhóm tế bào được ủ với phloretin. Các thí nghiệm đều lập lại ba lần.
Từ kết quả hình 3.23 cho thấy cả hai protein (IRS-1 và Y20) được biểu hiện rò ràng (sau khi ủ với phloretin và rosiglitazone-RM) hoặc không biểu hiện (không ủ với phloretin) ở tế bào kháng insulin (IR), điều này chỉ ra rằng có sự gián đoạn trong con đường truyền tín hiệu insulin như báo cáo trước đây của Solomon và cộng sự [141]. Sau khi điều trị bằng phloretin (200 µg/mL) và rosiglitazone (120 𝜇M) đã cho thấy làm tăng biểu hiện của cả hai protein Y20 và IRS-1 ở các tế bào kháng insulin. Biểu hiện của Y20 mạnh sau khi ủ với phloretin đã cung cấp cơ sở chứng minh cho khả năng tiềm tàng của phloretin trong tăng khả năng nhạy cảm của tế bào đối với tín hiệu insulin. Biểu hiện IRS-1 cũng được quan sát trong các tế bào bình thường và ở tế bào điều trị bằng phloretin và rosiglitazone. Trong khi đó, không có dải IRS-1 nào được quan sát thấy trong các tế bào kháng insulin không được điều trị. Các tế bào được điều trị với rosiglitazone và phloretin đã cho thấy có thể khôi phục các biểu hiện của IRS-1. Như vậy, phloretin có hiệu quả trong con đường truyền tín hiệu insulin thông qua phục hồi biểu hiện của hai protein Y20 và IRS-1, điều này sẽ dẫn đến sự dịch chuyển của GLUT-4 để tăng sự hấp thu glucose vào trong tế bào. Các tác dụng hạ đường huyết của phloretin thông qua khôi phục biểu hiện hai protein IRS-1 và Y20 của tế bào chưa từng được được báo cáo trước đây.
3.4.6. Thảo luận về cơ chế hạ đường huyết của các hợp chất phân lập từ cây chè dây và lá đắng
Phương pháp điều trị ĐTĐ hiện nay tập trung vào việc kiểm soát và giảm nồng độ đường huyết trong mức bình thường. Cơ chế của cả thuốc hiện đại và thuốc cổ truyền nhằm giảm nồng độ đường huyết trong máu là: (1) để kích thích tế bào beta của đảo tụy tiết ra nhiều insulin; (2) ức chế hoạt động của các hormone làm tăng nồng độ glucose trong máu; (3) tăng độ nhạy của vị trí thụ thể insulin; (4) ức chế quá trình thủy phân glycogen ở gan; giảm hấp thu carbohydrate ở ruột non thông qua ức chế enzyme α-glucosidase và α-amylase; (5) tăng cường sử dụng glucose trong mô và cơ quan; (6) chống quá trình oxy hóa, chống lại sự peroxy hóa các lipid và sửa chữa rối loạn trao đổi lipid và protein [153]. Các hợp chất chống ĐTĐ, có thể có tác dụng hiệu quả theo một hay nhiều cơ chế hạ đường huyết kể trên.
Điều chỉnh đường huyết sau ăn trở thành một hướng điều trị phổ biến ở bệnh nhân ĐTĐ type 2. Ức chế α-glucosidase và α-amylase đã được xem là đích mục tiêu để làm chậm lại quá trình hấp thu đường vào máu từ quá trình phân hủy carbohydrate của thức ăn, cho phép tuyến tụy có thêm thời gian để tăng tiết insulin để đáp ứng với sự gia tăng nồng độ đường trong máu. Hiện nay, có ba chất ức chế α-glucosidase và α-amylase có sẵn được sử dụng làm thuốc trị đái tháo đường: acarbose, miglitol và voglibose. Tuy nhiên, các thuốc này có một số tác dụng phụ phổ biến nhất là đầy hơi, tiêu chảy và tăng men gan [106]. Có rất nhiều hoạt chất tham gia ức chế α-glucosidase và α-amylase được tìm thấy trong thực vật, như các terpene, alkaloid, flavonoid, glycoside, phenol…được cho là tác dụng phụ ít hơn so với các thuốc hóa dược. Trong nghiên cứu này, kết quả ức chế chế enzym α-glucosidase và α-amylase của 7 hợp chất phân lập được từ cây chè dây và lá đắng cho thấy: Myricitrin; quercetin; myricetin; phloretin và cynaroside đều thể hiện hoạt tính ức chế 2 enzyme này khá mạnh khi so với thuốc Acarbose, trong khi đó 2 hợp chất dihydromyricetin và vernonioside E thể hiện khả năng ức chế yếu đối với hoạt động của enzyme α-glucosidase và không có tác dụng ức chế enzyme α-amylase. Như đã trình bày ở trên, một số hợp chất phân lập từ chè dây và lá đắng không có tác dụng tốt trong việc ức chế enzym α-glucosidase và α-amylase, tuy nhiên các hợp chất này có thể tác dụng tốt theo một cơ chế khác, vì vậy, chúng tôi tiếp tục tiến hành nghiên cứu các cơ chế hạ đường huyết khác của các hợp chất này để từ đó làm sáng tỏ thêm về tác dụng hạ đường huyết của cây chè dây và lá đắng.
Nhiều nghiên cứu cho thấy rằng viêm mãn tính có liên quan đến sinh lý bệnh của bệnh ĐTĐ type 2 và do đó việc nghiên cứu nhắm vào mục tiêu điều trị tình trạng viêm có thể cải thiện được kháng insulin ở bệnh ĐTĐ type 2, ngăn chặn sự tiến triển cũng như biến chứng của bệnh [122]. Nhiều công trình nghiên cứu cũng đã chứng minh rằng các chất trung gian gây viêm hoạt hóa kinase serine bao gồm IκB kinase (IKK-β), c-Jun kinase NH2 ở đầu tận cùng (c-Jun NH2-terminal kinase -JNK), những kinase này ức chế hoạt động của insulin bằng cách thúc đẩy sự phosphoryl hóa serine của con đường truyền tín hiệu insulin, bao gồm protein IR và IRS-1 làm suy yếu tín hiệu insulin và gây kháng insulin [125]. Các hoạt động chống viêm của flavonoid