Nhỏ lên tới miệng | Vàng | Xanh | |
MEL | Nhỏ lên tới miệng | Vàng | Xanh |
AMY | Nhỏ lên tới miệng | Vàng | Xanh |
ARA | Nhỏ lên tới miệng | Vàng | Xanh |
O/F | Cấy vk vào 2 ống nghiệm chứa mt OF, một trong 2 ống phủ kín bằng lớp dầu parafin | Vàng | Xanh |
Oxidase | Bôi vk lên miếng giấy lọc đã tẩm thuốc thử . Đọc kq sau 10-30s. | Màu xanh tím | Không đổi màu |
Catalase | Lấy vk lên lam rồi nhỏ 1-2 giọt H2O2 30% lên . | Có bọt khí sủi lên | Không có bọt khí |
Có thể bạn quan tâm!
-
 Nghiên cứu khả năng gây bệnh hoại tử gan tụy cấp của một số loài vi khuẩn vibrio trên tôm nuôi nước lợ tại một số tỉnh phía Bắc - 3
Nghiên cứu khả năng gây bệnh hoại tử gan tụy cấp của một số loài vi khuẩn vibrio trên tôm nuôi nước lợ tại một số tỉnh phía Bắc - 3 -
 Tình Hình Hội Chứng Gan Tụy Cấp Trên Tôm Nuôi Nước Lợ
Tình Hình Hội Chứng Gan Tụy Cấp Trên Tôm Nuôi Nước Lợ -
 Phân Lập Và Định Danh Vi Khuẩn (Frerichs Và Millar (1983, 1993))
Phân Lập Và Định Danh Vi Khuẩn (Frerichs Và Millar (1983, 1993)) -
 Nghiên cứu khả năng gây bệnh hoại tử gan tụy cấp của một số loài vi khuẩn vibrio trên tôm nuôi nước lợ tại một số tỉnh phía Bắc - 7
Nghiên cứu khả năng gây bệnh hoại tử gan tụy cấp của một số loài vi khuẩn vibrio trên tôm nuôi nước lợ tại một số tỉnh phía Bắc - 7 -
 Nghiên cứu khả năng gây bệnh hoại tử gan tụy cấp của một số loài vi khuẩn vibrio trên tôm nuôi nước lợ tại một số tỉnh phía Bắc - 8
Nghiên cứu khả năng gây bệnh hoại tử gan tụy cấp của một số loài vi khuẩn vibrio trên tôm nuôi nước lợ tại một số tỉnh phía Bắc - 8
Xem toàn bộ 65 trang tài liệu này.
2.3.3 Xác định độc lực của vi khuẩn:
- Thí nghiệm đợt 1 (TN1):
Bố trí thí nghiệm 1:
108 | 108 | 108 | 108 | 108 | 108 | 108 | 108 | |
6h | 6h | 6h | 12h | 12h | 12h | 24h | 24h | 24h |
(1) | (2) | (3) | (1) | (2) | (3) | (1) | (2) | (3) |
107 | 107 | 107 | 107 | 107 | 107 | 107 | 107 | 107 |
6h | 6h | 6h | 12h | 12h | 12h | 24h | 24h | 24h |
(1) | (2) | (3) | (1) | (2) | (3) | (1) | (2) | (3) |
106 | 106 | 106 | 106 | 106 | 106 | 106 | 106 | 106 |
6h | 6h | 6h | 12h | 12h | 12h | 24h | 24h | 24h |
(1) | (2) | (3) | (1) | (2) | (3) | (1) | (2) | (3) |
Đối chứng | Đối chứng | Đối chứng | Đối chứng | Đối chứng | Đối chứng | Đối chứng | Đối chứng | Đối chứng |
- Tôm thí nghiệm: Tôm thẻ chân trắng khỏe Post 21
- Loài vi khuẩn gây nhiễm: V. paraheamolyticus (13.014)
- Dùng phương pháp ngâm vi khuẩn cho tôm khỏe ở 3 mức nồng độ vi khuẩn khác nhau: 106, 107, 108 (cfu/ml) và 1 nghiệm thức đối chứng ngâm dung dịch nutrient broth; ở 3 mức thời gian khác nhau: 6h, 12h, 24h.
- Tôm được ngâm ở thùng nhựa 10 lít (8 lít nước) và được nuôi thí nghiệm trong thùng nhựa thể tích 50 lít (40 lít nước)
- Độ mặn nước nuôi: 29‰;
- Độ oxy hòa tan: 7,4 ppm
- PH = 8,1
- Nhiệt độ: 26-30oC
Thí nghiệm đợt 2 (TN2):
Bố trí thí nghiệm 2:
106 | 106 | 106 | 106 | 106 | 106 | 106 | 106 | |
1h | 1h | 1h | 3h | 3h | 3h | 6h | 6h | 6h |
(1) | (2) | (3) | (1) | (2) | (3) | (1) | (2) | (3) |
105 | 105 | 105 | 105 | 105 | 105 | 105 | 105 | 105 |
1h | 1h | 1h | 3h | 3h | 3h | 6h | 6h | 6h |
(1) | (2) | (3) | (1) | (2) | (3) | (1) | (2) | (3) |
104 | 104 | 104 | 104 | 104 | 104 | 104 | 104 | 104 |
1h | 1h | 1h | 3h | 3h | 3h | 6h | 6h | 6h |
(1) | (2) | (3) | (1) | (2) | (3) | (1) | (2) | (3) |
Đối chứng | Đối chứng | Đối chứng | Đối chứng | Đối chứng | Đối chứng | Đối chứng | Đối chứng | Đối chứng |
- Tôm thí nghiệm: Tôm thẻ chân trắng khỏe Post 24
- Loài vi khuẩn gây nhiễm: V. paraheamolyticus (13.014)
- Dùng phương pháp ngâm vi khuẩn cho tôm khỏe ở 3 mức nồng độ vi khuẩn khác nhau: 104, 105, 106 (cfu/ml) và 1 nghiệm thức đối chứng ngâm dung dịch nutrient broth; ở 3 mức thời gian khác nhau: 1h, 3h, 6h.
- Tôm được ngâm ở thùng nhựa 10 lít (8 lít nước) và được nuôi thí nghiệm trong thùng nhựa thể tích 50 lít (40 lít nước);
- Số lượng tôm thí nghiệm/công thức: 50 con
- Độ mặn nước nuôi: 29‰;
- Độ oxy hòa tan: 7,4 ppm
- PH = 8,1
- Nhiệt độ: 26-30oC
Thí nghiệm 3 (TN3):
- Tiến hành trên tôm thẻ chân trắng 40 ngày tuổi
- Số lượng tôm thí nghiệm/công thức: 5 con/8 lít nước
- Vi khuẩn gây nhiễm V. paraheamolyticus 12.020 nồng độ 5. 107, là vi khuẩn được phân trong năm 2012 tại Hải phòng từ ao nuôi tôm được khẳng định chắc chắn là phân lập từ tôm bị AHPND theo phương pháp mô bệnh học.
- Tiến hành ngâm trực tiếp vi khuẩn vào bể nuôi ở 3 hỗn hợp khác nhau
(1) Vi khuẩn+nước muối sinh lý; (2) vi khuẩn + dịch nuôi cấy; (3) Dịch nuôi cấy vi khuẩn và 1 nghiệm thức đối chứng ngâm dung dịch nutrient broth ở các điều kiện nhiệt độ, độ oxy hòa tan, Ph, độ mặn tương tự thí nghiệm 1 và 2.


Hình 2.1: Bố trí thí nghiệm
2.3.4 Thử kháng sinh đồ (Kibry-Bauer)
Tiến hành thử kháng sinh đồ với 08 loại kháng sinh, đó là: Do (Doxycyline, 30 µg); Rf (Rifampin, 5 µg); Te (Tetracylin, 30 µg); Ery (Erythromycin, 15 µg); Sm (Streptomycin, 10 µg); Nv (Novobiocin, 5 µg); Am (Ampicilin, 10 µg); Ox (Oxacillin, 1 µg).
Các bước cụ thể như sau:
Bước 1: Lấy vi khuẩn Vibrio thuần cho vào dung dịch nước muối 2%
để tạo dung dung dịch huyền phù 109CFU/ml
Bước 2: Lấy 100 ml dung dịch vi khuẩn này trên trang đều trên đĩa thạch MH+(Mueller Hinton) trong vòng 1 phút
Bước 3: Đặt các tấm kháng sinh vào đĩa thạch nói trên cho vào tủ ấm, sau 24h đo vòng kháng khuẩn và kiểm tra lại sau 48h.
2.4 Phương pháp xử lí số liệu
Số liệu được xử lí bằng phần mềm Microsoft Excel 2010.
Chương 3: KẾT QUẢ NGHIÊN CỨU
3.1 Xác định sự có mặt của vi khuẩn trên tôm bị AHPND
- Tôm thu tại Nghệ An (2 đợt), và Nam Định (1 đợt) được xác định có dấu hiệu lâm sàng và biểu hiện AHPND theo như “Hướng dẫn về dấu hiệu nhân biết hội chứng hoại tử gan tụy cấp” của Cục Thú y, 2012.
Bảng 3.1 Kết quả phân lập vi khuẩn
Địa điểm thu mẫu | Số lượng mẫu | Xác định vi khuẩn | |
04/2013 | Nam Định | 17 mẫu | 47,1% mẫu tôm nhiễm Vibrio, gồm: V.parahaemolyticus V. alginolyticus V.cholerae V. harveyi |
05/2013 | Nghệ An | 45 mẫu | 42% mẫu tôm nhiễm Vibrio, cụ thể: V.vulnificus V.cholerae V. V.ordalii |
Tỷ lệ phân lập các loài vi khuẩn Vibrio ở Nghệ An được thể hiện ở
hình 3.1 và Nam Định ở hình 3.2:
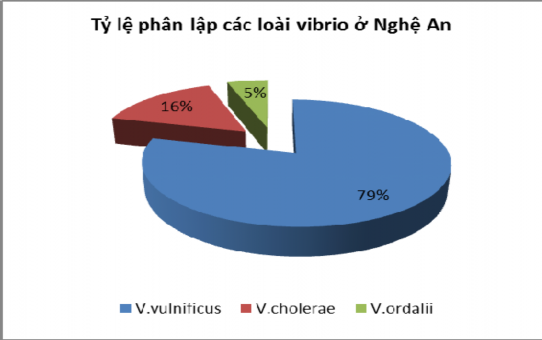
Hình 3.1: Tỷ lệ phận lập các loài Vibrio ở Nghệ An
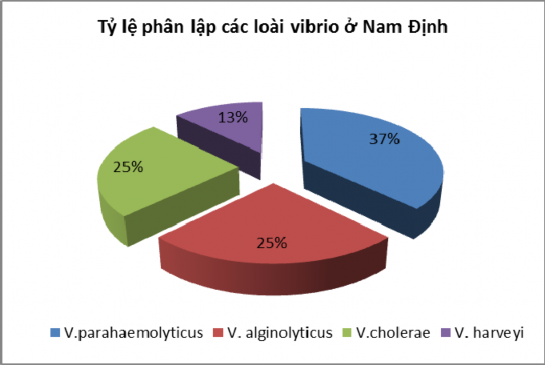
Hình 3.2: Tỷ lệ phận lập các loài Vibrio ở Nam Định
Vi khuẩn V.vulnificus Vi khuẩn V.parahaemolyticus


Hình 3.3: Hình ảnh soi vi khuẩn trên kính hiển vi
Bảng 3.2 Kết quả phân tích mẫu theo phương pháp mô
Địa điểm thu mẫu | Số lượng mẫu | AHPND (+) | |
04/2013 | Nam Định | 22 | 0/22 (0%) |
05/2013 | Nghệ An | 47 | 28/47 (59,6%) |
Dựa vào dấu hiệu bệnh lý và phương pháp phương pháp mô bệnh học (Bảng 3.2) cho thấy mẫu tôm thu tại Nghệ An là chết do AHPND, ngược lại mẫu tôm thu được ở Nam Định là âm tính. Tuy nhiên, kết quả phân lập tôm tại Nam Định lại có phát hiện thấy vi khuẩn V. parahaemolyticus. Lightner và cộng sự (2013) đã xác định một chủng vi khuẩn V. parahaemolyticus là tác nhân gây ra AHPND. Là một phần của đề tài: “Nghiên cứu nguyên nhân, tác nhân gây hội chứng hoại tử gan tụy trên tôm sú và tôm thẻ chân trắng và biện pháp khắc phục” do viện NTTS 1 chủ trì, chúng tôi quyết định sẽ tiến hành gây
nhiễm vi khuẩn này để xác định rò độc lực của vi khuẩn V. parahaemolyticus
đã phân lập được. Mặt khác, chúng tôi thực hiện thí nghiệm trên V. parahaemolyticus đã phân lập được cũng để so sánh với thí nghiệm 3, thí nghiệm mà chúng tôi sẽ thực hiện sau đó đối với chủng vi khuẩn đã được phân lập ở Hải phòng năm 2012 (chủng vi khuẩn đã được xác định là tác nhân gây bệnh theo phương pháp mô bệnh học).
3.2 Xác định các chủng vi khuẩn Vibrio độc lực
Trong thời gian thực hiện đề tài chúng tôi đã tiến hành tổng cộng 3 thí nghiệm gây nhiễm vi khuẩn: 02 thí nghiệm đối với loài vi khuẩn V. paraheamolyticus thu được tại Nam Định ký hiệu là V. paraheamolyticus 13- 041; và 01 thí nghiệm đối với chủng V. paraheamolyticus thu được từ Hải phòng năm 2012 ký hiệu là V. paraheamolyticus 12-020.
* Kết quả thí nghiệm 1:
- CTVK 108: Tỷ lệ chết 100% trong thời gian 14h
- CTVK 107: Tỷ lệ chết 100% trong thời gian 24h
- CTVK 106: bắt đầu chết sau 13h, và chết rải rác vào những ngày tiếp theo cho đến khi thu mẫu định kỳ 21 ngày (tỷ lệ chết trung bình 83%).
- Tỷ lệ tái phân lập lại vi khuẩn 0% (0/17 mẫu).
- Tỷ lệ mẫu được xác định là hoại tử gan tụy cấp theo phương pháp mô bệnh học là: 0% (0/45 mẫu).
Số liệu chi tiết được thể hiện ở bảng 3.3:





