1,0. Sản phẩm thu được có khoảng cách lớp lớn (18,0 – 18,7Å), tương đương với MMT biến tính nhôm (18,2Å) ở nhiệt độ sấy mẫu 120oC. Tác giả cho rằng cation La3+ liên kết chặt chẽ vào tâm bát diện của polyoxocation Al13, kết quả thu được polyoxocation Al/La có công thức chung là [(Al)td(Al12-xLax)bdO4(OH)24]7+ và vẫn duy trì cấu trúc kiểu ion Keggin. Vật liệu MMT biến tính Al/La chứa nhiều tâm
hoạt động hơn MMT biến tính Al trong phản ứng cracking cumen [69, 70].
1.2.4.5. Bentonit biến tính nhôm/sắt
Việc đưa nguyên tố kim loại chuyển tiếp vào bentonit biến tính nhôm có ảnh hưởng đến ứng dụng của vật liệu biến tính trong quá trình hấp phụ và xúc tác. Theo ý tưởng này, bentonit biến tính Al/Fe thu được từ phản ứng của dung dịch polyoxocation Al/Fe và huyền phù bentonit được nghiên cứu bởi một số tác giả [28, 93, 106, 131, 159]. Để xác định sự có mặt của nguyên tố Fe trong bentonit biến tính Al/Fe cần sử dụng các phương pháp phân tích lý hoá hiện đại như phổ Mössbauer, cộng hưởng từ hạt nhân, UV-Vis hoặc TPR để làm rõ cấu trúc của vật liệu bentonit biến tính bởi hỗn hợp polyoxocation Al/Fe.
Carrado [28] nghiên cứu sự trao đổi của cation Fe3+ với tác nhân
polyoxocation Al13 và xác định cấu trúc lỗ xốp của sản phẩm sử dụng 2 quá trình điều chế khác nhau: (i) trao đổi cation hiđrat lớp xen giữa của bentonit với cation Fe3+, sau đó phản ứng với polyoxocation Al13 và (ii) đưa cation Fe3+ vào polyoxocation Al13 trước khi cho phản ứng với huyền phù bentonit. Khoảng cách lớp của bentonit biến tính Al/Fe là 19,6Å (giảm xuống còn 18,8Å sau khi nung mẫu ở 400oC) và hàm lượng Fe chiếm 5,64% khối lượng. Carriazo [29] khảo sát độ bền của bentontie biến tính Al/Fe trong môi trường axit, kết quả cho thấy bentonit biến tính chứa Fe pha tạp có độ bền kém hơn so với vật liệu bentonit chưa biến tính. Tuy nhiên, vật liệu bentonit biến tính Al/Fe là rất bền, có thể là do cation Fe3+ liên kết chặt với polyoxocation Al13.
Lee [76] điều chế dung dịch polyoxocation chứa cả Fe và Al do sự thuỷ phân dung dịch chứa AlCl3.6H2O và FeCl3.6H2O với tỉ lệ Al/Fe là 25 bằng Na2CO3. MMT đã thành công trong việc biến tính với dung dịch này và cũng như biến tính
với dung dịch chứa hỗn hợp polyoxocation Al13 và polyoxocation [Fe3(OH)4]5+. Sản phẩm thu được có khoảng cách lớp là 16,7Å và diện tích bề mặt là 250 m2/g (400oC). Timofeeva [131] đã khảo sát một số yếu tố ảnh hưởng đến quá trình điều chế vật liệu MMT biến tính với hỗn hợp Al/Fe như: tỉ lệ mol OH-/(Al3++Fe3+), thời
gian già hoá dung dịch polyoxocation Fe/Al đến tính chất lý hoá và khảo sát tính chất nhiệt của chúng. Diện tích bề mặt và khoảng cách lớp của mẫu bentonit biến tính Fe/Al (tỉ lệ Fe/Al là 1/10 và tỉ lệ mol OH-/(Al3++Fe3+) là 2,4) là 132 m2/g và 17,2Å. Tăng thời gian già hoá dung dịch polyoxocation thì diện tích bề mặt, tổng
thể tích lỗ xốp và thể tích lỗ xốp vi mao quản của vật liệu bentonit biến tính tăng lên. Khi tỉ lệ Al/Fe tăng lên thì làm giảm sự hình thành loại polyoxocation sắt. Khi tăng thời gian già hoá dung dịch polyoxocation chứa Fe/Al thì làm giảm độ hoà tan của sắt và tăng tốc độ phản ứng hình thành các loại ion sắt riêng biệt [66].
1.3. TÍNH CHẤT CỦA BENTONIT BIẾN TÍNH
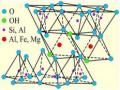
Vật liệu bentonit biến tính bằng tác nhân kim loại hoặc polyoxocation kim loại có tiềm năng ứng dụng lớn trong lĩnh vực xúc tác và hấp phụ bởi vì diện tích bề mặt cao và độ xốp nằm trong vùng lỗ xốp vi mao quản – mao quản trung bình. Ngoài ra, tâm axit Bronsted và Lewis làm cải thiện độ bền nhiệt và tăng chiều rộng lỗ xốp mở ra cơ hội ứng dụng vật liệu này trong chuyển hoá chất hữu cơ và trong hấp phụ. Đặc tính quan trọng của bentonit biến tính là khoảng cách lớp xen giữa ( ∆d ). Khoảng cách lớp của bentonit biến tính với ion Keggin Al13 là 18,6Å, tương ứng với khoảng cách lớp xen giữa là 9Å chỉ ra trong Hình 1.8. Nếu khoảng cách lớp xen giữa nhỏ hơn 9Å thì xem như quá trình biến tính bentonit bằng ion Keggin nhôm xảy ra không hoàn toàn [22, 90, 133].
Một tính chất quan trọng khác của bentonit biến tính là diện tích bề mặt cao. Bentonit biến tính thường có lỗ xốp và diện tích bề mặt cao hơn bentonit nguyên liệu. Bentonit biến tính bóc lớp hoàn toàn có diện tích bề mặt đạt khoảng 800 m2/g. Vaughan [141, 142] điều chế vật liệu này với diện tích bề mặt 600 m2/g và tổng thể tích lỗ xốp là 0,6 cm3/g. Tổng thể tích lỗ xốp này hình thành do kích thước các loại lỗ xốp khác nhau, bentonit biến tính nhôm thường chứa lỗ xốp vi mao quản [28, 48] và bentonit biến tính Al/Fe thường chứa lỗ xốp mao quản trung bình [131].
Lỗ xốp
Lỗ xốp
Hình 1.8. Cấu trúc bentonit biến tính bằng tác nhân polyoxocation Al13.
Quá trình biến tính bentonit làm thay đổi liên kết giữa các lớp cơ sở từ lực Van de Van hoặc ion đến gần liên kết cộng hoá trị làm bền cấu trúc lớp của bentonit biến tính. Nhìn chung, bentonit biến tính thu được có khoảng cách lớp (giá trị d001) tăng từ 12Å lên 14 – 30Å phụ thuộc vào loại tác nhân kim loại biến tính. Ngoài kích thước tác nhân, mật độ và sự phân bố tác nhân biến tính trong lớp xen giữa cũng là yếu tố quan trọng của bentonit biến tính. Từ các kết quả đã trình bày ở trên cho thấy rằng, quá trình biến tính bentonit bằng cation kim loại hoặc polyoxocation kim loại thu được sản phẩm có khoảng cách lớp tăng, diện tích bề mặt lớn, tính axit được cải thiện và số lượng tâm hoạt động tăng,v.v.. Với sự phát triển của vật liệu thân thiện với môi trường, bentonit biến tính bằng tác nhân kim loại có thể là vật liệu ứng dụng tiềm năng trong tương lai.
1.4. TÍNH CHẤT HẤP PHỤ PHỐTPHO CỦA BENTONIT BIẾN TÍNH
Phốtpho là chất dinh dưỡng thiết yếu cho sự phát triển của sinh vật trong môi trường nước, nhưng nồng độ phốtpho dư thừa trong nước là nguyên nhân gây ra hiện tượng phú dưỡng cho các thủy vực, tác động xấu đến hệ sinh thái nước. Phốtpho phát sinh vào môi trường nước bằng nhiều cách khác nhau, trong đó quan trọng nhất là các hoạt động trong công nghiệp, nông nghiệp và hoạt động khai thác mỏ,v.v.. Mặc dù việc loại bỏ phốtpho được yêu cầu xử lý trước khi được thải vào nước, mà ô nhiễm phốtpho vẫn ngày càng tăng lên. Do đó, phương pháp loại bỏ phốtpho ngày càng phát triển để ứng dụng xử lý phốtpho trước khi xả vào hệ nước.
1.4.1. Hiện tượng phú dưỡng
Phú dưỡng là sự phát triển quá trình sinh học tự nhiên trong hồ, ao, sông, biển,v.v. do gia tăng chất dinh dưỡng (thường hợp chất của nitơ và phốtpho) thúc đẩy sự phát triển của tảo, thực vật thuỷ sinh và tạo ra những biến động lớn trong hệ sinh thái nước, làm chất lượng nước bị suy giảm và ô nhiễm [20, 24, 37, 110, 152]. Hình 1.9 cho thấy một số thuỷ vực bị phú dưỡng.


Hình 1.9. Một số thuỷ vực bị phú dưỡng.
Cơ sở sinh hóa của hiện tượng phú dưỡng là phản ứng quang hóa xảy ra theo nhiều bước: trước hết, các chất diệp lục và các sắc tố trong cây xanh hấp thụ ánh sáng để tổng hợp lên các chất hữu cơ từ CO2 và H2O. Tiếp theo quá trình biến đổi sinh hóa, tổng hợp lên các tế bào. Thông thường lượng C, H, O trong cây xanh và rong tảo chiếm 98% khối lượng tươi, nguồn cung cấp của các nguyên tố này chủ yếu từ khí CO2 và H2O. Ngoài ra còn có những nguyên tố đa lượng và vi lượng khác cũng tham gia vào sự hình thành cấu trúc tế bào [54].
Phản ứng quang hợp của thực vật phù du (tảo) như sau:
106CO2 + 16NO3- + HPO42– + 122H2O + 18H+ → C106H263ON16P + 138O2 (1.2)
Từ phản ứng (1.2) cho thấy, tỉ số C:N:P là 106:16:1. Tỉ số N:P được gọi là “giá trị biên độ đỏ”. Dựa vào giá trị này trong môi trường nước, có thể biết yếu tố nào hạn chế tiềm năng phát triển của tảo. Nếu tỉ lệ hàm lượng (tính bằng mg/l) N:P
> 7 thì phốtpho trở thành yếu tố giới hạn, ngược lại N:P < 7 thì nitơ trở thành yếu tố giới hạn [152]. Tuy nhiên hầu hết tỉ lệ này ở các ao hồ khoảng 20 cho nên hầu như lúc nào phốtpho cũng là yếu tố hạn chế [34, 45].
Còn theo WHO [146] thì “yếu tố giới hạn” được xác định dựa trên tỉ số TN/TP (biểu diễn bằng khối lượng/khối lượng) đối với nước ngọt và nước vùng cửa sông/nước biển ven bờ chỉ ra trong Bảng 1.2. Khi phốtpho là yếu tố giới hạn thì nồng độ phốtphat ở mức 0,01 mg/l sẽ duy trì sự phát triển của sinh vật phù du, nhưng khi nồng độ phốtphat từ 0,03 đến 0,1 mg/l hoặc lớn hơn thì sinh vật phù du phát triển bùng nổ, tức là sự phú dưỡng xảy ra.
Bảng 1.2. Yếu tố giới hạn đối với sự phú dưỡng, WHO [146]
Yếu tố giới hạn | |||
Nitơ | Cả nitơ và phốtpho | Phốtpho | |
Nước ngọt | ≤ 4,5 | 4,5 ÷ 6,0 | ≥ 6 |
Nước cửa sông/nước biển ven bờ | ≤ 5 | 5 ÷ 10 | ≥ 10 |
Có thể bạn quan tâm!
-
 Nghiên cứu điều chế, tính chất của vật liệu bentonit biến tính và ứng dụng hấp phụ phốtpho trong nước - 2
Nghiên cứu điều chế, tính chất của vật liệu bentonit biến tính và ứng dụng hấp phụ phốtpho trong nước - 2 -
 Sơ Đồ Mô Tả Sự Trương Nở Hoàn Toàn Của Bentonit.
Sơ Đồ Mô Tả Sự Trương Nở Hoàn Toàn Của Bentonit. -
 Sự Hình Thành Bentonit Biến Tính Và Các Yếu Tố Ảnh Hưởng
Sự Hình Thành Bentonit Biến Tính Và Các Yếu Tố Ảnh Hưởng -
 Quy Trình Điều Chế Vật Liệu Bentonit Biến Tính Lantan.
Quy Trình Điều Chế Vật Liệu Bentonit Biến Tính Lantan. -
 Khảo Sát Một Số Yếu Tố Ảnh Hưởng Đến Khả Năng Hấp Phụ Phốtpho Của Bentonit Biến Tính
Khảo Sát Một Số Yếu Tố Ảnh Hưởng Đến Khả Năng Hấp Phụ Phốtpho Của Bentonit Biến Tính -
 Các Yếu Tố Ảnh Hưởng Đến Quá Trình Điều Chế Vật Liệu B90-La Và B40-La
Các Yếu Tố Ảnh Hưởng Đến Quá Trình Điều Chế Vật Liệu B90-La Và B40-La
Xem toàn bộ 213 trang tài liệu này.
1.4.2. Ảnh hưởng của phú dưỡng
Thuỷ vực giàu dinh dưỡng gây nguy hại cho hệ thuỷ sinh và tác động xấu đến chất lượng nguồn nước sử dụng trong sinh hoạt, công nghiệp, nông nghiệp và vui chơi giải trí [89, 152]. Môi trường nước có chứa quá nhiều chất dinh dưỡng nitơ và phốtpho sẽ làm cho thực vật phù du phát triển mạnh, tăng sinh khối, đặc biệt là tảo que, tảo xanh và nhiều loại tảo độc khác (như Microcystis). Hàm lượng chất diệp lục cũng tăng lên đáng kể và khi bị thối rữa, phân hủy dẫn đến làm giảm nghiêm trọng nồng độ oxi hoà tan trong nước, yếu tố cơ bản của quá trình tự làm sạch của môi trường nước, đặc biệt là ở những nơi có độ sâu đáng kể. Sự phân hủy của tảo là một trong những nguyên nhân chính gây ra sự thiếu oxi nghiêm trọng trong nước [20, 24, 110, 152]. Quá trình này xảy ra theo phương trình (1.3):
CH2O106(NH3)16H3PO4 + 138O2 →
106CO2 + 122H2O + 16HNO3 + H3PO4 (1.3)
Từ phản ứng (1.3), cho thấy cứ 1 phân tử thực vật phù du thì sử dụng 276 nguyên tử oxi để tiến hành phản ứng phân hủy, đồng thời giải phóng một lượng đáng kể CO2 và axit vào trong môi trường làm giảm pH của nước, làm cho nước bị nhiễm bẩn, có mùi hôi thối, cá chết hàng loạt. Đặc biệt là thải ra một số chất chứa độc tố cao có ảnh hưởng đến các động thực vật thuỷ sinh và nguy hại đến sức khoẻ của con người.
1.4.3. Bentonit biến tính là vật liệu hấp phụ phốtpho hiệu quả
Phốtpho là yếu tố quan trọng gây nên phú dưỡng của thuỷ vực, dẫn đến nhiều cách xử lý phú dưỡng dựa vào khả năng kiểm soát nồng độ phốtpho. Nhiều nhà nghiên cứu [24, 34, 55, 110, 152] cho rằng, kiểm soát P đạt hiệu quả cao hơn kiểm soát N, không giống như N, nguồn P sinh học không có sẵn trong không khí. Đồng thời, từ phương trình quang hợp (1.2) cho thấy, cứ 1 gam P thì cần 7 gam N để tạo thành chất hữu cơ trong quá trình này [37, 54, 152]. Điều này cho thấy giảm một lượng nhỏ phốtpho có ảnh hưởng rất lớn đối với sự phát triển của tảo và vi khuẩn lam so với giảm cùng một lượng nitơ. Thực tế, nitơ có sẵn trong không khí cho sinh vật có khả năng cố định N, làm cho chiến lược giảm P đạt hiệu quả cao trong công cụ quản lý phú dưỡng.
Từ các giả thuyết và các phân tích ở trên của một số tác giả trên thế giới [24, 55, 110, 152], cũng như căn cứ vào thực tế của Việt Nam việc giảm nồng độ P trong hệ nước phú dưỡng hiệu quả cao hơn việc giảm nồng độ N tương ứng. Đồng thời phương pháp làm giảm nồng độ N trong nước là khó khăn và phức tạp hơn nhiều. Hiện nay, nhiều phương pháp xử lý phốtpho trong nước đã được nghiên cứu. Nhưng mỗi phương pháp có những ưu và nhược điểm nhất định.
❖ Phương pháp vật lý thường sử dụng xử lý phốtpho trong nước là phương
pháp pha loãng, rửa hoặc đảo tầng nhân tạo có thể làm giảm nồng độ P trong hồ một cách dễ dàng [44, 145]. Bên cạnh những thuận lợi nêu trên vẫn còn có những hạn chế nhất định như: làm phá vỡ hệ sinh thái, tốn nhiều thời gian và phụ thuộc vào điều kiện của từng hồ.
❖ Phương pháp sinh học sử dụng loại bỏ phốtpho trong nước dựa vào phản
ứng sinh học được thực hiện bởi các vi sinh vật. Tuy nhiên, các loài thường được sử dụng không cụ thể và phụ thuộc vào điều kiện lớp bùn đáy làm tác nhân ủ. Nổ lực cố gắng sử dụng các vi sinh vật cụ thể làm các tác nhân loại bỏ phốtpho được báo cáo trong những thập kỷ gần đây bao gồm các loài vi khuẩn và vi tảo [39, 87, 108, 139]. Tuy nhiên, vi khuẩn và vi tảo có thời gian sống ngắn, nên khả năng xử lý hồ trong thời gian dài là rất khó thực hiện.
❖ Ngày nay, quy trình thương mại chủ yếu để loại bỏ phốtpho trong nước là sử dụng các hoá chất để kết tủa P là muối sắt, phèn hoặc vôi [58, 79, 84, 118, 153].
Kết tủa phốtpho là phương pháp thường được sử dụng, kiểm soát và tối ưu hoá dễ dàng. Đồng thời, vật liệu hấp phụ sử dụng là các vật liệu thải, loại vật liệu mới từ quá trình công nghiệp khác và một số cải tiến đã được đề xuất trong những năm gần đây. Bên cạnh tác dụng đến hàm lượng P, phương pháp này còn để ngỏ khả năng thay thế hoàn toàn phương pháp sử dụng thuốc diệt tảo hóa học. Có nhiều hợp chất có thể sử dụng với vai trò là chất keo tụ như: muối nhôm, sắt, canxi hoặc hỗn hợp của chúng và một số loại đất sét [84, 104, 113, 156]. Muối nhôm, sắt, canxi đã được dùng hàng trăm năm nay để làm chất keo tụ trong công tác xử lý nước cấp hoặc nước thải. Lund [79] là người đầu tiên đề xuất sử dụng chất keo tụ gốc nhôm trong việc kiểm soát bùng phát tảo lam trong nước hồ. Những chất được đề cập bên trên có khá nhiều tác động đến môi trường thuỷ sinh, có thể phát sinh ra một số loại ion không mong muốn gây độc hại cho các động vật thuỷ sinh.
❖ Hiện nay các nhà khoa học trong nước và trên thế giới đã nghiên cứu khả
năng hấp phụ phốtpho trên một số vật liệu hấp phụ thải, tự nhiên và rẻ tiền như muối của lantan, nhôm, sắt và bentonit đã được khảo sát, nhưng mỗi loại có những bất lợi nhất định [58, 84, 104, 113]. Muối lantan hấp phụ phốtpho trong nước hiệu quả nhưng chúng sẽ gây hại cho hệ thuỷ sinh nếu sử dụng chúng với lượng dư lớn. Trong khi đó muối nhôm và sắt có khả năng phát sinh ion hyđro (H+) cho hệ thuỷ sinh, đặc biệt trong các hồ có độ kiềm thấp hoặc vừa phải, dẫn đến giảm mạnh độ pH của nước, ảnh hưởng đến động thực vật trong nước [14, 20, 34, 37, 153]. Khả năng gây hại của các nguyên tố này giảm đi đáng kể (gần như không còn) nếu kết
hợp chúng vào trong khoáng sét có độ trương nở cao, chẳng hạn bentonit [55, 104, 130]. Khi cation kim loại hoặc polyoxocation kim loại trao đổi với cation lớp xen giữa của bentonit thì tác nhân biến tính này bị khoá vào trong cấu trúc lớp của bentonit [15, 54, 55, 56, 148]. Vật liệu này có khả năng hấp phụ phốtpho và lưu giữ chúng trong cấu trúc không cho phát sinh trở lại cột nước, do đó thực vật thuỷ sinh không thể hấp thu phát triển [14]. Như vậy, bentonit biến tính bằng cation kim loại hoặc polyoxocation kim loại là loại vật liệu tiềm năng để sử dụng hấp phụ phốtpho trong nước hiệu quả.
1.5. TÌNH HÌNH NGHIÊN CỨU VÀ SỬ DỤNG BENTONIT BÌNH THUẬN
Ở nước ta quặng bentonit được phát hiện ở nhiều nơi như: Cổ Định (Thanh Hóa), Di Linh (Lâm Đồng), Tuy Phong (Bình Thuận),v.v. với trữ lượng dồi dào. Trong đó mỏ bentonit Bình Thuận với diện tích gần 10 km2, bao gồm các lớp bentonit chiều dày tối đa 11 m, trung bình 4 m, có trữ lượng lớn hàng trăm triệu tấn, được tìm thấy vào năm 1987. Bentonit kiềm tập trung ở đới khô Thuận Hải chiếm diện tích khoảng 4 km2, thành phần khoáng chính gồm MMT, quartz, felspar, canxit, cristobalit,v.v.. Trữ lượng có thể khai thác được ở Nha Mé khoảng 42 triệu tấn, còn ở thung lũng Vĩnh Hảo khoảng 33 triệu tấn [1, 4, 9]. Như vậy, khoáng sét bentonit Bình Thuận khá dồi dào. Đây là nguồn tài nguyên quý giá của đất nước mà các nhà khoa học cần phải nghiên cứu định hướng, sử dụng một cách có hiệu quả nhằm phục vụ cho nền kinh tế quốc dân.
Bảng 1.3. Thành phần hoá học các loại sản phẩm bentonit Nha Mé (Tuy Phong, Bình Thuận) [9]
Hàm lượng (%) | |||
Bentonit nguyên khai | Bentonit sơ tuyển | Bentonit đơn khoáng | |
SiO2 | 65,5 – 76,5 | 60,42 | 54,18 – 57,22 |
Al2O3 | 6,71 – 11,81 | 14,15 | 15,61 – 17,21 |
Fe2O3 | 1,44 – 2,27 | 3,41 | 3,20 – 4,10 |
FeO | 0,21 – 0,75 | 0,56 | 0,18 – 0,54 |
MgO | 1,05 – 2,13 | 2,75 | 2,78 – 3,12 |
CaO | 3,29 – 8,32 | 3,21 | 2,86 – 3,97 |
Na2O | 1,35 – 2,40 | 2,89 | 3,10 – 3,36 |
K2O | 0,62 – 1,92 | 0,67 | 0,78 – 0,91 |
TiO2 | 0,20 – 0,78 | 0,44 | 0,35 – 0,75 |
MKN | 10,0 – 11,30 | 10,09 | 10,93 – 12,43 |
Thời gian vừa qua nhiều công trình nghiên cứu đã quan tâm đến tài nguyên bentonit và công nghệ chế biến chúng thành các sản phẩm có thể sử dụng trong thực tế [1, 2, 4, 5, 6, 7, 9, 11]. Ngoài những công trình nghiên cứu địa chất nhằm tìm