MỞ ĐẦU
Bentonit là loại khoáng sét thiên nhiên, thuộc nhóm sét smectit. Thành phần chính của bentonit là khoáng chất montmorillonit, ngoài ra còn có một số khoáng chất khác như quartz, cristobalit, fenspat, biotit, kaolinit, illit, pyroxene, zircon, canxit,v.v.. Chính do cấu trúc, thành phần hoá học, khả năng trao đổi cation lớn, với lớp xen giữa có đặc tính hiđrat hoá, cho nên bentonit có các tính chất rất đặc trưng của khoáng sét trương nở như: khả năng trao đổi ion, trương nở, hấp phụ, kết dính, trơ, nhớt và dẻo,v.v.. Do những tính chất quý này mà bentonit có tiềm năng ứng dụng rộng rãi trong công nghiệp. Ngày nay với sự phát triển của công nghiệp người ta còn dùng bentonit làm vật liệu hấp phụ, chế tạo tác nhân xúc tác trong chuyển hoá chất hữu cơ, trong công nghiệp dầu khí và ứng dụng trong xử lý môi trường.
Nước ta có nguồn quặng bentonit rất phong phú được phát hiện ở nhiều nơi. Theo số liệu của Tổng cục Địa chất, ở Việt Nam có số lượng mỏ bentonit với trữ lượng tương đối lớn đã được phát hiện, thăm dò và khai khác. Trong đó mỏ bentonit Tuy Phong – Bình Thuận thuộc loại bentonit kiềm, với trữ lượng tương đối lớn, khoảng 150 triệu tấn. Bên cạnh đó, mỏ quặng bentonit Di Linh – Lâm Đồng thuộc loại bentonit kiềm thổ và một số mỏ bentonit khác ở Phú Yên, Thanh Hoá, An Giang,v.v. với trữ lượng bé hơn [1, 4, 5, 9]. Mặc dù vậy, bentonit ở nước ta mới được khai thác trong phạm vi nhỏ và chủ yếu dưới dạng thô, sử dụng làm vật liệu gốm, vật liệu xây dựng, chế tạo dung dịch khoan,v.v.. Hiện nay, bentonit hoạt hoá và biến tính sử dụng làm vật liệu hấp phụ ở nước ta chỉ mới nghiên cứu với lượng nhỏ và kết quả chưa được triển khai thực tế. Vì vậy việc nghiên cứu, sử dụng loại tài nguyên quý giá này và biến nó thành vật liệu sử dụng có hiệu quả trong các lĩnh vực khác nhau của nền kinh tế quốc dân là nhiệm vụ của các nhà khoa học nước nhà.
Biến tính bentonit bằng tác nhân kim loại hoặc tác nhân polyoxocation kim loại thu được loại vật liệu có cấu trúc lỗ xốp vi mao quản – mao quản trung bình [48, 50, 69, 72]. Bentonit biến tính được tạo thành khi trao đổi cation hiđrat lớp giữa của bentonit với cation kim loại hoặc polyoxocation kim loại. Các polyoxocation kim loại này được sinh ra do sự thuỷ phân bằng bazơ của các muối kim loại như Al, Fe, Ga, Cr, Ti,v.v. [16, 42, 98, 105, 125, 135]. Tính chất bentonit biến tính có thể được khống chế bởi điều kiện điều chế, kết hợp với tính chất sẵn có
của lớp nhôm silicat tự nhiên làm cho bentonit biến tính bằng tác nhân kim loại hoặc polyoxocation kim loại có nhiều tính chất thú vị. Vật liệu bentonit biến tính có tiềm năng ứng dụng lớn trong lĩnh vực xúc tác và hấp phụ bởi vì số tâm hoạt động tăng, diện tích bề mặt cao và độ xốp nằm trong vùng lỗ xốp vi mao quản – mảo quản trung bình. Ngoài ra, tâm axit Bronsted và Lewis làm cải thiện độ bền nhiệt và tăng chiều rộng lỗ xốp mở ra cơ hội ứng dụng vật liệu này trong chuyển hoá chất hữu cơ và trong hấp phụ [59, 73, 91, 155].
Phú dưỡng là sự phát triển quá trình sinh học tự nhiên trong hồ, ao, sông, biển,v.v. do gia tăng chất dinh dưỡng thường là các hợp chất của nitơ và phốtpho làm thúc đẩy sự phát triển của tảo, thực vật thuỷ sinh và tạo ra những biến động lớn trong hệ sinh thái nước, làm chất lượng nước bị suy giảm và ô nhiễm môi trường. Phốtpho là yếu tố quan trọng gây nên phú dưỡng của thuỷ vực, dẫn đến nhiều cách xử lý phú dưỡng dựa vào khả năng kiểm soát nồng độ phốtpho. Nhiều nhà nghiên cứu [24, 37, 55, 110, 152] cho rằng, kiểm soát phốtpho đạt hiệu quả cao hơn kiểm soát nitơ, không giống như nitơ, nguồn phốtpho sinh học không có sẵn trong không khí.
Bentonit là khoáng đất sét có sẵn, rẻ tiền và hàm lượng phong phú trong tự nhiên. Bề mặt bentonit mang điện tích âm cao thường được cân bằng bằng cation kim loại kiềm và kim loại kiềm thổ (tiêu biểu là Na+ và Ca2+). Những cation này có thể được thay thế bằng tác nhân kim loại đóng vai trò tác nhân biến tính làm tăng khoảng
cách lớp xen giữa của bentonit. Nhiều tác nhân kim loại bao gồm Al [63, 71], Zr [42], Fe [32, 155], La [55, 130], Cr [105, 135], Ti [53, 77] và Ga [36, 42] được sử dụng
nhiều trong thời gian qua. Bentonit biến tính có khả năng hấp phụ hiệu quả các dạng phốtpho trong nước và lưu giữ chúng ở giữa lớp sét, không cho phát sinh trở lại cột nước nên thực vật thuỷ sinh không thể hấp thu phát triển [55, 148, 152].
Việc tìm kiếm các vật liệu hấp phụ mới trên cơ sở sử dụng các tài nguyên hiện có ở Việt Nam nhằm xử lý ô nhiễm môi trường nước là nhiệm vụ cần thiết và cấp bách. Với ý tưởng sử dụng nguồn tài nguyên bentonit phong phú, sẵn có, rẻ tiền ở nước ta để điều chế các vật liệu bentonit biến tính có khả năng hấp phụ phốtpho trong nước, nhằm kiểm soát ngăn chặn phú dưỡng, chúng tôi chọn đề tài nghiên cứu cho luận án là: “Nghiên cứu điều chế, tính chất của vật liệu bentonit biến tính và ứng dụng hấp phụ phốtpho trong nước”.
Chương 1. TỔNG QUAN
1.1. BENTONIT
1.1.1. Thành phần khoáng và thành phần hoá học
Bentonit là loại khoáng sét thiên nhiên, thuộc nhóm smectit. Thành phần chính của bentonit là khoáng chất montmorillonit (MMT), ngoài ra còn có một số khoáng chất khác như quartz, cristobalit, fenspat, biotit, kaolinit, illit, pyroxene, zircon, canxit,v.v.. Đôi khi người ta còn gọi khoáng bentonit là MMT. Công thức đơn giản nhất của MMT (Al2O3.4SiO2.nH2O) ứng với nửa đơn vị cấu trúc. Công thức lý tưởng của MMT là Si8Al4O20(OH)4 cho một đơn vị cấu trúc. Tuy nhiên, thành phần hoá học của MMT luôn khác với thành phần biểu diễn theo lý thuyết do có sự thay thế đồng hình của các cation kim loại như Al3+, Fe2+, Mg2+,v.v. với Si4+ trong tấm tứ diện và Al3+ trong tấm bát diện [4, 11, 143]. Bentonit xuất hiện trong tự nhiên với sự biến thiên trong thành phần phụ thuộc vào nhóm và nguồn gốc của chúng. Công thức phân tử chung của MMT được biết thông thường là (M+x.nH2O)(Al4-yMgx)Si8O20(OH)4.nH2O, trong đó M+ là cation trao đổi lớp giữa
(M+ là Na+, K+, Mg2+, Ca2+,v.v.), trong điều kiện lý tưởng, x = 0,33 [4, 8, 35].
Như vậy thành phần hoá học của MMT với sự có mặt của Si, Al, còn có các nguyên tố khác Mg, Fe, Na, Ca,v.v. ngoài ra còn một số nguyên tố vi lượng khác như: Ti, Tl,v.v.. Trong đó tỉ lệ của Al2O3:SiO2 dao động từ 1:2 đến 1:4.
1.1.2. Cấu trúc của montmorillonit
Đơn vị cấu trúc cơ bản của tinh thể MMT được chỉ ra trong Hình 1.1. Mạng tinh thể của MMT gồm có lớp hai chiều trong đó tấm Al2O3 (hoặc MgO) bát diện ở trung tâm giữa hai tấm SiO2 tứ diện nằm ở đầu nguyên tử O vì thế nguyên tử oxi của tấm tứ diện cũng thuộc tấm bát diện. Nguyên tử Si trong tấm tứ diện thì phối trí với 4 nguyên tử oxy định vị ở bốn góc của tứ diện. Nguyên tử Al (hoặc Mg) trong tấm bát diện thì phối trí với 6 nguyên tử oxy hoặc nhóm hyđroxyl (OH) định vị ở 6 góc của bát diện đều. Ba tấm này chồng lên nhau hình thành một lớp cơ sở của MMT. Bề dày của lớp này có kích thước khoảng 0,96 nm (9,6Å), chiều dài và chiều rộng của lớp thay đổi từ hàng trăm đến hàng nghìn nm [4, 9, 22].
Trong tự nhiên, những lớp cơ sở của MMT xếp chồng lên nhau tạo thành khoảng không giữa các lớp này, thường được gọi là ‘khoảng cách lớp xen giữa’ [4, 22, 35]. Trong tự nhiên, MMT thường có sự thay thế đồng hình, nguyên tử Si hoá trị 4 trong tấm tứ diện được thay thế một phần bởi nguyên tử Al hoá trị 3 và nguyên tử Al hoá trị 3 trong tấm bát diện thì được thay thế một phần bằng các nguyên tử có hoá trị 2 như Fe và Mg. Sự thiếu hụt điện tích dương trong lớp cơ sở, dẫn đến bề
mặt của các lớp mang điện tích âm. Điện tích âm này được cân bằng bởi các cation kim loại kiềm và kiềm thổ hiđrat (chẳng hạn như Na+, K+, Ca2+, Mg2+,v.v.) chiếm giữ khoảng không gian giữa các lớp này.
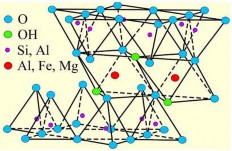
Hình 1.1. Đơn vị cấu trúc cơ bản của tinh thể montmorillonit.
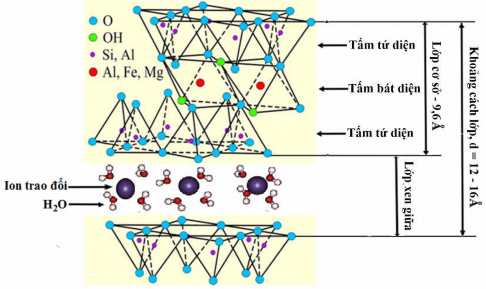
Hình 1.2. Cấu trúc khoáng chất montmorillonit.
Trong Hình 1.2 cho thấy sự thay thế đồng hình của một số ion Al3+, Fe3+, Mg2+,v.v. trong tấm tứ diện và tấm bát diện, cũng như khoảng cách lớp của MMT. Bề dày của một lớp cơ sở của MMT đã chỉ ra trong Hình 1.2 là 9,6Å [4, 22, 51],
còn khoảng cách lớp d001 của sét khô (làm khô ở 70oC) là 12 – 16Å tuỳ thuộc vào cation trao đổi và số lượng phân tử nước hấp phụ lớp xen giữa [4, 35, 51].
1.1.3. Tính chất của bentonit
Do thành phần khoáng chất chính của bentonit là MMT có cấu trúc gồm các lớp cơ sở liên kết với nhau bằng liên kết hiđro, có các ion bù trừ điện tích tồn tại ở lớp xen giữa nên bentonit có các tính chất đặc trưng như: trương nở, hấp phụ, trao đổi ion, kết dính, nhớt, dẻo, trơ,v.v.. Trong đó, tính chất quan trọng nhất của bentonit là trao đổi ion, hấp phụ và khả năng trương nở [4, 9, 116, 119, 143].
1.1.3.1. Khả năng trao đổi ion
Quá trình trao đổi cation là khả năng thay đổi cation hấp phụ trên bề mặt lớp bentonit. Các ion trao đổi (Na+, K+, Ca2+,v.v.) nằm trong lớp xen giữa của bentonit có thể được thay thế bởi ion kim loại chuyển tiếp, các ion kim loại đất hiếm và một số cation khác. Bản chất của hiện tượng này là do các cation nằm trong không gian lớp xen giữa (ion trung hoà điện tích âm của lớp sét) không cố định vị trí trong mạng lưới và do đó nếu được ngâm trong môi trường điện li, quá trình trao đổi xảy ra giữa các cation bên ngoài dung dịch và các cation trao đổi nằm ở lớp xen giữa của bentonit.
Các cation này có thể được thay thế bằng cation bất kỳ qua quá trình trao đổi đơn giản [4, 9, 85, 102]. Với các cation phức lớn, mức độ trao đổi ion được giới hạn bởi kích thước giới hạn của cation phức. Bảng 1.1 cho biết dung lượng trao đổi cation (CEC) của một số loại khoáng sét. Từ bảng này cho thấy CEC của nhóm khoáng sét smectit lớn hơn nhiều so với các loại khoáng sét khác [12, 22, 27, 82, 116].
Bảng 1.1. Dung lượng trao đổi cation (CEC) của một số loại khoáng sét [116]
CEC (mlđlg/100g) | Khoáng sét smectit | CEC (mlđlg /100g) | |
Kaolinit | 3 – 15 | Montmorillonit | 80 – 150 |
Halloysit.4H2O | 40 – 50 | Vermiculit | 100 – 150 |
Illit | 10 – 40 | Beidellit | 60 – 120 |
Chlorit | 10 – 40 | Nontronit | 60 – 120 |
Pyrophyllit | 0 | Hectorit | 60 – 120 |
Talc | 0 | Saponit | 60 – 120 |
Có thể bạn quan tâm!
-
 Nghiên cứu điều chế, tính chất của vật liệu bentonit biến tính và ứng dụng hấp phụ phốtpho trong nước - 1
Nghiên cứu điều chế, tính chất của vật liệu bentonit biến tính và ứng dụng hấp phụ phốtpho trong nước - 1 -
 Nghiên cứu điều chế, tính chất của vật liệu bentonit biến tính và ứng dụng hấp phụ phốtpho trong nước - 2
Nghiên cứu điều chế, tính chất của vật liệu bentonit biến tính và ứng dụng hấp phụ phốtpho trong nước - 2 -
 Sự Hình Thành Bentonit Biến Tính Và Các Yếu Tố Ảnh Hưởng
Sự Hình Thành Bentonit Biến Tính Và Các Yếu Tố Ảnh Hưởng -
 Cấu Trúc Bentonit Biến Tính Bằng Tác Nhân Polyoxocation Al13.
Cấu Trúc Bentonit Biến Tính Bằng Tác Nhân Polyoxocation Al13. -
 Quy Trình Điều Chế Vật Liệu Bentonit Biến Tính Lantan.
Quy Trình Điều Chế Vật Liệu Bentonit Biến Tính Lantan.
Xem toàn bộ 213 trang tài liệu này.
1.1.3.2. Tính chất hấp phụ
Tính chất hấp phụ của bentonit được quyết định bởi đặc tính bề mặt, cấu trúc lỗ xốp và kích thước hạt của chúng [4, 9, 27]. Bentonit có cấu trúc tinh thể và độ phân tán cao, cho nên có cấu trúc lỗ xốp phức tạp và có diện tích bề mặt lớn. Cấu trúc lỗ xốp ảnh hưởng rất lớn đến tính hấp phụ của các chất hấp phụ, đặc trưng của bentonit là tính chọn lọc chất bị hấp phụ. Chỉ có những phân tử nào có đường kính đủ nhỏ so với lỗ xốp thì mới chui vào được. Dựa vào điều này người ta có thể hoạt hoá hoặc biến tính sao cho có thể dùng bentonit làm vật liệu tách các chất. Đây cũng là điểm khác nhau giữa bentonit và các chất hấp phụ khác [4, 9, 14, 15].
Do sự dư hoá trị trên các nguyên tử của các nút mạng tinh thể cho nên bentonit là một chất hấp phụ phân cực và vì vậy nó sẽ ưu tiên hấp phụ các chất phân cực. Tuy nhiên, bentonit vẫn có thể hấp phụ các chất không phân cực do lực Van de Van và tương tác hấp phụ chủ yếu là tương tác cảm ứng. Bentonit có diện tích bề mặt tương đối lớn bao gồm bề mặt ngoài và bề mặt trong. Bề mặt trong bao gồm bề mặt của các lớp cơ sở chồng lên nhau và được ngăn cách bằng các cation kim loại bù đắp điện tích trên bề mặt bentonit. Bề mặt ngoài được xác định bởi bề mặt của các mao quản chuyển tiếp. Các mao quản này được tạo nên do sự tiếp xúc của các hạt bentonit với nhau và có kích thước khoảng hàng trăm Å. Diện tích của bề mặt ngoài phụ thuộc vào kích thước các hạt bentonit, hạt càng nhỏ thì diện tích bề mặt ngoài càng lớn. Khả năng trao đổi ion càng lớn cùng với khả năng hấp phụ tốt mà ta có một loại vật liệu xử lý kim loại nặng rất hiệu quả từ bentonit [4, 11, 13, 147].
1.1.3.3. Tính trương nở
Bentonit có cấu trúc lớp hai chiều cho nên chúng có khả năng hấp phụ lượng lớn nước vào khoảng không gian lớp, ở bề mặt ngoài và sau đó bóc tách, làm mất cấu trúc lớp của chúng và vì vậy chúng có thể tồn tại ở dạng lá rất mỏng [9, 122, 134]. Khi nước bị hấp phụ vào giữa các lớp sẽ làm tăng khoảng cách lớp (giá trị d001) gây ra sự trương nở. Quá trình trương nở xảy ra thuận nghịch, chủ yếu là do sự hiđrat cation lớp xen giữa của sét. Mức độ trương nở phụ thuộc vào bản chất của khoáng sét, tác nhân trương nở, cation trao đổi ở lớp xen giữa, điện tích lớp và vị trí
của điện tích lớp (điện tích nằm ở tấm bát diện hoặc tấm tứ diện) [85, 102, 123]. Khi bentonit và nước trộn lẫn nhau, phân tử nước thâm nhập vào lớp xen giữa, dẫn đến cation trao đổi bắt đầu khuếch tán ra bề mặt lớp được mô tả trong Hình 1.3.
~ +
~ +
H2O
Na+
H2O
Na
+
~ +
Na+
H2O
~ +
Hình 1.3. Sơ đồ mô tả quá trình trương nở của bentonit.
Để quá trình trương nở hiệu quả, năng lượng giải phóng bởi sự hyđrat hoá của các cation (hoặc lớp) phải đủ vượt qua lực hút giữa các lớp liền kề (chẳng hạn như liên kết hiđro). Với khoáng sét kiểu 2:1, khả năng trương nở phụ thuộc vào sự hyđrat cation lớp xen giữa và điện tích lớp. Khoáng sét với cấu trúc kiểu 2:1 và có điện tích lớp thấp (talc và pyrophyllit) có số lượng cation nằm ở lớp xen giữa thấp, do đó khả năng trương nở kém. Ngược lại, với khoáng sét có điện tích cao (bentonit) có lực tương tác tĩnh điện giữa lớp điện tích âm và cation lớp xen giữa cho nên khả năng trương nở dễ dàng với cation lớp xen giữa hoá trị thấp và giảm khi cation đa hoá trị.
Vì vậy, bentonit với lớp xen giữa chứa chủ yếu các ion Li+, Na+ có khả năng trương
nở cao [4, 9, 22, 123]. Sự di chuyển của cation của lớp xen giữa ra bên ngoài và phân tử nước đi vào (sự khuếch tán) và sự di chuyển của nước vào trong không gian giữa các lớp sét (sự thẩm thấu) làm thúc đẩy quá trình tách lớp cho đến khi các lớp sét được bóc tách hoàn toàn chỉ ra trong Hình 1.4.
Hàm lượng nước ở lớp xen giữa tăng khi áp suất tăng, một hay nhiều lớp nước có thể hình thành ở lớp xen giữa. Khoảng cách lớp (giá trị d001) tăng lên đột ngột khi bentonit chứa 2 lớp nước ở lớp xen giữa. Trong điều kiện thích hợp, các lớp cơ sở của bentonit có thể được ngăn cách bởi hàng trăm Å phân tử nước. Trong thực tế, lớp cơ
sở của Na+-MMT trong dung dịch loãng bị bóc tách hoàn toàn (bóc lớp). Khi nồng độ huyền phù bentonit thấp thì dung dịch huyền phù tồn tại dạng gel, xuất hiện khi nồng độ của chúng nhỏ hơn 2% (tính theo khối lượng), do hình thành các định hướng mặt
H2O
– cạnh và cạnh – cạnh tạo ra cấu trúc bóc lớp [9, 65, 96, 116].
H2O
H2O
H2O
~+
~+
~+
H2O
~+
~+
H2O
~+
~+
H2O
~+
H2O
Hình 1.4. Sơ đồ mô tả sự trương nở hoàn toàn của bentonit.
1.3.4. Ứng dụng của bentonit
Trên thế giới việc ứng dụng bentonit vào những ngành công nghiệp là khá đa dạng và phong phú. Bentonit được ứng dụng trong nhiều lĩnh vực khác nhau như: làm chất hấp phụ, chế tạo dung dịch khoan, làm chất độn, chất màu trong công nghiệp sản xuất các vật liệu tổng hợp, công nghiệp rượu, bia; trong công nghiệp tinh chế nước,v.v.. Ngoài những ứng dụng rộng rãi như vừa nên trên của bentonit, các ứng dụng mới của bentonit đã và đang được tìm ra nhiều loại vật liệu mới được chế tạo từ chúng. Trong những năm gần đây các nhà khoa học đã sử dụng khoáng bentonit kiềm với thành phần chính là Na-MMT làm các vật liệu gốc để điều chế vật liệu bentonit biến tính bởi các tác nhân kim loại.
1.2. BENTONIT BIẾN TÍNH BẰNG CÁC TÁC NHÂN KIM LOẠI
Bentonit tự nhiên chưa biến tính ứng dụng trong hấp phụ và xúc tác đạt hiệu quả thấp [4, 11, 43], để sử dụng cho các ứng dụng này, bentonit cần được biến tính. Bentonit biến tính làm tăng độ xốp, bền nhiệt, diện tích bề mặt và số lượng tâm hoạt