lớn nhất đối với sản phẩm và người tiêu dùng. Ngoài ra, để lựa chọn một loại màng phù hợp, cần phải tính đến khả năng bảo vệ có được cũng như độ bền, khả năng hàn gắn, độ trong, tính dễ gia công, khả năng in nhãn và gradient khí được tạo thành bởi màng kín [70].
Mặc dù nhiều loại màng chất dẻo có khả năng sử dụng cho mục đích bao gói nhưng rất ít loại được sử dụng để bao gói các sản phẩm tươi, thậm chí còn ít loại hơn nữa có tính chất thấm khí phù hợp với MAP. Do hàm lượng O2 trong MAP thường giảm từ 21% ở điều kiện thường xuống còn 2-5% trong bao gói nên điều nguy hiểm là CO2 sẽ tăng từ 0,03% ở điều kiện thường lên 16-19% trong bao gói. Điều này là do có sự tương quan tỷ lệ 1:1 giữa O2 tiêu thụ và CO2 giải phóng. Hàm lượng CO2 cao có thể gây hại cho hầu hết các loại rau quả nên màng bao gói lý tưởng phải để CO2 thoát ra nhanh hơn là O2 thấm vào. Độ thấm CO2 đôi khi phải cao hơn gấp 3-5 lần so với độ thấm O2 tùy thuộc khí quyển mong muốn. Màng lý tưởng phải có các tính chất sau [70-72]:
- Khả năng thay đổi tính chất thấm khí khi tăng nhiệt độ.
- Kiểm soát được tốc độ thấm hơi nước để ngăn chặn sự tích lũy hơi quá bão hòa và ngưng tụ.
- Khả năng cảnh báo cho nguời tiêu dùng khi chất lượng sản phẩm bên trong không ở trạng thái tốt nhất.
- Khả năng chịu nhiệt và ozon tốt.
- Tính phù hợp thương mại và dễ gia công, ứng dụng.
- Không phản ứng với sản phẩm và không gây độc hại.
- Dễ in để có thể ghi nhãn.
Khả năng kéo dài thời hạn sử dụng và bảo quản hoa quả phụ thuộc độ dày màng, hàm lượng phụ gia và kích thước hạt. Hiện nay phương pháp sản xuất màng MAP với việc đưa vào các phụ gia để điều chỉnh độ thấm khí qua màng được nghiên cứu và áp dụng khá nhiều.
A- Giới thiệu về polyetylen (PE)
a. Polyetylen [73]
Polyetylen (PE) là tên gọi thông thường của họ polyme bán tinh thể được ứng dụng rộng rãi như một loại nhựa dẻo. PE là các polyme mạch thẳng với các
phân tử etylen tạo thành một khối, hầu hết các phân tử PE là các polyme mạch nhánh, trong một số trường hợp, cấu trúc của PE có thể được biểu diễn theo công thức sau:
-(CH2-CH2)xnhánh 1-(CH2-CH2)y-( CH2-CH2)z- nhánh 2-…
Ở đây: các nhóm CH2-CH2 được tạo thành từ etylen, các giá trị x, y, z có thể thay đổi từ 4 hoặc 5 đến 100. Điều này cho phép sản xuất được nhiều loại PE có trọng lượng phân tử và các nhánh khác nhau trong công nghiệp.
b. Phân loại các loại nhựa PE
Sự phân loại các loại nhựa PE dựa trên hai thông số có thể dễ dàng xác định trong những năm 1950 với những thiết bị đơn giản: tỷ trọng của PE và chỉ số nóng chảy.
Bảng 1.5. Phân loại các loại nhựa PE
Kí hiệu | Tỷ trọng g/cm3 | |
PE trọng lượng phân tử cao | HDPE | ≥ 0,941 |
PE trọng lượng phân tử trung bình | MDPE | 0,926-0,94 |
PE mạch thẳng trọng lưọng phân tử thấp | LLDPE | 0,915-0,925 |
PE trọng lượng phân tử thấp | LDPE | 0,91-0,94 |
PE trọng lượng phân tử rất thấp | VLDPE | 0,915-0,88 |
Có thể bạn quan tâm!
-
 Nghiên cứu chế tạo và tính chất của màng polyme ứng dụng để bảo quản quả - 1
Nghiên cứu chế tạo và tính chất của màng polyme ứng dụng để bảo quản quả - 1 -
 Nghiên cứu chế tạo và tính chất của màng polyme ứng dụng để bảo quản quả - 2
Nghiên cứu chế tạo và tính chất của màng polyme ứng dụng để bảo quản quả - 2 -
 Bảo Quản Rau Quả Bằng Bao Gói Khí Quyển Biến Đổi
Bảo Quản Rau Quả Bằng Bao Gói Khí Quyển Biến Đổi -
 Cơ Chế Chuyển Pha Từ Dạng Lớp Sang Dạng Lục Lăng
Cơ Chế Chuyển Pha Từ Dạng Lớp Sang Dạng Lục Lăng -
 Các Nghiên Cứu Bảo Quản 2 Loại Quả Được Đề Cập
Các Nghiên Cứu Bảo Quản 2 Loại Quả Được Đề Cập -
 Tình Hình Nghiên Cứu Rau, Quả Sau Thu Hoạch Ở Việt Nam
Tình Hình Nghiên Cứu Rau, Quả Sau Thu Hoạch Ở Việt Nam
Xem toàn bộ 178 trang tài liệu này.
c. Tổng hợp và cấu trúc của PE
+ Tổng hợp PE:
Polyetylen có thể được tổng hợp theo cơ chế trùng hợp gốc tự do hay theo cơ chế ion.
- Trùng hợp gốc: sử dụng các chất khơi mào có khả năng phân huỷ tạo gốc tự do (peoxit, pesunfat, hợp chất azo…).
Phản ứng:
R● + CH2= CH2 € R- CH2- CH2● (3) R- CH2- CH2● + n CH2= CH2 € R- ( CH2CH2-)n CH2- CH2● (4)
Phản ứng chuyển mạch xảy ra dễ dàng.
Phản ứng toả ra nhiều nhiệt, nhiệt lượng này lớn hơn nhiều so với các loại monome khác. Do vậy, nhiệt lượng này phải tách khỏi môi trường phản ứng.
- Trùng hợp ion: sử dụng các xúc tác Ziegler-Natta. Khối lượng phân tử của polyme thu được phụ thuộc vào nồng độ xúc tác, loại xúc tác và tỷ lệ của các cấu tử…
+ Cấu trúc của PE:
PE có cấu trúc mạch thẳng, dài. Ngoài ra, còn có những mạch nhánh. Nếu mạch nhánh càng nhiều và càng dài thì độ kết tinh càng kém.
CH2 CH2 CH
(CH2)m CH3
CH2
CH2( CH2)n CH2
Độ kết tinh khác nhau là nguyên nhân làm cho tỷ trọng của PE khác nhau và ảnh hưởng đến các tính chất như độ bền kéo đứt, mođun đàn hồi khi uốn, độ bền va đập, độ thấm khí và hơi…
d. Tính chất của PE.
+ Tính chất vật lý: PE là một polyme nhiệt dẻo, có cấu trúc tinh thể với mức độ kết tinh thường nhỏ hơn 100%. Mức độ kết tinh phụ thuộc vào phương pháp sản xuất và nhiệt độ. Mức độ kết tinh của HDPE khoảng 75÷95%, của MDPE khoảng 65÷75% và của LDPE khoảng 50÷60%. Mức độ kết tinh ảnh hưởng rất lớn đến các tính chất của polyme. Cũng giống như các parafin, PE cháy chậm và cháy với ngọn
lửa yếu không có tàn. Nếu như không có O2, PE có khả năng ổn định nhiệt đến nhiệt độ 2900C. Trong giới hạn 290÷3300C, thì nó bắt đầu bị phân huỷ thành các polyme
khối lượng phân tử thấp dưới dạng sáp, khi ở nhiệt độ cao hơn thì nó bị phân huỷ thành các phân tử thấp ở dạng lỏng và các hợp chất dạng khí như H2, CO, CO2, etylen, etan…
+ Tính chất cơ học: Tính chất cơ học của PE phụ thuộc vào khối lượng phân tử và mức độ kết tinh của nó. HDPE cứng và bền hơn LDPE do mức độ kết tinh cao hơn và mạch cân đối hơn. Tính chất cơ học của PE không những phụ thuộc vào khối lượng phân tử và mức độ kết tinh mà độ bền kéo đứt và độ bền uốn của nó tăng rõ rệt khi giảm nhiệt độ.
+ Tính chất nhiệt: Nhiệt độ làm thay đổi một số tính chất cơ lý PE nhất là kích thước và độ cứng của sản phẩm. Nó có hằng số dãn nở nhiệt khá cao (1,8.10-4). Các tính chất nhiệt của PE phụ thuộc nhiều vào khối lượng phân tử và mức độ kết tinh. HDPE có khả năng chịu được nhiệt độ tốt hơn LDPE. Cũng như các polyme tinh thể khác nhiệt độ chảy mềm của PE dao động khoảng nhỏ 3÷50C.
+ Tính chất điện: PE là một polyme không phân cực, tính chất cách điện của nó không phụ thuộc vào nhiệt độ và độ ẩm.
+ Tính chất hoá học: Ở điều kiện thường, PE bền với các axit sunfuric, axit nitric loãng, axit clohiđric, axit photphoric, axit axetic, amoniac… Ở 1000C, nó không bền với axit sunfuric đặc và axit nitric đặc.
e. Ứng dụng của PE.
Do tính chất cơ, lý và hoá học tốt nên PE được sử dụng trong nhiều lĩnh vực kỹ thuật. Dùng trong kỹ thuật điện, kỹ nghệ nhẹ, màng mỏng, sợi, màng bảo vệ các sản phẩm đúc, sản phẩm tạo hình… Ngoài ra, nhựa PE còn được sử dụng trong lĩnh vực bao gói thực phẩm cũng như dùng để bao gói bảo quản các loại hoa quả sau khi thu hái.
Trên cơ sở các tính chất của PE, và với nội dung của luận án là chế tạo màng bao gói khí quyển biến đổi chúng tôi đã lựa chọn được nhựa cho mục đích chế tạo MAP là LDPE do nó có trọng lượng phân tử phù hợp cho yêu cầu nghiên cứu.
B- Giới thiệu về các phụ gia vô cơ
a. Zeolit
Có nhiều cách định nghĩa khác nhau về zeolit nhưng một cách chung nhất, zeolit có thể được định nghĩa như sau: “Zeolit là các aluminosilicat có cấu trúc mạng tinh thể chứa đựng bên trong nó một hệ thống mao quản rất đồng đều”.
Thành phần hóa học của zeolit có thể được biểu diễn bằng công thức hóa học như sau:
Mx/n [(AlO2)x(SiO2)y]zH2O
Trong đó: M: là cation kim loại có hoá trị n
y/x: là tỷ số nguyên tử Si/Al ( thay đổi tuỳ theo từng loại zeolit)
z: là số phân tử H2O kết tinh trong zeolit
Kí hiệu trong [ ] là thành phần cơ bản của một ô mạng cơ sở tinh thể.
Sự hình thành cấu trúc zeolit [74]
Đơn vị cơ bản của zeolit là tứ diện TO4 bao gồm một cation T (T là cation Si4+ hoặc Al3+) được bao quanh bởi 4 ion O2- (hình 1.2). Khác với tứ diện SiO4 trung hoà về điện, mỗi một nguyên tử Al phối trí tứ diện trong AlO4 còn dư một điện tích âm do Al có hoá trị 3. Điện tích âm này được bù trừ bởi các cation kim loại Mn+ (M thường là kim loại kiềm hoặc kiềm thổ).
_
O2
_
O2
_
o Al3+
O2
_
O2
_
O2
_
O2
_
o Si4+
O2
_
O2
_
Hình 1.2. Đơn vị cấu trúc cơ bản của zeolit
Sự kết hợp giữa các tứ diện TO4 hoặc các SBU phải tuân theo quy tắc Lowenstein: trong cấu trúc zeolit không tồn tại các liên kết Al-O-Al, mà chỉ tồn tại các liên kết Si-O-Si và Si-O-Al, do đó tỷ số SiO2/Al2O3 ≥ 2.
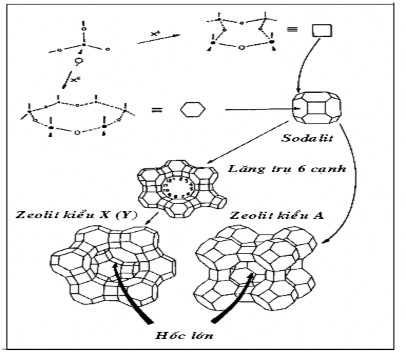
Hình 1.3. Sơ đồ minh họa sự hình thành cấu trúc zeolit
Hình 1.3 là sơ đồ minh họa sự hình thành các liên kết SBU, cách ghép nối các SBU để tạo ra bát diện cụt (sodalit) và cách ghép nối các bát diện cụt với nhau để tạo thành các kiểu cấu trúc zeolit A hoặc Y.
Một vài tính chất của zeolit [75]
Zeolit có những tính chất hoá lý cơ bản giữ vai trò quan trọng đối với hoạt tính xúc tác là tính hấp phụ, tính trao đổi ion, tính axit và tính chọn lọc hình dạng.
● Tính chất hấp phụ: Các zeolit hydrat hoá có diện tích bề mặt bên trong chiếm trên 90% tổng diện tích bề mặt nên phần lớn quá trình hấp phụ xảy ra ở bên trong hệ thống mao quản, khả năng hấp phụ bề mặt ngoài là không đáng kể. Tinh thể zeolit có khả năng hấp phụ thuận nghịch mà không bị biến đổi về cấu trúc hình học cũng như độ tinh khiết. Khả năng hấp phụ của zeolit được đánh giá thông qua hai thông số là dung lượng hấp phụ và tốc độ hấp phụ. Dung lượng hấp phụ phụ thuộc vào tính chất bề mặt và kích thước mao quản của zeolit còn tốc độ hấp phụ phụ thuộc vào kích thước phân tử của chất bị hấp phụ cũng như kích thước mao quản của zeolit.
● Tính chất trao đổi ion: Cation bù trừ điện tích trong zeolit rất linh động nên chúng có khả năng bị thay thế bởi các cation khác bằng cách trao đổi ion. Khả năng trao đổi cation của zeolit phụ thuộc vào các yếu tố sau: đặc tính cấu trúc của zeolit, bản chất, kích thước, trạng thái, điện tích và nồng độ của cation trao đổi, loại ion liên hợp với cation trong dung dịch trao đổi, dung môi và nhiệt độ trao đổi. Dung lượng cation trao đổi trong zeolit liên quan trực tiếp tới hàm lượng nhôm trong tinh thể, khi hàm lượng nhôm tăng thì số cation bù trừ điện tích tăng nên dung lượng cation trao đổi tăng.
● Tính chất axit: Zeolit ở dạng trao đổi H+ hoặc các cation kim loại đa hoá trị
Mn+ (RE3+, Cu2+, Mg2+, Ca2+,...) có chứa 2 loại tâm axit là tâm Bronsted và tâm Lewis. Theo F.R.Chen, tâm Bronsted có thể được hình thành theo các cách sau:
- Phân huỷ nhiệt zeolit đã trao đổi cation với NH4+:
Na+
O
Si Al
NH +
4
_ Na+
NH +
Al
4
O
Si
300-500oC
_ NH3
H O
Si Al
(5)
- Xử lý zeolit trong môi trường axit (đối với các zeolit bền có tỷ số Si/Al
cao):
Na+
O
Si Al _
HCl NaCl
H+
O
Si Al
H O
Si Al
(6)
- Thuỷ phân cation đa hoá trị ở nhiệt độ cao:
(n-1)+ H
_ [Me(H2O)x-1OH]
Al
n+ O O + O
(7)
[Me(H2O)x] +
n Si Al
(n-1) Si
Si Al
- Khử ion kim loại chuyển tiếp:
_ H
+
n
Si
n+ O
Me Al
+ nH2 2
Meo + n
O
Si Al
(8)
Tâm Lewis được hình thành do quá trình tách một phân tử nước ở nhiệt độ cao, tạo một tâm Lewis từ 2 tâm Bronsted:
H
O
2 Si Al
> 400oC
Si+ Al +
O
Si Al
_
+ H2O
(9)
T©m Bronsted T©m Lewis
Cả hai loại tâm Bronsted và Lewis đều góp phần tạo nên hoạt tính của zeolit, trong đó tâm Bronsted có vai trò quyết định còn tâm Lewis có tác dụng phân cực nhóm hydroxyl, làm tăng lực axit của tâm Bronsted.
● Tính chất chọn lọc hình dạng: Chọn lọc hình dạng là sự điều khiển theo kích cỡ và hình dạng của phân tử khuếch tán vào và ra khỏi hệ thống mao quản, làm ảnh hưởng đến hoạt tính và độ chọn lọc của xúc tác. Người ta phân biệt 3 hình thức
chọn lọc hình dạng như sau: Chọn lọc chất tham gia phản ứng; chọn lọc sản phẩm phản ứng và chọn lọc hợp chất trung gian.
b- Silica [76]
Trong những năm qua, các vật liệu vi mao quản đã được ứng dụng rất rộng rãi và có hiệu quả trong nhiều quá trình hóa học. Tuy nhiên, do kích thước mao quản nhỏ nên chúng còn nhiều hạn chế. Do vậy, để tăng cường hơn nữa khả năng ứng dụng của vật liệu vi mao quản, đã có nhiều công trình nghiên cứu nhằm tăng kích thước mao quản. Trong những năm gần đây, hướng nghiên cứu được chú ý nhất là tổng hợp những vật liệu có kích thước mao quản trung bình (MQTB).
Theo định nghĩa của IUPAC, vật liệu vô cơ rắn chứa các mao quản có đường kính trong khoảng 2-50nm được gọi là vật liệu MQTB.
Các loại vật liệu MQTB có thể được phân loại theo những tiêu chuẩn khác
nhau:
- Phân loại vật liệu MQTB theo cấu trúc:
+ Cấu trúc lục lăng (ví dụ như MCM-41, SBA-15)
+ Cấu trúc lập phương (ví dụ như MCM-48, SBA-16)
MCM-41
+ Cấu trúc lớp (ví dụ như MCM-50)


MCM-48 MCM-50
Hình 1.4. Các dạng cấu trúc của vật liệu MQTB
Cấu trúc của họ vật liệu MQTB có nhiều dạng, tuỳ thuộc vào bản chất và nồng độ của chất hoạt động bề mặt (HĐBM) được sử dụng mà chúng có các cấu trúc khác nhau.
• Cơ chế độn lớp
Na+ H+ Na+ H+
Chất HĐBM- Na+ HĐBM- H+ Độn lớp
Hình 1.5. Cơ chế độn lớp