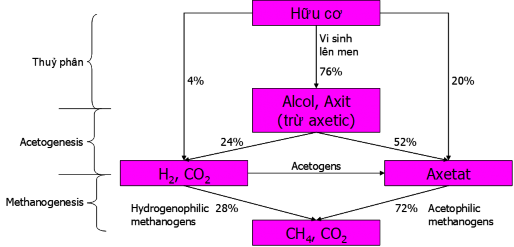
Hình 1. 1. Sơ đồ các quá trình chuyển hóa bằng vi sinh Yếm khí [16].
Khi trong hệ có amoni, sau khi chất hữu cơ bị ôxi hoá gần hết (BOD còn khoảng 10÷30 mg/L) sẽ xảy ra sự ôxi hoá amoni trước hết thành nitrit, sau thành nitrat. Phản ứng nối tiếp như sau:
NH4+ + 1,5O2 NO2– + 2H+ + H2O + 84 kcal.mol-1 (2) NO2– + 0,5O2 NO3– + 17 kcal.mol-1 (3)
Phương trình tổng là:
NH4+ + 2O2 NO3– + 2H+ + H2O (4)
Theo đó, 1 mol NH4+ tiêu thụ 2 mol O2 hay 1 g N-NH4+ tiêu thụ 4,57 g O2; 1 mol NH4+ tạo thành 1 mol NO3- và 2 mol H+; lượng H+ tạo ra phản ứng với độ kiềm HCO3-, 1g N-NH4+ tiêu thụ 7,14 g độ kiềm (quy về CaCO3).
(ii) Các quá trình yếm khí:
Phương trình tổng của phản ứng yếm khí phân huỷ chất hữu cơ như sau: CcHhOoNnSs + 1/4(4c–h–2o+3n+2s) H2O
1/8(4c –h+2o+3n+2s) CO2 + 1/8(4c + h – 2o – 3n – 2s) CH4 + nNH3 + sH2S (5)
Tính chung cho các chất thải, quá trình YK bao gồm 3 giai đoạn với sản phẩm cuối là biogas (CH4 + CO2) được mô tả bằng sơ đồ rút gọn như Hình 1.1, thành phần khí (được gọi là biogas-khí sinh học) và giá trị nhiệt lượng phụ thuộc vào thành phần đầu vào và được cho ở Bảng 1.5.
Bảng 1. 5. Sự phụ thuộc thành phần biogas và dự trữ năng lượng vào thành phần thải [16]
V tạo thành, cm3/g | Biogas | |||
%CH4 | %CO2 | Thiêu nhiệt kWh/m3(d) | ||
Cacbonhyđrata | 746,7 | 50 | 50 | 4,95 |
Chất béob | 1434 | 71 | 29 | 7,02 |
Đạm | 636 | 60 | 40 | 5,93 |
Có thể bạn quan tâm!
-
 Nghiên cứu chế tạo Eco-Bio-Block EBB cải tiến và đánh giá hiệu quả xử lý các chất hữu cơ và amoni trong một số nguồn nước thải - 2
Nghiên cứu chế tạo Eco-Bio-Block EBB cải tiến và đánh giá hiệu quả xử lý các chất hữu cơ và amoni trong một số nguồn nước thải - 2 -
 Giá Trị Thực Tế Và Ứng Dụng Các Kết Quả Của Luận Án
Giá Trị Thực Tế Và Ứng Dụng Các Kết Quả Của Luận Án -
 Hiện Trạng Các Công Trình Xử Lý Nước Thải Ở Việt Nam
Hiện Trạng Các Công Trình Xử Lý Nước Thải Ở Việt Nam -
 Sơ Đồ Quá Trình Loại Bỏ Cod Và Ni Tơ Bằng Vi Sinh: (A) Anoxic Trước; (B) Anoxic Sau; (C) 2 Giai Đoạn Nitrat Hóa Và Khử Nitrat Độc Lập; (D) Quá Trình
Sơ Đồ Quá Trình Loại Bỏ Cod Và Ni Tơ Bằng Vi Sinh: (A) Anoxic Trước; (B) Anoxic Sau; (C) 2 Giai Đoạn Nitrat Hóa Và Khử Nitrat Độc Lập; (D) Quá Trình -
 Tổng Quan Ebb Và Lựa Chọn Vật Liệu Chế Tạo Ebb Cải Tiến
Tổng Quan Ebb Và Lựa Chọn Vật Liệu Chế Tạo Ebb Cải Tiến -
 So Sánh Giữa Vật Liệu Ebb Cải Tiến Và Ebb Nhập Khẩu
So Sánh Giữa Vật Liệu Ebb Cải Tiến Và Ebb Nhập Khẩu
Xem toàn bộ 143 trang tài liệu này.
aTính cho đường hexoza; bTính cho triglixerit với 3 mol axit palmitic; cTính cho polyalanin với sự phân huỷ N thành NH4+ rồi thành (NH4)2CO3
Để so sánh với quá trình chuyển hóa hiếu khí ta cũng xét sơ đồ chuyển hoá chất chuẩn là glucô Hình 1.2.
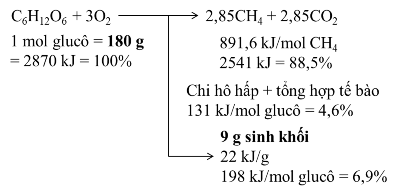
Hình 1. 2. Cân bằng chất và năng lượng trong quá trình vi sinh yếm khí. [16]
Theo sơ đồ 1.2 thì từ 1 mol (180g) glucô có dự trữ nhiệt = 2870 kJ khi chuyển hóa sẽ tạo thành 2,85 mol CH4 (dự trữ nhiệt = 891,6 kJ/mol×2,85mol = 2541 kJ) + 2,85 mol CO2 (dự trữ nhiệt = 0) + 9 gam sinh khối (dự trữ nhiệt 22 kJ/gam × 9 gam
= 198 kJ); tổn thất năng lượng dưới dạng nhiệt xảy ra trong quá trình chuyển hóa ATP chỉ bằng 131 kJ = 4,6%. Như vậy, quá trình yếm khí là quá trình từ chất thải sinh ra năng lượng chủ yếu ở dưới dạng biogas là hỗn hợp khí CH4 + CO2 (~88,5% tổng năng lượng đầu vào). Ngoài ra còn một lượng nhỏ tích lũy dưới dạng 9 gam sinh khối mới (~6,9%), tổn thất dưới dạng nhiệt năng chiếm khoảng 4,6%. So sánh hai quá trình Yếm khí và Hiếu khí ta thấy:
- Yếm khí chậm hơn hiếu khí nhiều: ít tạo sinh khối
- Yếm khí không xử lí được tới chất lượng đầu ra cao, chỉ áp dụng như phương tiện tiền xử lí
- Yếm khí thuận lợi vì sinh ít bùn, giảm chi phí xử lí bùn
- Yếm khí thu hồi năng lượng, rất quan trọng trong bối cảnh khủng hoảng năng lượng, biogas được coi là nguồn năng lượng tái tạo
- Yếm khí sinh ra amoni, photphat nên không phải là phương tiện xử lí N, P; có tiềm năng thu hồi N, P.
(iii) Các quá trình thiếu khí:
Về khía cạnh xử lí nước các quá trình thiếu khí (DO ~ 0 mg/L) rất quan trọng về khía cạnh khử nitrat, nitrit. Trước hết quá trình này cần chất khử (cho điện tử), ví dụ:
CH3OH + H2O CO2 + 6H+ + 6e– (6)
CH3COOH + 2H2O 2CO2 + 8H+ + 8e– (7)
N-nitrat sẽ nhận điện tử và lần lượt qua các trạng thái sau: 2e- e- e- e-
NO3– NO2– NO 0,5N2O 0,5N2 (8)
Như vậy tuỳ chất cho điện tử, ta có các phương trình ví dụ như sau: 5CH3OH + 6HNO3 5CO2 + 3N2 + 13H2O (9)
5CH3COOH + 8HNO3 10CO2 + 4N2 + 14H2O (10)
Chất cho điện tử cũng có thể là chính hữu cơ trong nước thải.
b. Về khía cạnh kỹ thuật xử lý:
Các kỹ thuật xử lý nước thải: Tùy yêu cầu chất lượng nước sau xử lí, công nghệ vi sinh xử lí nước thải thường được phân cấp như sau: (i’) Xử lí cấp 1 (bao gồm cả tiền xử lí); (ii’) Xử lí cấp 2; và (iii’) Xử lí cấp 3 (nâng cao).
(i’) Xử lí cấp 1: (bao gồm cả tiền xử lí) thường là các công đoạn, đôi khi rất đơn giản như lược rác, lắng cát mang tính hỗ trợ, loại bỏ những yếu tố cơ học (rác, cát sạn có thể gây tắc, hỏng bơm và hệ van, ống), điều hòa làm tăng độ tin cậy và ổn định của các đơn vị xử lí đi sau. Lắng cấp 1, trong trường hợp nước thải đầu vào quá đậm đặc (COD trên 1000 mg/L) có thể áp dụng cả các kĩ thuật yếm khí làm giảm tải cho xử lí cấp hai. Xử lí cấp 1 khó đạt các QCVN về môi trường.
(ii’) Xử lí cấp 2 thường là công nghệ sinh học để xử lí các ô nhiễm hữu cơ. Công nghệ sinh học là công nghệ xử lí ô nhiễm sinh thái nhất, hầu như không sử dụng hoá chất, nước thải sau xử lý có thể đạt chất lượng rất cao. Quá trình thường dùng là quá trình sinh học hiếu khí. Chất thải duy nhất là bùn vi sinh (sinh khối). Xử lí cấp 2 thường đạt QCVN loại B, đôi khi đạt loại A về các chỉ tiêu hữu cơ (BOD/COD) nhưng không xử lí được N, P và một số thông số khác. Kĩ thuật xử lí cấp 2 thường là kĩ thuật bùn hoạt tính cổ điển (bùn hoạt tính).
Với quá trình hiếu khí, vi sinh hiếu khí thực hiện đồng thời hai quá trình: Đồng hoá sử dụng các cơ chất chứa các nguyên tố C,H,O,N,P, vi lượng có trong nước thải để tổng hợp tế bào với công thức gần đúng C5H7NO2 và Dị hoá là ôxi hoá các chất hữu cơ và các chất có khả năng ôxi hoá khác để tạo năng lượng sử dụng cho các hoạt động sống. Các nội dung này được thể hiện ở cân bằng cacbon như Hình 1.3. Kết quả là nước giảm các chất ô nhiễm và sinh khối tăng. Để thực hiện điều này trong thực tế xử lí nước thải phải áp dụng các kĩ thuật sao cho hệ vi sinh có điều kiện thực hiện tốt các chức năng đã nêu, đồng thời phải tách được lượng bùn dư hình thành. Kĩ thuật bùn hoạt tính ra đời đáp ứng được các yêu cầu này, quá trình bùn hoạt tính được nghiên cứu phát triển bắt đầu khoảng năm 1913 bởi Clark and Gage tại Lawrence Experiment Station tại Massachusetts và Ardern and Lockett (1914) tại Davyhulme Sewage Works, Manchester (nước Anh) [17].
Các quá trình vi sinh hiếu khí bao gồm hai quá trình chính được thể hiện ở hai phương trình dưới đây:
(i) Quá trình ôxi hóa phân hủy các chất ô nhiễm hữu cơ:
(4/100)C10H19NO3 + (25/100)O2 + (1/100)NH4+ + (1/100)HCO3
(16/100)CO2 + (23/100)H2O + (5/100)C5H7NO2 (11)
Ở đây: C10H19NO3 là công thức nước thải sinh hoạt gần đúng, C5H7NO2 là công thức vi sinh gần đúng. Nghiên cứu nhận thấy ở vế trái của phương trình là nhu cầu tối thiểu các chất mà vi sinh cần có để thực hiện quá trình, vế phải của phương trình là các sản phẩm CO2 + H2O không gây ô nhiễm nước và sản phẩm phụ C5H7NO2
- là bùn (sinh khối vi sinh cần phải tách loại).
Hình 1. 3. Cân bằng vật chất cacbon (BOD5) trong sinh học hiếu khí
(ii) Quá trình nitrat hóa (ôxi hóa) N-amoni:
Nếu phản ứng hiếu khí phân hủy hữu cơ (pt.1) được thực hiện đủ sâu sẽ xảy ra quá trình tiếp theo là nitrat hóa:
(11/20)NH4+ + (15/20)O2 + (4/20)CO2 + (1/20)HCO3
(10/20)NO3+ (20/20)H+ + (9/20)H2O + (1/20)C5H7NO2 (12)
Nghiên cứu nhận thấy sản phẩm của quá trình là N-NO3và sinh khối đi kèm. Điều kiện của phản ứng này là phải cấp đủ DO (ôxi hòa tan) và nguồn cácbon vô cơ (độ kiềm). Nếu xem xét kĩ hơn sẽ thấy (12) là tổng của hai quá trình: trước tiên NH4+ sẽ được ôxi hóa thành NO2(quá trình nitrit hóa được thực hiện bởi tập hợp các chủng Nitrosomonas), tiếp theo NO2sẽ được ôxi hóa tiếp thành NO3(quá trình nitrat hóa được thực hiện bởi tập hợp các chủng Nitrobacter). Để đơn giản hóa ta thể hiện hai quá trình này dưới dạng phương trình tổng (12).
Trong thực tế N-amôni được xử lí qua hai giai đoạn: nitrat hóa (pt.2) và tiếp theo khử nitrat sinh ra theo (pt.3), ở đây không có ôxi nên quá trình này được gọi là quá trình thiếu khí:
(iii) Quá trình thiếu khí khử nitrat bằng chất cho điện tử là hữu cơ trong nước
thải:
(1/5)NO3+ (0,5/50)NH4+ + (2/50)C10H19NO3 + (0,5/50)HCO3+ (1/5)H+
(8/50)CO2 + (5/50)N2 + (16,5/50)H2O + (2,5/50)C5H7NO2 (13)
Trong các hệ bùn hoạt tính, ba phương trình trên là đủ khái quát quá trình xử
lí nước thải đối với các thành phần hữu cơ (thể hiện qua COD và BOD5) và N (thể
hiện qua N-amôni và N-nitrat). Nếu thực hiện cả quá trình khử nitrat nghĩa là làm giảm tổng N (pt.3) ta có mức xử lí cấp 3 về khía cạnh T-N.
Kết quả của quá trình hiếu khí ở (11) là các chất ô nhiễm hữu cơ bị phân hủy thành CO2 + H2O, giảm các thông số BOD/COD nghĩa là quá trình (11) chỉ xử lí ô nhiễm hữu cơ, quá trình này chỉ được thực hiện tốt khi DO 2mg/L. Nếu tiếp tục sục khí cấp ôxi, quá trình nitrat hóa sẽ được thực hiện (12), khi đó N-amôni sẽ chuyển hóa thành N-nitrit rồi thành N-nitrat. Để thực hiện phản ứng (12) hệ cần được cấp đủ DO như trên và độ kiềm (HCO3-). Một số hệ xử lí cấp 2 cũng đạt đến mức độ nitrat hóa này.
Các quá trình đã nêu sẽ được VSV thực hiện hoàn hảo khi các điều kiện sống của chúng được đảm bảo, đó là các điều kiện về: pH (phải trung tính hoặc gần); không có chất độc hoặc có ở mức không nguy hiểm (các kim loại nặng, nhiều loại hóa chất); tỷ lệ các chất (tỷ lệ C:N:P) tạo nên tế bào vi sinh, mật độ vi sinh phải phù hợp; phải có đầy đủ các nguyên tố vi lượng; nồng độ ôxi (DO), nhiệt độ phù hợp… Trong các điều kiện kể trên thì nước thải từ quá trình nuôi tôm STC đáp ứng hầu hết các yêu cầu đối với quá trình VSV. Ở đây nhu cầu hóa chất là tối thiểu, chi phí cơ bản là điện năng thực hiện các công tác cấp khí và vận hành các bơm, máy khuấy, chi phí xử lí bùn … Đây là lí do chính để lí giải tại sao công nghệ vi sinh luôn là sự lựa chọn hàng đầu. Chi phí vận hành chủ yếu là chi phí nhân công, điện năng, chi phí sát trùng và xử lí sản phẩm phụ (luôn có) là bùn – chủ yếu là sinh khối dư phát sinh do bản chất quá trình chuyển hóa.
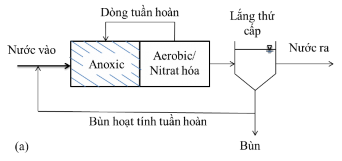
Để hiện thực hóa các quá trình trên một cách hiệu quả nhất người ta đã phát minh ra hàng loạt các kĩ thuật, trong đó thuộc lâu đời nhất, hoàn chỉnh nhất về mặt lí luận và phổ biến nhất là công nghệ bùn hoạt tính. Bản thân công nghệ là khái niệm bao gồm các quá trình cần thực hiện và hệ thống thiết bị, kĩ thuật phù hợp để thực hiện các quá trình đó. Về khía cạnh này bùn hoạt tính sẽ được thực hiện theo sơ đồ công nghệ Hình 1.4.
Theo sơ đồ Hình 1.4, nước thải lần lượt phải trải qua các bước (các đơn vị xử lí) sau: 1) Tách rác, 2) Tách cát, dầu mỡ và rác nổi (điều hòa không thể hiện trên hình, đây được coi là các bước tiền xử lí) 3) Bể lắng cấp một (quy mô nhỏ có thể bỏ
qua, đây được coi là xử lí cấp 1) 4) Bể phản ứng vi sinh 5) Bể lắng cấp hai
6) Sát trùng (không thể hiện trên hình). Đến đây, về nguyên tắc, nước thải đã đạt các tiêu chuẩn về hữu cơ, về sinh học.
Để các quá trình vi sinh trong hệ bùn hoạt tính được thực hiện hoàn hảo, mật độ vi sinh X cần có trong Bồn phản ứng (4) phải ổn định (X thường có các giá trị nằm trong khoảng 2-3 g/L, tối đa là 5g/L). Để ổn định X, bùn lắng từ Bể lắng cấp hai (5) phải được tuần hoàn một phần về đầu vào Bể phản ứng (4), phần bùn dư từ (5) sẽ được tách ra và cùng với bùn từ Bể lắng cấp một (2) đi xử lí bùn hoặc thải bỏ đúng cách.
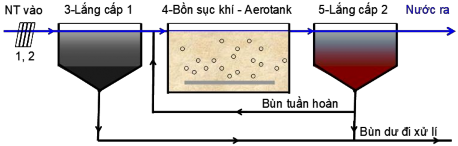
Hình 1. 4. Sơ đồ công nghệ bùn hoạt tính .
Như vậy, trong công nghệ bùn hoạt tính cũng như các công nghệ vi sinh khác chất thải là bùn (phần lớn là sinh khối dư, Vbùn thường = 1-2% tổng thể tích nước thải, chi phí xử lí bùn có thể lên tới 50% tổng chi phí [18]). Tuy nhiên, nếu chỉ thực hiện quá trình như Hình 1.4 thì ngoài tiêu chuẩn về nồng độ hữu cơ (BOD, COD), bùn hoạt tính thông thường không thể đạt được các tiêu chuẩn về N, P. Để xử lý được N, P, quá trình bùn hoạt tính được nâng cấp thành công nghệ bùn hoạt tính tiên tiến (advanced treatment) hoặc xử lí cấp 3.
(iii’) Xử lí cấp 3 Khử nitrat:
Để khử N-nitrat và ở mức độ ít hơn nhiều là N-nitrit theo quá trình - phương trình (13) thì DO cần tiệm cận 0, vì lí do này quá trình này còn được gọi là thiếu khí (anoxic). Phản ứng sẽ sinh ra độ kiềm, tiêu thụ các hợp chất cho điện tử (các chất hữu cơ có sẵn trong nước thải hoặc bổ sung, trong một số trường hợp có thể dùng CH4, S, H2). Như vậy, các quá trình (pt.11-13) sẽ đảm bảo xử lí BOD/COD và N.
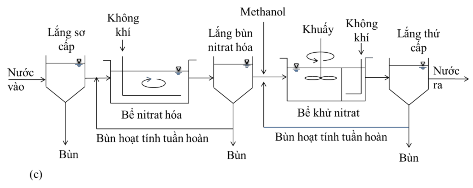
Khi đó, phải thực hiện hai nội dung: Một là, trước Bể phản ứng hiếu khí (4) phải bố trí thêm Bể phản ứng thiếu khí để thực hiện quá trình khử nitrat (pt.3); Hai là, mở rộng Bể phản ứng hiếu khí (4) để phản ứng nitrat hóa (pt.2) thực hiện được sâu hơn, sau đó một phần nước thải sau nitrat hóa sẽ được tuần hoàn trở về Bể thiếu khí để thực hiện phản ứng (pt.3) với chất khử-cho điện tử là chất hữu cơ sẵn có trong nước thải đầu vào. Một số mô hình hệ thống được áp dụng như Hình 1.5.
Dùng anoxic phía sau được thiết kế như một bước khử nitrat tăng cường. Trong quá trình Bardenpho, trên 75% nitrat được loại bỏ ở vùng anoxic phía trước [18]. Nitrat trong nước đầu ra của hệ thống xử lý theo quá trình NdN (nitrat → denitrat) dao động từ 3,0 đến 4,8 mg/L, tổng nồng độ nitơ (TN) dưới 8,0 mg/L [19]. Hình 1.5 là một phương án xử lí COD và TN, kèm theo bể yếm khí phân hủy bùn và thu hồi biogas.
|
|